黄芪甲甙胸腔注射对肺癌小鼠恶性胸腔积液的影响*
武建毅 姚晓祥 朱纪华 朱麟玉 丁昭珩 黄晓东
恶 性 胸 腔 积 液(malignant pleural effusion,MPE)是晚期肺癌最常见的并发症之一。目前肺癌合并癌性胸腔积液的治疗以胸腔灌注化疗为主,但临床有效率低,相关副反应多[1]。目前对恶性胸腔积液的基础研究表明,多种细胞因子参与其中,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)在癌性胸腔积液中作用明显,它可以改善肿瘤微血管及微淋巴管的通透性,参与胸腔积液形成,抑制VEGF表达可以抑制肿瘤生长、转移和胸腔积液形成[2]。另外,水通道蛋白(aquaporins,AQPs)是存在于细胞膜表面的一类家族蛋白,主要控制水分子等跨膜转运。其中水通道蛋白-1(AQPs-1)研究较为深入,文献[3]报道其与恶性胸腔积液的发生关系密切。黄芪甲苷(astragaloside Ⅳ,AsⅣ)是黄芪中的一种主要成分,现代研究表明它具有诱导癌细胞凋亡,阻止肿瘤新生血管生成、阻止癌细胞转移的活性,可以作为治疗癌性胸腔积液的有效药物深入研究[4]。本课题设计建立小鼠肺癌合并胸腔积液模型,通过胸腔穿刺灌注治疗的方式考察不同浓度的AsⅣ对Lewis肺癌小鼠恶性胸腔积液的治疗效果及抗肿瘤活性,进一步明确其机制,AsⅣ是否对肿瘤新生血管、水通道蛋白有抑制作用,为肺癌胸腔积液的治疗提供实验依据。
1 材料与方法
1.1 一般材料
4周龄BALB/C 小鼠 100只,体重 18~22 g,购于中国科学院细胞研究所。细胞株:小鼠Lewis肺癌细胞株,购于中国医学科学院实验动物研究所。药物与试剂:AsⅣ分子式为C14H68O14,购自成都普瑞法公司。顺铂DDP购自默克公司。细胞培养血清购于上海恒远生物科技有限公司,VEGF ELASIA检测试剂盒购于上海泽叶生物科技有限公司。小鼠的VEGF、AQP-1、二抗购买于abnova公司。
1.2 方法
1.2.1 小鼠Lewis肺癌细胞培养 把小鼠Lewis肺癌细胞株复苏,在37 ℃、5% CO2培养箱中,用含10%胎牛血清的DMEM培养基培养72 h,消化、传代,取对数生长期的细胞,用0.2%台盼蓝染色后,细胞计数板计数,细胞活力95%。
1.2.2 小鼠Lewis肺癌恶性胸腔积液动物模型建立 用无血清培养基将Lewis肺癌细胞稀释后接种于BALB/C小鼠胸腔,第10天处死小鼠并收集胸腔积液,离心取细胞,调整细胞浓度(1.0×106/ml)。取该悬液0.2 ml/只,给100只小鼠胸腔内均接种肿瘤,建立小鼠肺癌恶性胸腔积液动物模型。
1.2.3 实验小鼠分组及给药方法 将100只小鼠按随机数字法分为五组,每组20只。A组:阴性对照,注射0.9%生理盐水(NS)20 ml;B组:阳性对照组,注射顺铂(DDP)0.5 mg/kg;C组:低剂量黄芪甲苷(l-AsⅣ)0.3 mg/kg;D组:中剂量的黄芪甲苷(m-AsⅣ)1.0 mg/kg;E组:高剂量黄芪甲苷(h-AsⅣ)3.0 mg/kg。接瘤 24 h 后采用胸腔穿刺注射药物的给药方式,按照体重给药,1次/d,连续给药 14 d。
1.3 观察指标及评价标准
(1)治疗效果:比较五组治疗效果,包括抑瘤率及细胞存活率、胸腔积液量、瘤细胞数、最大结节直径,用药结束24 h后各组半数小鼠处死,抽取小鼠胸腔积液,记录胸腔积液量,胸腔积液经台盼蓝染色,显微镜下计算瘤细胞数、瘤细胞存活率。细胞存活率=未染色细胞数/细胞总数×100%。解剖死亡小鼠,观察胸腔内肿瘤转移情况,测量胸膜转移瘤最大结节直径,测定抑瘤率,抑瘤率=[A组胸膜转移瘤平均体积-实验组(B、C、D、E组)胸膜转移瘤平均体积]/A组平均体积×100%。(2)VEGF含量:比较五组VEGF含量,末次给药24 h后,收集小鼠胸腔积液0.4 ml,离心取上清,按照ELISA试剂盒说明书进行操作,计算出每份标本中VEGF的浓度。(3)VEGF、AQP-1的表达水平:比较五组VEGF、AQP-1的表达水平,对胸膜转移瘤组织内VEGF、AQP-1的表达水平进行免疫组织化学检测,对处死小鼠的胸腔进行解剖,分离胸膜转移肿瘤的组织,制作石蜡切片,用5%BSA 液封闭,加入一抗:VEGF(1∶100)、AQP-1(1∶100),4 ℃孵育过夜,用PBS漂洗后加入二抗,室温下孵育30 min,漂洗后DAB显色,苏木素复染,脱水并透明后封片。用Image-Pro Plus 7.0软件进行图像分析,计算阳性面积。
1.4 统计学处理
2 结果
2.1 五组治疗效果比较
B、D、E组胸腔积液量均少于A组(P<0.01),瘤细胞存活率和瘤细胞数均低于A组(P<0.01),胸膜转移瘤最大结节直径均小于A组(P<0.01),上述指标都存在剂量依赖性。E组胸腔积液量、瘤细胞存活率、最大结节直径均低于B组,抑瘤率高于B组(P<0.05),见表1。
表1 五组治疗效果比较(±s)
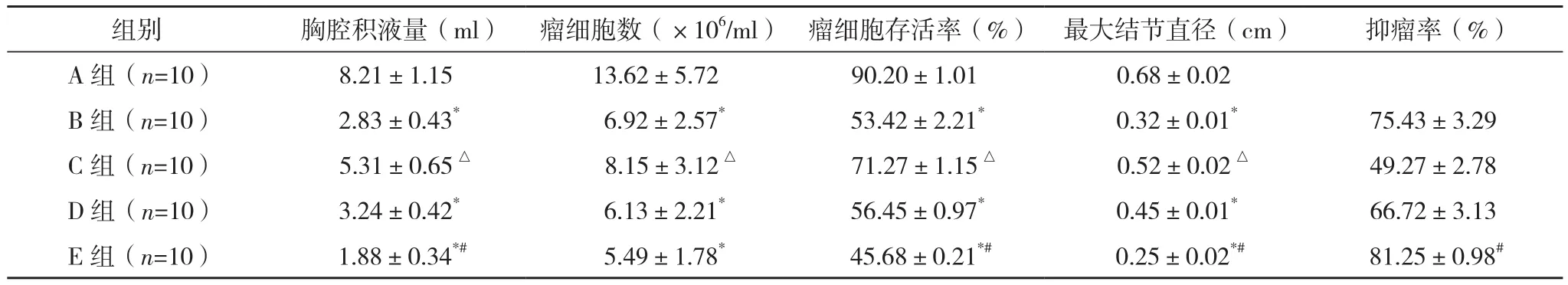
表1 五组治疗效果比较(±s)
*与A组比较,P<0.01;#与B组比较,P<0.05;△与A组比较,P<0.05。
组别 胸腔积液量(ml) 瘤细胞数(×106/ml) 瘤细胞存活率(%) 最大结节直径(cm) 抑瘤率(%)A 组(n=10) 8.21±1.15 13.62±5.72 90.20±1.01 0.68±0.02 B组(n=10) 2.83±0.43* 6.92±2.57* 53.42±2.21* 0.32±0.01* 75.43±3.29 C 组(n=10) 5.31±0.65△ 8.15±3.12△ 71.27±1.15△ 0.52±0.02△ 49.27±2.78 D组(n=10) 3.24±0.42* 6.13±2.21* 56.45±0.97* 0.45±0.01* 66.72±3.13 E 组(n=10) 1.88±0.34*# 5.49±1.78* 45.68±0.21*# 0.25±0.02*# 81.25±0.98#
2.2 五组VEGF含量比较
B、C、D、E组 VEGF含量均低于A组(P<0.01),且存在剂量依赖性,见表2。
表2 五组VEGF含量比较[ng/L,(±s)]
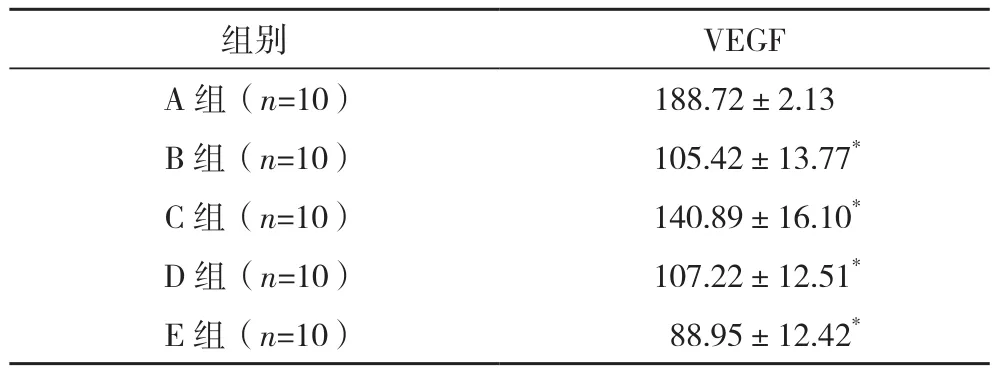
表2 五组VEGF含量比较[ng/L,(±s)]
*与A组比较,P<0.01。
组别 VEGF A组(n=10) 188.72±2.13 B 组(n=10) 105.42±13.77*C 组(n=10) 140.89±16.10*D 组(n=10) 107.22±12.51*E 组(n=10) 88.95±12.42*
2.3 五组Lewis肺癌小鼠胸膜转移瘤组织VEGF、AQP-1表达
B、C、D、E组 VEGF表达 均 低 于 A组(P<0.01);C、D、E组AQP-1蛋白表达均低于A组,差异有统计学意义(P<0.05、<0.05、<0.01),见图1、图2、表3。

图1 五组Lewis肺癌小鼠胸膜转移瘤组织VEGF蛋白表达(×200)

图2 五组Lewis肺癌小鼠胸膜转移瘤组织AQP-1蛋白表达(×200)
表3 五组Lewis肺癌小鼠胸膜转移瘤组织VEGF、AQP-1表达水平比较(±s)

表3 五组Lewis肺癌小鼠胸膜转移瘤组织VEGF、AQP-1表达水平比较(±s)
*与A组比较,P<0.01,#与A组比较,P<0.05。
组别 VEGF AQP-1 A 组(n=10) 729.47±25.22 725.55±35.02 B 组(n=10) 524.71±24.15* 720.42±50.08 C组(n=10) 673.22±35.75* 657.12±65.82#D组(n=10) 558.22±38.33* 625.11±52.72#E组(n=10) 520.35±52.12* 617.52±33.20*
3 讨论
胸腔积液为晚期肺癌常见并发症,此时癌细胞侵犯胸膜,胸腔积液中找到肿瘤细胞。肺癌合并恶性胸腔积液表明疾病已经进展,患者生活质量不佳,预后较差,平均生存期小于6个月。肺癌合并恶性胸腔积液时治疗困难,目前以胸腔灌注治疗为主,但灌注的药物效果不理想[5]。寻找有效的胸腔灌注药物是治疗肺癌合并恶性胸腔积液急需解决的难题。AsⅣ是黄芪中的一种主要成分,现代研究表明它具有诱导癌细胞凋亡,阻止肿瘤新生血管生成、阻止癌细胞转移的活性,可以作为治疗恶性胸腔积液的有效药物深入研究[6-8]。本文的研究中发现胸腔灌注AsⅣ可以使小鼠的恶性胸腔积液明显减少,B、D、E组胸腔积液量均少于A组(P<0.01);恶性胸腔积液中瘤细胞存活率和瘤细胞数均低于A组(P<0.01),胸膜转移瘤最大结节直径均小于A组(P<0.01)。E组胸腔积液量、瘤细胞存活率、最大结节直径均低于B组,抑瘤率高于B组(P<0.05),表明胸腔注射AsⅣ可以抑制恶性胸腔积液中瘤细胞生长,从而使胸膜转移瘤明显缩小,这些作用AsⅣ药物的浓度存在剂量依赖性。表明AsⅣ可以有效抑制瘤细胞的生长,从而减少恶性胸腔积液的生成。
近年来对恶性胸腔积液发生机制的基础研究表明细胞因子在恶性胸腔积液的发生中的起到非常重要的作用。目前研究与恶性胸腹腔积液发生关系密切的细胞因子包括:VEGF和AQPs[9]。VEGF是改善血管、淋巴管通透性重要的细胞因子。研究表明,恶性胸腔积液的发生依赖于VEGF水平,抑制VEGF可以抑制癌性胸腔积液的形成,提示VEGF在癌性胸腔积液的发生中举足轻重。VEGF促进癌性胸腔积液形成的主要机制就是通过增加胸膜毛细血管形成,并使毛细血管通透性增加,导致胸腔积液形成[10]。AsⅣ具有抗肿瘤血管生成的作用,细胞水平的研究证实:AsⅣ可以通过抑制肝癌细胞株VEGF基因的表达,从而使癌细胞侵袭和转移能力的明显下降[11]。本文的研究中发现B、C、D、E组VEGF含量均低于A组(P<0.01),且存在剂量依赖性,说明胸腔灌注AsⅣ后可以使胸腔积液中的VEGF含量明显下降,同时胸膜转移瘤的免疫组化结论为B、C、D、E组VEGF表达均低于A组(P<0.01),AsⅣ可以抑制转移瘤组织内VEGF表达。这可能是AsⅣ抑制Lewis肺癌细胞生长,减少癌性胸腔积液生成的重要机制之一。
AQPs-1是细胞膜表面控制水分子通过的通道蛋白,它与恶性肿瘤的生长、转移和癌性积液的形成关系密切[12]。恶性胸腔积液小鼠模型中的研究表明:当恶性胸腔积液体积不断增加时,肺癌小鼠胸膜组织中AQPs-1基因的表达也不断增加,二者呈正相关。高度提示肺癌合并恶性胸腔积液与AQPs-1关系密切,抑制AQPs-1的表达,可以有效减少恶性胸腔积液[9]。本文中发现C、D、E组AQP-1蛋白表达均低于A组(P<0.05、<0.05、<0.01),说明胸腔灌注AsⅣ后可以抑制转移瘤组织内AQPs-1表达。这可能是黄芪甲甙抑制Lewis肺癌细胞生长,减少癌性胸腔积液生成的另一个重要机制之一。
本研究以肺癌恶性胸腔积液为动物模型,考察胸腔内注射AsⅣ对小鼠肺癌合并恶性胸腔积液的治疗效果。结果表明AsⅣ胸腔注射后,Lewis肺癌细胞的生长得到抑制,恶性胸腔积液的生成减少。这种作用与AsⅣ抑制肿瘤细胞VEGF和AQPs-1的表达有关。本研究为肺癌合并恶性胸腔积液的治疗提供了重要的试验数据,为恶性胸腔积液发生机制的研究和治疗给予启示。

