竹炭基生物炭对茶叶品质和土壤微生物群落结构的影响
张四海 邓先俊 赵承森,* 丁枫华 邱永华 金爱武,*
(1 丽水学院,浙江 丽水 323000;2 遂昌县林业局,浙江 遂昌 323300)
土壤是茶树赖以生存和生长的必要条件。土壤的性状特征和各类营养元素的丰缺直接影响茶树生长和茶叶品质[1]。茶树喜酸性土壤,但只有适宜的土壤pH才是其根系生存的基础[2]。较多研究均指出,茶园土壤酸化、连作障碍等问题是我国茶园普遍存在的现象[3]。研究发现导致茶园土壤酸化的外部原因主要包括酸沉降和铵态氮肥的施用[4]。其根本原因是茶农受到经济利益驱使,盲目追求产量,大量施用化学肥料,虽然茶叶产量得到了提高,但茶叶品质下降,土壤酸化、连作障碍等土壤劣化现象随之出现[5-6]。
生物炭指植物或动物来源的生物质材料在限氧或缺氧条件下,经高温热解炭化而产生的一类具有高度芳香化结构的难溶性有机物[7]。生物炭具有高碳氮比、孔隙结构丰富、比表面积大、理化性质稳定、高土壤阳离子交换量、弱碱性和低密度等性质[8],能够提高土壤pH值及有机碳含量,增强土壤保肥和保水功能,可作为土壤改良剂促进作物生长发育[9]。此外,生物炭可以改善土壤微生态环境,从而有益于土壤中微生物栖息和活动[10],为土壤有益微生物提供保护,特别是菌根真菌[11]。研究表明,生物炭自身特殊的性质可为真菌提供“避难”场所,从而避免种内竞争,对微生物群落结构产生影响[12]。
施用生物炭是修复劣化土壤的重要措施之一。它能有效改善土壤酸度、提高土壤孔隙度、降低土壤容重、提高微生物活性、恢复酸性土壤的生产力,对农业可持续发展和生态环境保护均具有重要意义[2, 13]。本试验通过研究竹炭基生物炭不同施入量对茶园土壤理化性质、土壤酶和微生物群落结构的影响,探讨竹炭施入量与土壤群落结构、真菌/细菌比值、微生物生物量及土壤压力指数的相互关系、变化规律,旨在为病土的生态修复奠定理论基础。
1 材料与方法
1.1 供试材料与试验地概况
供试土壤采于浙江省遂昌县大柘镇新安村现代农业示范基地(28°13′~28°49′N、 118°41′~119°30′E),该基地属中亚热带季风气候,全年四季分明,雨量充沛,山地垂直气候有明显差异,土壤类型为黄红壤。年平均气温16.8℃,极端最高气温40.1℃,极端最低气温零下9.9℃,年均日照达1 346.5~1 847.8 h。该基地以茶叶种植为主,种植茶树的品种为龙井43,由于茶树是多年生植物,连续种植多年后,土壤酸化,茶叶品质下降,连作障碍严重。2017年6月,在该基地采集0~20 cm根际土壤,带回实验室,分类处理用于土壤本底值检测。土样本底值为有机质26.79 g·kg-1,碱解氮251.65 mg·kg-1、有效磷272.60 mg·kg-1、速效钾237.84 mg·kg-1、pH值4.13。试验所用竹炭是毛竹秸秆经过800℃高温炭化,而后过100目筛制备而成;有机肥为市场普通有机肥。竹炭基生物炭为遂昌绿金有机肥有限公司提供,特性如下:有机碳637.65 g·kg-1、 全氮 6.32 g·kg-1、全磷1.35 g·kg-1、全钾5.13 g·kg-1、 pH值9.87、比表面积257. 60 m2·g-1、总孔容积0.21 cm3·g-1。
1.2 试验设计
本试验(持续3年)在基地内设置5个处理,每个处理小区面积为48 m2(宽6 m、长8 m),每个处理3个重复,共计15个小区,试验采用随机区组处理设计。5个处理分别为不施肥对照处理(CK1);有机肥7 500 kg·hm-2对照处理(CK2);有机肥7 500 kg·hm-2+竹炭1 125 kg·hm-2处理(T1);有机肥7 500 kg·hm-2+竹炭粉2 250 kg·hm-2处理(T2);有机肥7 500 kg·hm-2+竹炭粉3 375 kg·hm-2处理(T3)。以上各处理施肥量为一年施肥量。施肥时间为2017年11月9日、2018年11月11日、2019年11月10日,施肥方式采用开沟(沟深15 cm)均匀施肥而后覆土。2020年6月10日取样,在每个小区采用S形取0~20 cm的土样,茶叶采摘时间为2020年4月3日,采摘标准为一芽两叶。
1.3 测定项目与方法
茶叶品质成分测定方法参照GB/T 8303-2013[14]和GB/T 8313-2018[15]。称取50 mg烘干的茶叶样品粉末,利用Xevo TQ-S超高效液相色谱-三重四极杆串联质谱(美国Waters公司)测定。土壤养分指标参考《土壤农化分析(第三版)》[16],采用重铬酸钾外加热法测定有机质含量;采用碱解扩散法测定碱解氮含量;采用FP6410乙酸铵提取-火焰光度计(上海精科仪器有限公司)测定速效钾含量;速效磷采用0.5 mol·L-1NaHCO3浸提-钼锑抗吸光光度法(721分光光度计,江苏孟安仪器设备有限公司);土壤有效锌采用王水消煮,用原子吸收光谱法测定(ICE3000原子吸收光谱仪,上海硅仪生化科技有限公司);土壤阳离子交换量采用氯化钡一硫酸镁交换法测定。土壤过氧化氢酶(peroxidase, PER)活性采用紫外分光光度法(752自动紫外分光光度计,上海菁华仪器有限公司),土壤酸性磷酸酶(acidphosphatase, ACP)活性采用对硝基苯磷酸二钠比色法,脲酶(urease, UR)活性采用苯酚钠一次氯酸钠比色法,蔗糖酶(sucrase, SU)活性采用3,5-二硝基水杨酸比色法测定[17]。
将取回土样滤去杂质过10目筛,以备检测。磷脂脂肪酸(phospholipid fatty acid, PLFA)测定方法在Kontro等[18]的方法上加以改进,通过Agilent 6850气相色谱(美国安捷伦科技公司)进行色谱分析,色谱柱为ULTRA-2(25.0 m×200 μm×0.33 mm),载气为氢气(内标为C19:0)。
磷脂脂肪酸的组成可以指示微生物群落结构及生物量[19]。脂肪酸的命名格式为 X:YωZ(c/t),其中:X为碳原子总数,Y代表不饱和烯键的数目,ω表示甲基末端,Z为烯键或环丙烷链的位置。前缀a(anteiso)和i(iso)分别代表支链的反异构和异构;“cy”代表环丙基支链,后缀“c”和“t”分别代表顺式和反式同分异构体,10Mel表示一个甲基团在距分子末端第10个碳原子上[20],具体各表征分子团见表1。

表1 估算微生物生物量的磷脂脂肪酸Table 1 PLFA for calculating soil microbial biomass
1.4 数据处理
采用 Excel 2003、DPS 和 SPSS 16.0软件对数据进行典型性分析(canonical correlation analysis,CCA)、主成分分析(principe components analysis,PCA)、用冗余分析(redundancy analysis,RDA)和方差分析(analysis of variance,ANOVA)。
2 结果与分析
2.1 不同处理对土壤养分及酶活性的影响
2.1.1 不同处理对土壤养分的影响 由表2可知,随着竹炭添加量的增加,土壤全磷、有效磷和pH值呈现增加的趋势,CK1和CK2处理的pH与添加竹炭处理均具有显著差异,CK1处理的全磷与添加竹炭各处理均具有显著差异。土壤全氮、全钾、碱解氮、速效钾、阳离子交换量均呈现先升高后降低的趋势,CK1和CK2处理的全氮、碱解氮、有效磷、阳离子交换量与添加竹炭处理均呈显著性差异。CK1处理的全钾、有机质和速效钾与其他处理均具有显著差异。全氮、碱解氮、速效钾、阳离子交换量均以T2最高,分别为5.97 g·kg-1、664.60 mg·kg-1、640.67 mg·kg-1和6.26 cmol·kg-1。
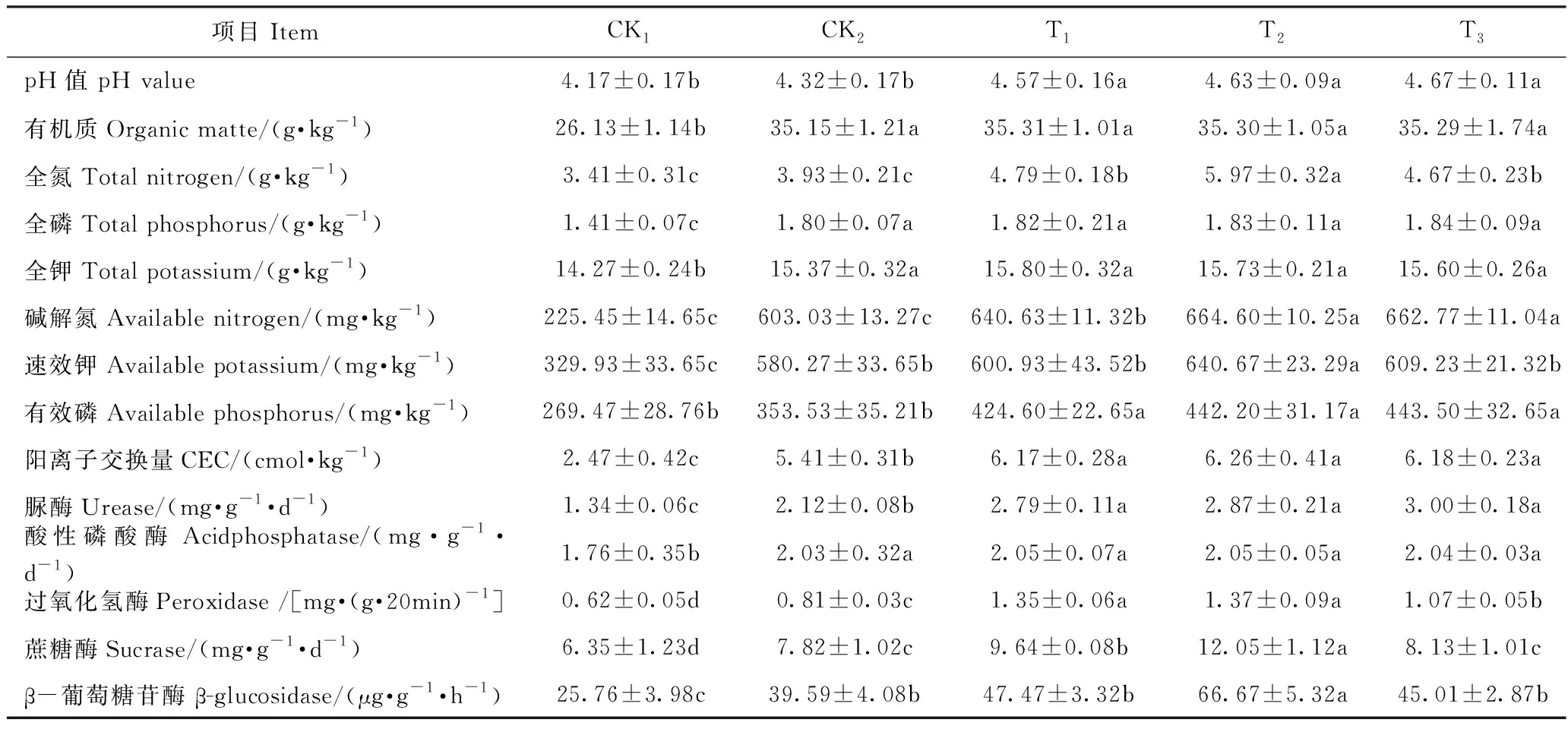
表2 不同处理对土壤理化性质的影响Table 2 Effect of different treatments on the physical and chemical properties of soil
2.1.2 不同处理对土壤酶活性的影响 由表2可知,随着竹炭添加量的增加,PER、SU和β-葡萄糖苷酶(β-glucosidase, BG)活性均呈现先增加后减少的趋势,表现为T2>T1>T3>CK2>CK1,其中添加竹炭处理的过氧化氢酶和蔗糖酶与CK1对照处理均达到显著差异。CK1处理的PER、SU和BG较T2处理分别降低了92.59%、72.89%和103.33%。脲酶(UR)在两个对照处理与添加竹炭各处理间均达到显著差异,但添加竹炭各处理间均未达到显著差异,以T3处理最高。CK1处理的酸性磷酸酶(ACP)最低,较CK2、T1、T2和T3处理分别降低了15.01%、16.32%、16.28%和15.88%。
2.2 不同处理对茶叶产量和品质的影响
2.2.1 茶叶产量和品质 添加竹炭各处理茶叶产量与对照处理均存在差异(表3),但添加竹炭各处理之间均未达到显著差异。T2处理的发芽密度及百芽重最高,显著高于对照处理;T1、T2和T3处理百芽重均显著高于CK1。
不同处理间的茶叶品质见表3。随着竹炭添加量的增加,水浸出物含量呈现先升高后降低的趋势,以T2处理最高,但各处理间均未达到显著差异。儿茶素总量、咖啡碱、游离氨基酸和茶多酚也均以T2处理最高,分别为12.43 g·100g-1、3.34 g·100g-1、4.77 g·100g-1和19.78 g·100g-1,与CK1、CK2、T1和T3处理相比增幅分别为0.40%~4.08%、0.00%~8.28%、3.86%~13.99%、0.10%~5.80%。酚氨比恰好相反,以T2处理最低,且与其他各处理间均达到显著差异,与CK1相比降幅为8.70%;CK1、T1和T3处理与CK1处理也达到了显著差异(P<0.05),降幅分别为5.66%、6.71%和6.30%。
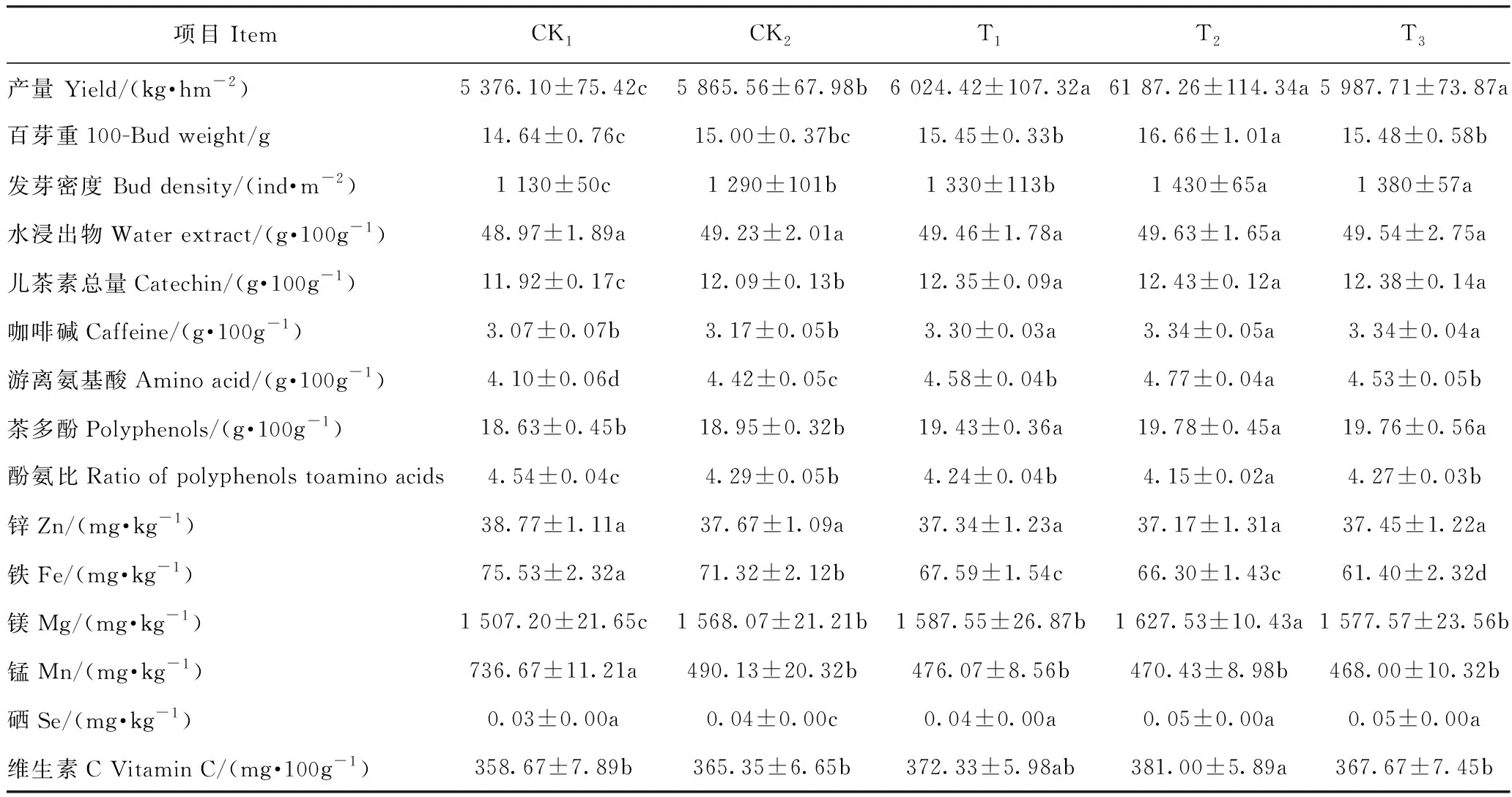
表3 不同处理对茶叶产量和品质的影响Table 3 Effect of different treatments on the yield and quality of tea
茶叶中的Zn、Fe和Mn含量以CK1处理最高,CK1处理的Fe和Mn与其他处理均达到显著差异,且随竹炭添加量的增加呈下降趋势,CK2、T1、T2和T3处理间的Zn和Mn含量均未达到显著差异。添加竹炭各处理Fe含量与CK2处理间均达到显著差异,T1和T2处理的Fe含量与T3处理之间也达到了显著差异。Mg和Vc含量以T2处理最高,T2处理与CK1和CK2处理间均达到显著性差异,呈现随竹炭添加量增加而先升高后下降的趋势。
2.2.2 不同处理对土壤理化性质及茶叶品质中各元素的影响 CCA排序图呈现了环境变量(包括处理和土壤理化性质)对茶叶中多种元素分布的影响(图1)。图中心附近分布指示性的元素,被称为广适性元素,即不易受处理和其他因素的影响[23]。结果表明,轴1(66.62%)和轴2(19.62%)共解释了数据变异的86.24%。处理矢量在排序图中彼此分离明显:CK1处理在第一象限、CK2在第四象限、T2在第二象限,而T1和T3均在第三象限。添加竹炭矢量(T1、T2和T3) 均沿着轴1与未添加竹炭矢量相背分布,表明添加竹炭处理对茶叶品质中各元素及理化因子影响较大。
竹炭添加量的变化引起了理化因子及茶叶中各元素分布的变化,在T1、T2和T3的区域茶叶中氨基酸、Vc、茶多酚及儿茶素出现频率较高;而Mn、Fe和酚氨比分布于第一和第四象限,并沿着轴1上下分布,与营养物质含量呈负相关,表明添加竹炭有利于降低Mn、Fe和酚氨比。氨基酸、Vc及茶多酚到有机质、碱解氮、速效磷及速效钾的多度值较大,即有机质、碱解氮、速效磷及速效钾含量较高,土壤茶叶中氨基酸、Vc及茶多酚累积量会相对较高;而Mn、Fe和酚氨比的累积则相对较低。
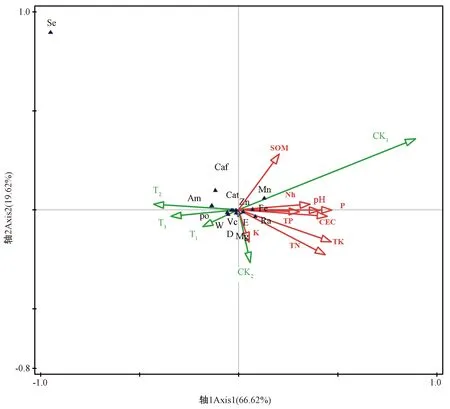
注:红色箭头表示土壤理化性质;绿色箭头表示不同处理;三角形表示茶叶品质指标。Note: The red arrow represents soil physical and chemical properties. The green arrow represents different treatments. The triangle represents tea quality indicators.图1 不同处理和茶叶品质各元素关系的典型相应性分析Fig.1 Analysis of typical correspondence between different treatments and elements of tea quality
2.3 不同处理土壤微生物群落结构特征
2.3.1 不同处理土壤微生物PLFA生物标记量变化 对茶园的土壤样品进行PLFA提取,测定碳10~碳24的PLFA(图2)。结果表明,从CK1、CK2、T1、T2和T3处理的土壤样品中共检测出74种PLFA,由于检测到PLFA分子种类较多,选择含量大于0.1 nmol·g-1的28种PLFA进行分析。其中,革兰氏阳性菌19种、革兰氏阴性菌20种、真菌4种、放线菌3种。5种处理土壤PLFAs图谱相似,都表现为16:00含量最高(占总PLFA的13.16%~14.57%);10Mel16:0、18:1ω9c、18:00、a12:0、a13:0、a15:0、i15:0、i16:0、i17:0、i17:1、18:1ω7c、cyc19:0含量较高(占总PLFA的50.21%~53.39%),说明在酸性土壤这13种PLFA 是土壤微生物优势类群。T1、T2和T3处理的16:00、10Mel16:0、18:1ω9c、a13:0、a15:0、i15:0、i16:0、i17:0、i17:1、18:1ω7c、cyc19:0分子团与CK1处理达到了显著差异;T1和T2处理的16:0、10Mel16:0、18:1ω9c、i15:0、i17:1、18:1ω7c、cyc19:0分子团与CK1和CK2两个对照处理均达到显著差异。a12:0、a13:0、a15:0、16:0表现为随着竹炭添加量的增加呈下降趋势。10Mel16:0、i17:0、cyc19:0表现为随着竹炭添加量的增加呈上升趋势,而18:1ω9c、i17:1、18:1ω7c则呈先升高后降低趋势。

注:不同小写字母表示不同处理间差异显著。Note: Different lowercase letters indicate significant differences between different treatments.图2 不同处理土壤微生物磷脂脂肪酸类型及含量Fig.2 The type and content of soil microbial phospholipid fatty acid under different treatment
由表4可知,T2处理的土壤微生物总PLFA含量最高,且显著高于其他处理,添加竹炭的其他处理也显著高于两对照处理,特别是高于CK1处理。各处理中土壤微生物均以细菌为优势类群,细菌PLFA含量占总PLFA含量的80.73%~85.75%,T2处理占比最低,为80.73%,其次为CK2,CK1处理占比最高,为85.75%。真菌PLFA含量随竹炭添加量的增加呈先升高后降低趋势,添加竹炭的各处理与对照相比差异显著。添加竹炭处理的革兰氏阴性菌/革兰氏阳性菌(G-/G+)和真菌/细菌(F/B)与两对照处理也均达到显著差异,但添加竹炭各处理间未达到显著差异。
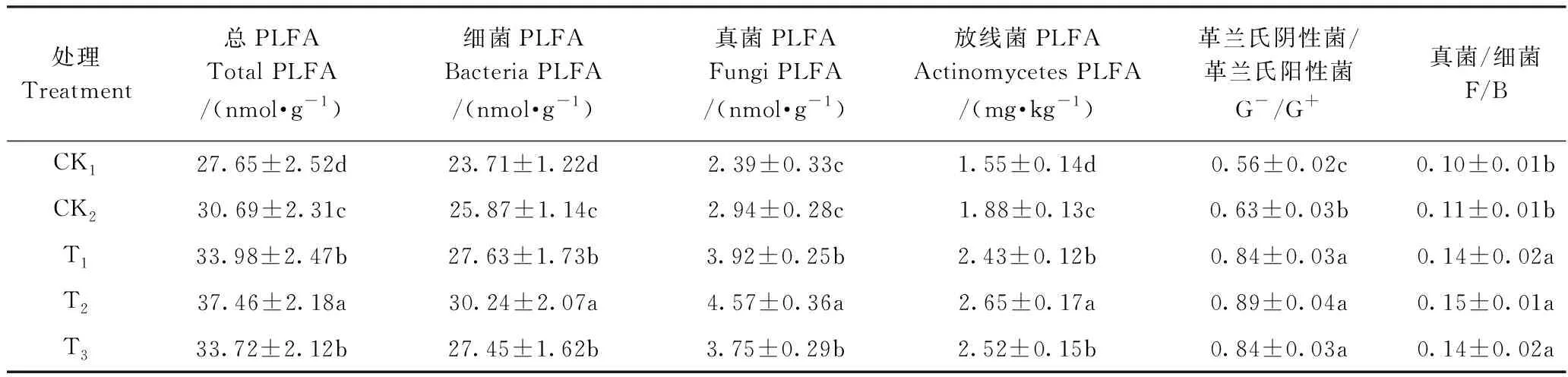
表4 不同处理土壤微生物各菌群磷脂脂肪酸含量及比率 Table 4 The content and ratio of soil microbial phospholipid fatty acid under different treatments.
2.3.2 不同处理对土壤微生物群落多样性指数与压力指数的影响 添加竹炭处理和对照处理的土壤微生物群落多样性指数与压力指数的变化如表5所示。添加竹炭的T2处理的多样性指数和均匀度指数均显著高于两对照处理;T2与T1、T3与CK2的均匀度指数均未达到显著差异。而添加竹炭处理的优势度指数和压力指数显著低于两对照处理,均以T2处理最低;优势度指数在添加竹炭的各处理间无显著差异。
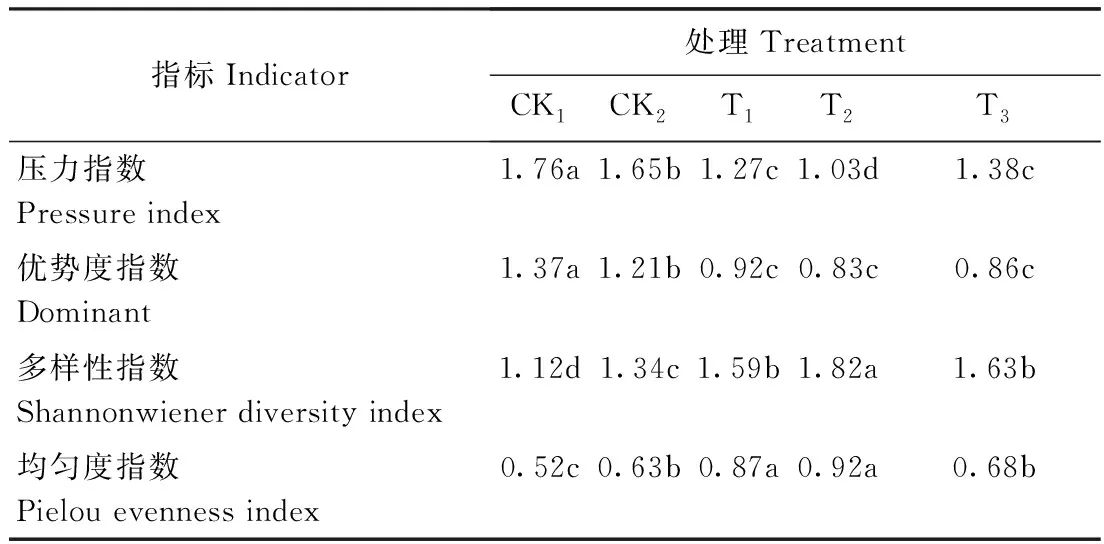
表5 不同处理不同土壤微生物菌群的多样性指数及压力指数Table 5 Stress level and diversity indices of soil microbial community in different treatments
2.4 土壤微生物PLFA主成分分析
经主成分分析(图3)得出,主成分1和主成分2基本能将不同处理区分开来。添加竹炭各处理与主成分1表现出高度正相关,而对照处理与主成分1表现出负相关;T1处理变异较大,与主成分2之间呈正相关关系,对照处理与主成分2之间均呈正相关关系。添加竹炭处理和两对照处理(特别是CK1)相距较远,说明添加竹炭处理与对照处理的土壤微生物群落结构差异较大。而T2和T3处理相距较近,说明这两处理土壤的微生物群落结构较为相似。
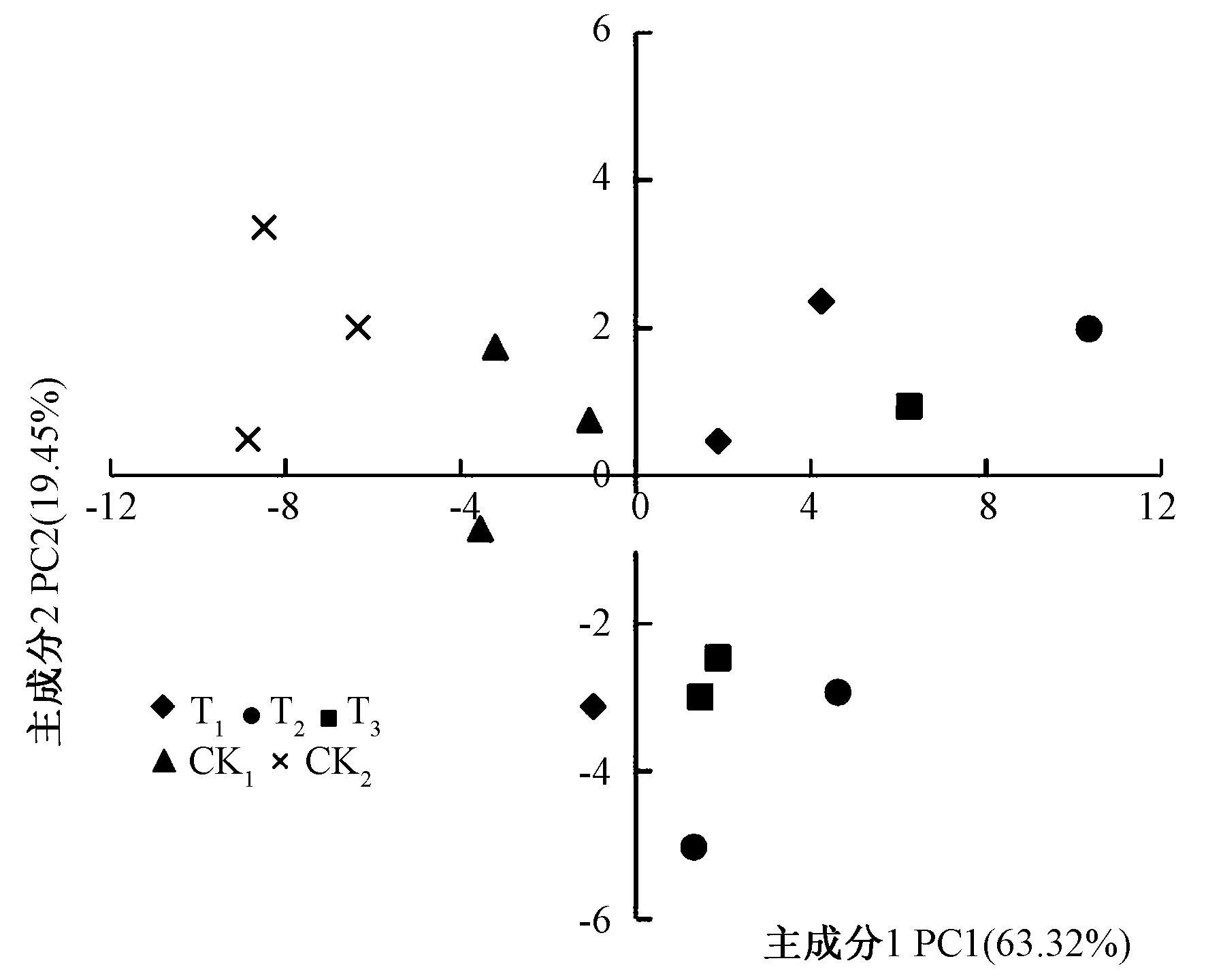
图3 添加秸秆处理土壤微生物群落PLFA的主成分分析Fig.3 Principe components analysis of PLFA profile fromsoil microbial communities under different treatments
由图4可知,cyc19:0、18:1ω7c、a17:0、i15:1ω9c、16:1ω9c、cyc17:0、15:0DMA、10Mel16:0、10Mel17:0和18:3ω9c的脂肪酸分子在主成分1上的载荷值较高,主成分1是它们的代表因子。其中支链脂肪酸多来自于革兰氏阳性菌,a17:0、15:0DMA、18:1ω7c、i15:1ω9c 是用来表征革兰氏阴性菌的脂肪酸,而cyc19:0和cyc17:0是用来表征革兰氏阴性菌的脂肪酸, 18:3ω9c 是真菌的标志性脂肪酸。说明添加竹炭粉使土壤中革兰氏阳性菌和革兰氏阴性菌增多,同时也有利于真菌的生长。18:2ω9c、i14:0、14:1ω5c、15:1ω7c 和16:1ω6c在主成分2上有较高的载荷值,而i19:0、16:1ω5c、 18:2DMA和i17:0在主成分2上的载荷值较低,可以认为主成分2是18:2ω9c、i14:0、14:1ω5c、 15:1ω7c和16:1ω6c的代表因子。说明添加竹炭粉处理使土壤中细菌的含量较高。综合分析得出,添加竹炭处理使土壤中微生物群落结构发生了变化,产生明显的种群优势。

图4 不同处理对土壤微生物群落PLFA载荷因子贡献Fig.4 Eigenvector loading of PLFA contribution to soilmicrobial communities under different treatments
2.5 土壤微生物群落结构与土壤理化性质间的关系
RDA分析显示(图5),第1主轴和第2主轴分别解释了微生物群落结构与理化性质关系总变异的56.67%和13.76%,两者累计解释变异量达70.43%,模拟效果较好。其中,土壤全氮与过氧化物酶、多酚氧化酶、蔗糖酶、β-葡萄糖苷酶、革兰氏阴性菌、放线菌、总磷脂脂肪酸G-/G+的相关性较强;土壤速效氮与脲酶、酸性磷酸酶、过氧化氢酶、β-葡萄糖苷酶相关性较强;有机质与酸性磷酸酶的相关性较强;土壤pH值与脲酶、革兰氏阴性菌、真菌、真菌/细菌和总磷脂脂肪酸的相关性较强;此外,革兰氏阳性菌与速效氮、pH值、脲酶表现为负相关。
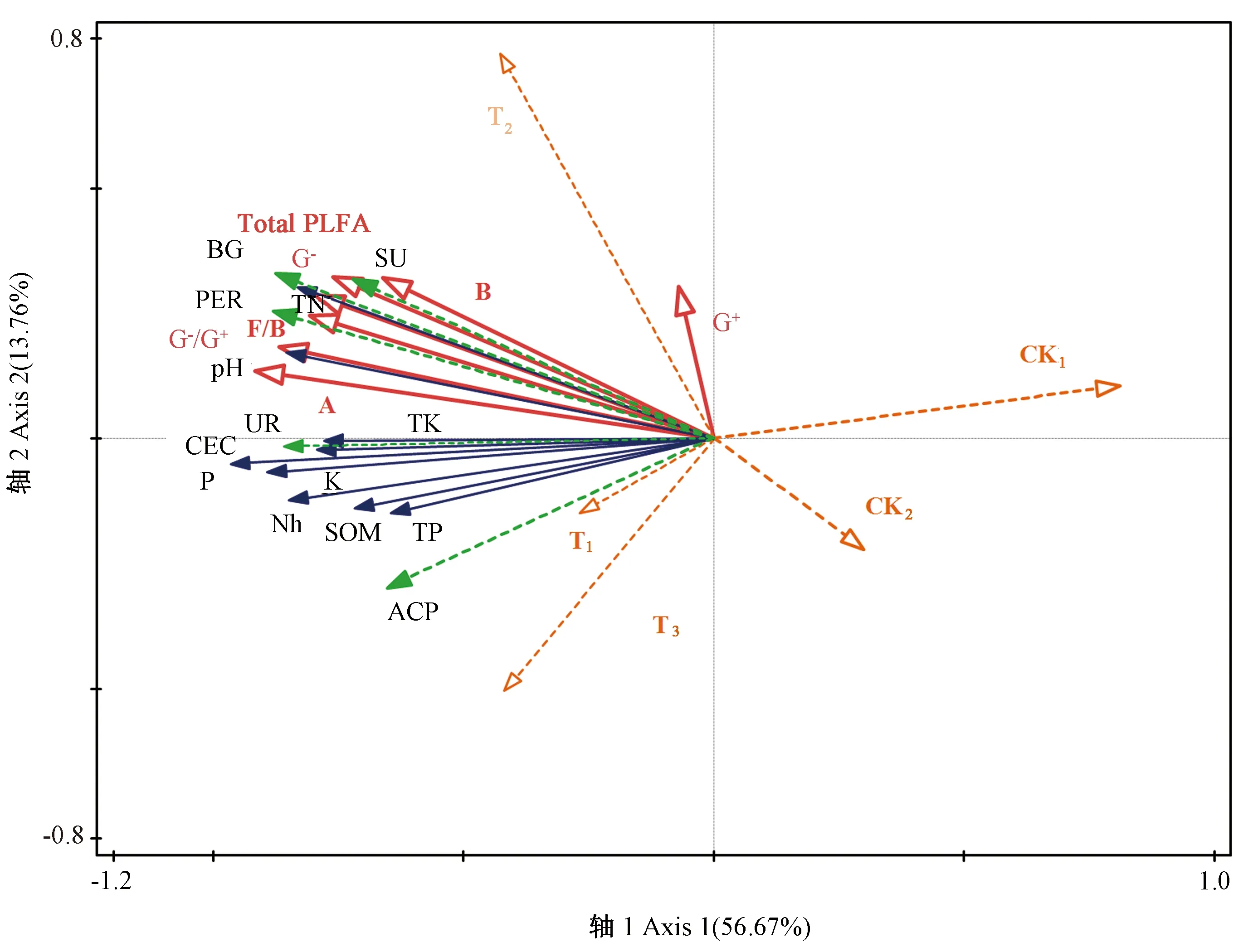
注:F:真菌;B:细菌;A:放线菌;Total PLFA:总磷脂脂肪酸;F/B:真菌/细菌;G-:革兰氏阴性菌;G+:革兰氏阳性菌;G-/G+:革兰氏阴性菌/革兰氏阳性菌;BG:β-葡萄糖苷酶;ACP:酸性磷酸酶;UR:脲酶;PER:过氧化物酶;SU:蔗糖酶。Note: F: Fungi. B: Bacteria. A: Actinomycetes. Total PLFA: Total phospholipid fatty acids. F/B: Fungi/bacteria. G-: Gram-negative bacteria. G+: Gram-positive bacteria. G-/G+: Gram-negative bacteria/Gram-positive bacteria. BG: β-glucosidase. ACP: Acid phosphatase. UR: Urease. PER: Peroxidase. SU: Sucrase.图5 土壤微生物群落结构与土壤环境因子的冗余分析Fig.5 Redundancy analysis of soil microbial community structure and soil environmental factors
3 讨论
3.1 竹炭对土壤酶活性的影响
土壤酶主要由土壤微生物分泌,在催化土壤多种生化反应中扮演重要角色[24],其中β-葡萄糖苷酶(BG)在纤维素降解过程中发挥关键作用,其降解产物是土壤微生物的主要能量来源[25]。本研究中,BG活性在添加竹炭的处理中较高,可能是施入竹炭后改善了植物生长的微环境,导致植株长势较好、地下植株根系生物量增加、地上植株凋落物增加、土壤中有机物积累也随之增加,进而提供更多可利用底物增加了BG活性;而对照处理的植株长势相对较差、植株根系生物量较少,可利用底物也随之降低,从而降低了BG活性。酸性磷酸酶(ACP)活性直接影响土壤中有机磷的分解转化及生物有效性[26]。本研究发现,ACP活性在添加竹炭处理中较高,原因可能为添加竹炭处理的植株长势较好、生物量较高,需要从土壤摄取更多的磷元素,从而刺激了微生物分泌更多的ACP促进有机磷矿化来缓解自身的磷限制[27]。 研究显示,脲酶活性依赖于有机质,其深度参与了有机质的转化分解过程[28],施入竹炭后有机质含量提升,脲酶活性随之提升,故竹炭处理脲酶活性高。土壤蔗糖酶主要参与土壤中碳水化合物的转化,其活性是反映土壤肥力的重要指标[29],过氧化氢酶反映出土壤微生物氧化过程的强弱[30]。本研究发现土壤蔗糖酶和土壤过氧化氢酶活性随施炭量的增加而增强,这与前人研究一致[31]。土壤酶活性与土壤全氮、有机质、碱解氮和有效磷等存在显著相关关系,表明土壤酶活性是由多因子协同作用的,故土壤酶活性的改变程度主要受其自身性质、生物炭性质及添加量和土壤性质的影响[32]。
3.2 竹炭对茶叶品质的影响
茶多酚、氨基酸、酚氨比、咖啡碱、水浸出物等是表征茶叶品质的重要指标。茶多酚在医学界被称为“辐射克星”[33],茶多酚含量在20%以内,茶汤滋味与其含量呈显著正相关,但茶多酚含量进一步增加后,使得正相关性发生逆转[34]。本研究显示,各处理茶多酚的含量均在20%以内,以T2和T3处理较高,说明T2和T3处理茶汤的苦涩味较适中。万青等[2]通过对比试验发现,施入生物炭(玉米秸秆炭)调理剂处理显著提高了茶多酚含量,本研究结果与之一致。氨基酸是茶叶滋味最重要的物质之一,含量越高,茶汤越鲜爽,香气高长,品质更优。相关研究表明,土壤中碱解氮和有效磷含量显著影响茶叶中氨基酸的含量[35];本研究显示,施入竹炭各处理碱解氮和有效磷显著高于对照处理,这也反映出添加竹炭处理有利于氨基酸的累积,与前人研究基本一致[13]。酚氨比是表征茶叶品质的重要指标,也是评价茶叶适制性的指标之一,制作绿茶要求酚氨比<8.00,制作红茶要求酚氨比>15.00,制作乌龙茶则居于二者之间(8.00<酚氨比<15.00)[2]。而本研究中,不同处理的酚氨比均小于8,从酚氨比的角度,本研究区域无论哪个处理产出的茶叶都适合制作绿茶,这也符合该区域主产绿茶的特征。本研究中对照处理的酚氨比最高,为4.54,T2处理酚氨比最低,为4.15,说明添加竹炭处理特别是T2处理更有利于改善茶叶的品质。
Zn元素与茶叶的品质有一定相关性,即茶叶品质越好,Zn元素含量越高[36]。本研究结果表明,Zn含量随竹炭施入量增多呈现下降趋势,但各处理之间均未达到显著差异。其原因可能是茶叶总产量上升,而土壤中Zn元素主要是靠土壤母质分解,且每年分解的量相对固定,同时没有外源施入,导致了单位面积茶叶中Zn的相对含量下降。朱旭君等[37]认为,Fe含量高会对茶叶的品质产生不利影响,含Fe高的茶叶品质较差。本研究结果表明,随竹炭施入量增多,茶叶中Fe含量呈现下降趋势,说明添加竹炭处理有利于改善茶叶品质。茶树具有聚Mn的性质,但Mn元素含量较高则茶叶品质较差[38]。研究表明,茶叶中Mn含量与茶多酚含量呈负相关,Mn不利于茶多酚积累[38],而本研究也显示添加竹炭处理不利于Mn元素的累积。Vc也是表征茶叶品质的重要指标,高级绿茶中Vc含量高达0.5 mg·100g-1[39],本研究显示添加竹炭处理的Vc含量高于对照处理,以T2处理最高,为0.38 mg·100g-1, 说明添加竹炭有助于茶叶中Vc的累积。
3.3 竹炭对土壤微生物群落结构的影响
本试验利用磷脂脂肪酸法研究竹炭对土壤微生物群落的影响,结果表明竹炭施入后茶园土壤的细菌、真菌、放线菌和总PLFA含量均有显著升高。在本研究中,10Mel16: 0、18: 1ω9c、18:0、a12:0、a13:0、a15:0、i15:0、i16:0、i17:0、i17:1、18: 1ω7c和cyc19:0是茶园土壤微生物的主要类群,但不同竹炭施入量处理的细菌、真菌、放线菌、真菌/细菌和总的PLFA含量存在一定差异,随竹炭施入量增加呈先增加后降低的趋势,T2处理最佳。研究显示,生物炭不仅使豌豆根部固氮量增加[40],更显著地增加了土壤放线菌、真菌和细菌的丰度,且增加幅度与生物炭施入量成正比[41]。也有研究显示,在一定范围内,随着生物炭施用量增加,土壤微生物数量和活性均显著提高[42]。本研究发现,添加竹炭各处理均对土壤微生物总生物量、细菌生物量和真菌的生物量均产生了不同程度的影响,随竹炭施入量的增加呈先增加后降低的趋势,与前人研究结果基本一致。究其原因,生物质炭由于具有疏松多孔结构,在微小的孔隙内可以吸附和储存不同种类和组分的物质,为土壤微生物提供丰富的营养物质和良好的生存环境,有利于微生物栖息与繁殖,特别是菌根真菌,也减少了自身竞争、外来侵袭和失水干燥等因素的影响[41-42]。但竹炭量增加到“抑制浓度”则会对微生物产生毒性,对真菌的生长更不利[41]。
4 结论
本研究表明,竹炭对土壤酶活性,茶叶品质和微生物群落结构产生了显著影响,ACP活性、BG活性、PER活性、UR活性、SU活性、茶叶产量、百芽重、发芽密度、茶多酚、氨基酸、咖啡碱、水浸出物、Mg、Vc、土壤微生物总生物量、土壤细菌量和土壤真菌量均随着竹炭添加量的增加呈先升高后降低的趋势;酚氨比、Zn、Fe和Mn随竹炭添加量的增加呈现降低趋势;施入不同量的竹炭处理对土壤真菌和细菌比值(F/B)也产生了显著影响,F/B随着竹炭量的增加呈先增加后降低的趋势。

