不同发育阶段厚壳贻贝幼虫对类胡萝卜素的吸收和代谢研究
翁梓雨 李 双 陈娟娟,*
(1宁波大学,农产品质量安全危害因子与风险防控国家重点实验室,浙江 宁波 315211;2宁波海关技术中心,浙江 宁波 315040)
厚壳贻贝(mytiluscoruscus)隶属于软体动物门(Mollusca),瓣鳃纲(Lamellibranchia),翼形亚纲(Pterimorphia),贻贝目(Mussels),贻贝科(Mytilidae),自然分布于我国东海、黄海、渤海,具有营养和药用价值高、生命力强、生长周期短、易养殖的特点,是我国重要的滩涂养殖贝类。贻贝养殖业的比重逐年增加,已成为我国沿海地区的几大支柱性产业之一[1-2]。目前,关于厚壳贻贝的研究工作主要集中在养殖技术提升、基因克隆及相关免疫功能、蛋白组学及功能和稚贝发育抗逆性研究等方面[3-7],但随着水产行业的快速发展和人们生活水平的日益提高,国民对水产品品质及营养的要求也愈加严格,水产品中营养功效因子成为影响水产品价值的重要因素,而功效因子的开发应用可以进一步促进水产品的高值和高效利用。
类胡萝卜素作为重要的营养功效因子成分,其种类组成与含量分布成为评价水产品品质的重要指标之一[8-9],广泛存在于水产生物体中[10-13],具有组织着色[9,14]、提高环境适应能力[14-17]、参与自由基清除[17-18]、增强繁殖及提高机体免疫力[18]等功能。水产生物不能从头合成类胡萝卜素,但可根据自身需求通过外源摄食进行类胡萝卜素的吸收与代谢,形成自身组织特异性类胡萝卜素,从而发挥其功效[16, 19]。受到水产生物自身遗传机制的调控和外源饵料差异的影响,不同水产品种类和组织部位的类胡萝卜素吸收与代谢不同。目前,关于类胡萝卜素在饵料微藻和水产生物之间的吸收与代谢研究甚少。
为了探究水产品中类胡萝卜素吸收与代谢途径,宁波大学贝藻种质资源与增养殖课题组前期通过单饵料投喂试验,对成贝期的厚壳贻贝中类胡萝卜素的组织分布情况进行研究,发现肠胰腺组织是类胡萝卜素吸收与代谢的主要场所,且主要存在2条合成途径——乙烯基到乙炔基类胡萝卜素代谢途径和4-酮基氧化途径[20]。然而,关于厚壳贻贝幼虫阶段类胡萝卜素吸收与代谢情况仍未见报道。基于此,本研究以不同阶段厚壳贻贝幼虫(担轮幼虫、D形幼虫、壳顶期、眼点期和稚贝期)为研究对象,通过饵料投喂试验,分析类胡萝卜素组成和代谢相关基因的表达,探讨饵料中外源性类胡萝卜素被厚壳贻贝幼虫摄取后的吸收与代谢情况,以期为选择性培育高品质的厚壳贻贝提供技术保障。
1 材料与方法
1.1 材料与试剂
类胡萝卜素标准品(α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素、β-隐黄质、玉米黄质、番茄红素、虾青素、叶黄质、紫玉米黄质、新黄质、岩藻黄素、硅甲藻黄素 )(纯度>95%)、2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)、乙酸铵和甲酸(色谱纯),美国Sigma-Aldrich公司;类胡萝卜素标准品(δ-胡萝卜素、ζ-胡萝卜素、ε-胡萝卜素、α-隐黄质、环氧玉米黄质、角黄素、硅藻黄素、岩藻黄酮醇)(纯度>95%),德国Dr. Ehrenstorfer公司。丙酮、甲醇和异丙醇(色谱纯),德国Merck公司;HiScript III RT SuperMix for qPCR和AceQ qPCR SYBR Green Master Mix,中国诺唯赞公司,1kb DNA Ladder和D2000 DNA Ladder,中国天根公司;0.22 μm聚四氟乙烯滤膜,北京迪马公司;HLB固相萃取柱(150 mg/6 cc),美国Waters公司;实验用水为Milli-Q超纯水(18.2 ΩM·cm-1)。
1.2 仪器与设备
UltiMate3000高压液相色谱串联Q-Exactive 四极杆静电场轨道阱高分辨质谱仪(配置H-ESI II源),美国Thermo Fisher Scientific公司;Milli-Q高纯水发生器,美国Millipore 公司;Delta 1-24 LSC plus冷冻干燥机、4-16KHS冷冻离心机,德国Sigma公司;Vortex08型漩涡振动器,德国Heldolph公司;ABI 7500 Real-time PCR仪,美国ABI Life technologies公司。
1.3 试验方法
1.3.1 样品采集和前处理 球等鞭金藻(Isochrysisgalbana)、湛江等鞭金藻(Isochrysiszhanjiangensis)、叉鞭金藻(Dicrateriasp.)、牟氏角毛藻(Chaetocerosmuelleri)、小硅藻(Nitzschiaclosteriumf.minutissima)、三角褐指藻(PhaeodactylumtricornutumBohlin)、小球藻(Chlorellavulgaris)、青岛大扁藻(Platymonashelgolandica)和微拟球藻(Nannochloropsissp.)均由宁波大学海洋生物实验室藻种室提供。在2 500 mL锥形瓶中,于自然光条件下进行微藻培养,培养液采用f/2 配方,海水(pH 值8.30,盐度28‰)在使用前经过0.22 μm醋酸纤维滤膜过滤后煮沸冷却,培养温度维持在20±2℃,每天摇晃3次,通过血球计数板测量藻种密度,并选取平台期微藻作为研究对象,进行类胡萝卜素组成和含量分析。此外,基于9种微藻的类胡萝卜素种类和含量,最终选择平台期的叉鞭金藻和牟氏角毛藻转移至50 L的塑料桶进行扩大培养,培养温度维持在20±2℃,连续充入2%二氧化碳气体以确保扩增速度,将处于指数生长期的叉鞭金藻和牟氏角毛藻投喂厚壳贻贝。
厚壳贻贝亲贝采自浙江省舟山市嵊泗县的枸杞岛(30.71°N, 122.77°E),产卵后,通过显微镜观察,依次收集担轮幼虫、D形幼虫、壳顶幼虫、眼点幼虫和稚贝5个发育阶段的幼贝样品。其中,从发育成为D形幼虫的第2天起对其进行投喂。投喂饵料为叉鞭金藻和牟氏角毛藻混合饵料微藻,2种饵料微藻的比例为1∶1(m∶m), 密度约为4×104cells·mL-1, 每日投喂2次,换水后投放1次。稚贝期幼虫的投放饵料微藻密度约为10×104cells·mL-1。分别收集上述厚壳贻贝幼虫并用2次砂滤海水暂养2 d,排空消化道中残存的内容物,然后将幼虫冷冻干燥至恒重。
称取500 mg幼虫或微藻样品,加入10 mL甲醇溶液(含0.1% BHT),震荡5 min,超声提取20 min,以 12 000 r· min-1高速离心5 min,得到有机层及残渣。将有机相经HLB固相萃取柱净化,甲醇(含0.1% BHT)作为洗脱液进行洗脱,洗脱液经氮吹浓缩近干。剩余残渣加入 10 mL甲醇-二氯甲烷溶液(1∶1, v∶v,含0.1% BHT)进行2次提取,震荡5 min,超声提取20 min,以12 000 r· min-1高速离心5 min,取上层有机相氮吹浓缩后准确加入2.0 mL甲醇溶液(含0.1% BHT)和1 g中性氧化铝粉,充分震荡,以12 000 r·min-1高速离心,得到上清液。合并上清液,经0.22 μm滤膜过滤,待分析。
1.3.2 类胡萝卜素的高效液相色谱-质谱条件[21]液相条件:固定相为Syncronis C18(2.1 mm × 150 mm, 1.7 μm);流动相A:乙腈-水(9∶1, v∶v,含10 mmol·L-1乙酸铵),流动相B:乙腈-异丙醇(7∶3, v∶v)。 采用梯度洗脱模式,0~5 min,5% B;5~25 min,5%~50% B;25~35 min,50%~100% B;35~45 min,保持100%B;45~45.1 min,100%~5% B;45.1~50 min,保持5% B。流速为0.3 mL·min-1,进样量为5.0 μL。
质谱条件:在样品运行前对仪器分别进行正、负离子校正。质谱在正、负离子转换模式下进行全扫描测定,质量范围为m/z 100~1 200(周期时长256 ms),分辨率70 000(m/z 200),自动增益控制(automatic gain control,AGC)目标值 5×e5, 负离子模式2 700 V,正离子模式3 800 V,离子传输管温度300℃,鞘气(N2)流速设置为35 L· h-1,辅助气(N2)流速为10 L· h-1,气化室温度350℃,质谱采集时间为0.0~45.0 min,最大注入时长为200 ms。二级采用自动触发模式(dd-MS2), 分辨率为35 000 FWHM(m/z 200,周期时长128 ms),自动增益控制(AGC)目标值2×e5,相对碰撞能量范围10%~80%,保留时间(retention time, RT)窗口根据目标物设置为RT±1.0 min。
1.3.3 类胡萝卜素的定性、定量分析 定性分析:利用高通量筛查软件ExactfinderTM(Thermo Fisher Scientific)对类胡萝卜素进行定性分析,要求精确质量误差低于5×10-6。同时比对保留时间、分子量、同位素分布、主要二级碎片和二级质谱图相识度,综合判断,以得到准确定性结果,避免假阳性结果。
定量分析:分别称取适量类胡萝卜素标准品,用丙酮(0.1% BHT)溶解,配制成 0.2 mg·mL-1的标准溶液,置于棕色瓶中,在-40℃条件下避光保存。配制10 μg·mL-1的类胡萝卜素混合标准溶液,并逐级稀释至浓度为10、20、50、100和200 ng·mL-1标准溶液。以浓度为横坐标,标准品峰面积为纵坐标,绘制标准工作曲线。贻贝黄素选择虾青素的标准曲线进行半定量分析。
1.3.4 类胡萝卜素的RT-PCR分析 利用获得的厚壳贻贝转录组内的部分序列数据,用4×gDNA wiper Mix和5 × HiScript Ⅲ RT SuperMix合成cDNA,并设计特异性引物(D5-验证-FD5-验证-R)在cDNA 上进行扩增,以验证相关基因序列正确性。引物全称和引物序列(5’→3’)见表1。利用TRIzol法对5个发育阶段的厚壳贻贝幼虫样本(担轮幼虫、D形幼虫、壳顶幼虫、眼点幼虫和稚贝期)中的总RNA进行分离,并进一步合成单链cDNA(PrimeScript®RT regent Kit With gDNA Eraser,TaKaRa)。采用SYBR Premix Ex Taq Ⅱ (TaKaRa)在ABI 7500 Real-time PCR仪中进行实时荧光定量PCR分析,以18SrRNA作为内参。RT-PCR反应程序为:50℃ 2 min, 95℃ 5 min, 95℃ 10 s,共40个循环。然后60℃ 1 min, 95℃ 15 s, 60℃ 15 s, 95℃ 15 s,最后从60℃缓慢加热到99℃。解离曲线分析用于确定目标的特异性。所有反应重复3次。通过2-ΔΔCT法进行相对基因定量分析。
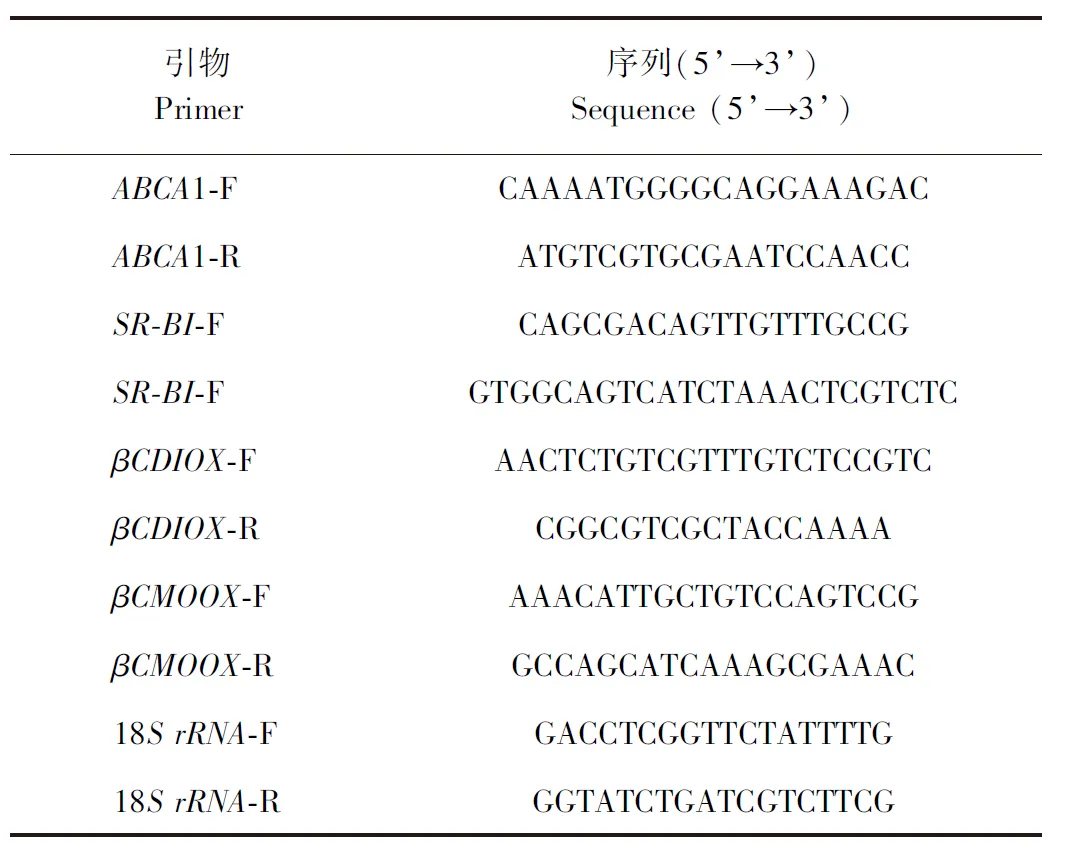
表1 类胡萝卜素相关基因表达的引物序列Table 1 Primer sequences used for carotenoid-related gene expression
2 结果与分析
2.1 类胡萝卜素定性方法建立
考虑到类胡萝卜素分子结构中羟基、羰基等电负性基团的存在,选取正离子模式进行分析(表2)。叶黄质、玉米黄质和新黄质的结构与α、β-胡萝卜素极其相似,仅在1, 3, 3-三甲基环己烯环取代位置不同,在质谱中产生分子离子峰[M]+;大部分含氧类胡萝卜素更易形成准分子离子峰[M+H]+。21种类胡萝卜素的选择离子流图,如图1-A所示。
为了进一步深入解析类胡萝卜素的结构,通过四极杆/静电场轨道阱高分辨质谱,在分辨率高达70 000情况下,将21种类胡萝卜素的分子离子峰分别在不同碰撞能量(20%、50%、 80%)进行二级质谱实验,获得高精度二级碎片离子(表2),并通过元素模拟得到碎片离子的元素组成,进而探究游离类胡萝卜素的裂解规律。结果表明,裂解过程主要集中在含氧基团附近。对于含氧的游离类胡萝卜素,环上的羟基得到1个质子后形成[M+H]+,随着碰撞能量的增加,环上的C-O键断裂,失去一分子水形成[M+H-H2O]+;对于含双羟基类胡萝卜素,还存在连续丢失两分子水后形成碎片离子[M+H-2H2O]+;不含氧的游离类胡萝卜素不存在丢失水分子的碎片离子。由于分子结构中存在高度不饱和的共轭多烯基团,在高碰撞能下,会形成一系列的Δ=12 or 14的碎裂片段,质荷比分布在31~133 Da之间。另外,由于各个化合物之间末端环状结构的差异,即取代基团的不同(羧基、羟基等),形成的碎裂离子会有所差异,通过中性丢失环或含环结构的碎片离子,可进一步推测环状结构组成。因此,根据标准品的保留时间、精确分子量和特征碎片离子,实现后续样品中类胡萝卜素的组成分析。经微藻喂养后的厚壳贻贝幼虫中发现响应较高的色谱峰,其保留时间为4.23 min(图2),准分子离子峰为m/z 598.401 6,将其进行二级碎裂,得到特征碎片离子m/z 197.117 1、m/z 127.112 1和m/z 109.101 3,与文献报道贻贝黄素的分子量和结构一致[22],因此推测该化合物为贻贝黄素(图1-B)。
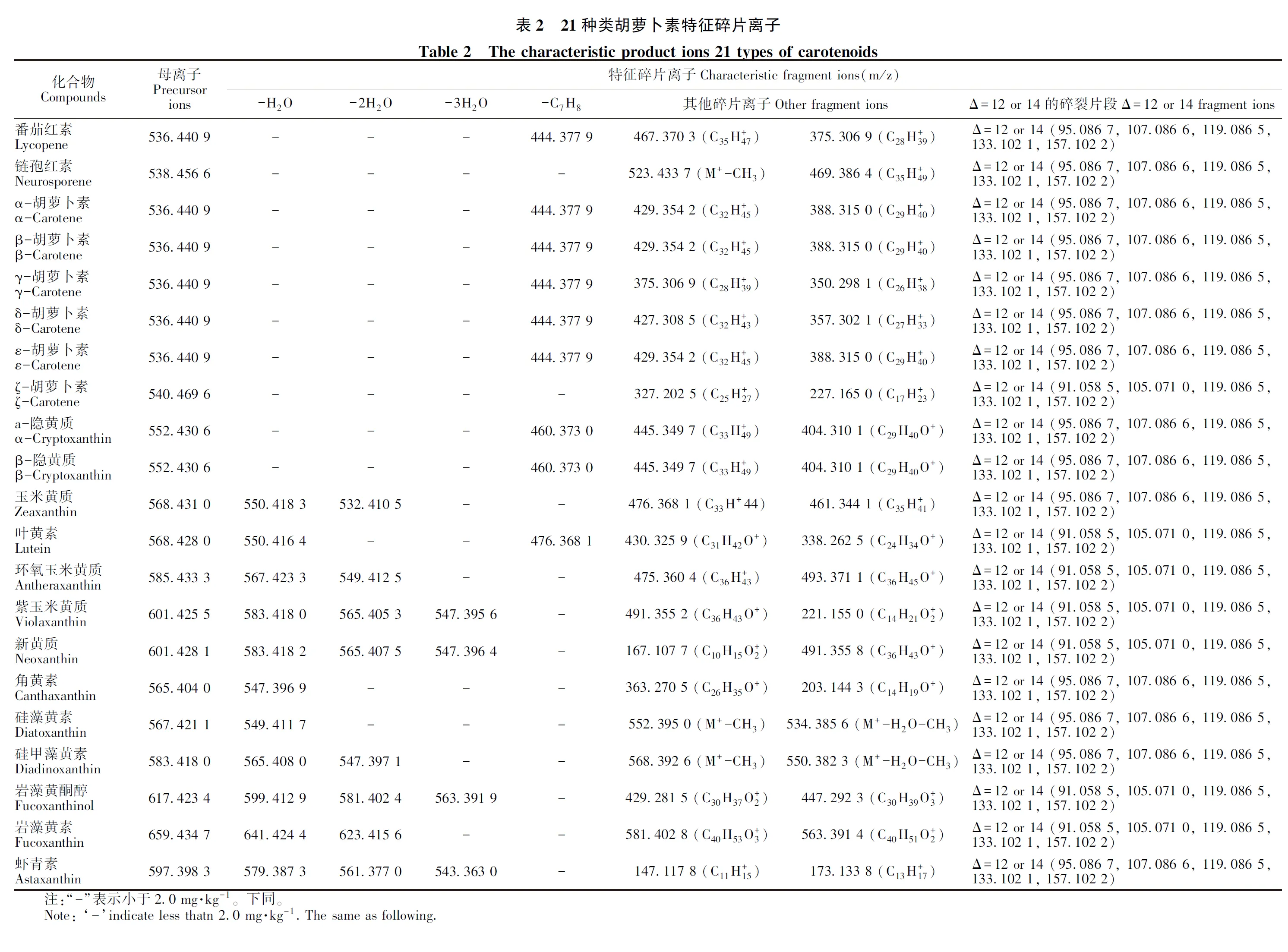
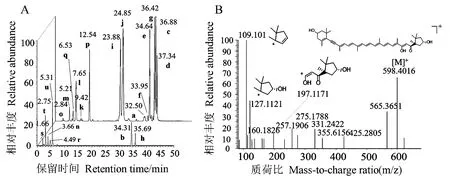
注:a:番茄红素;b:链孢红素;c:α-胡萝卜素;d:β-胡萝卜素;e:γ-胡萝卜素;f:δ-胡萝卜素;g:ε-胡萝卜素;h:ζ-胡萝卜素;i:α-隐黄质;j:β-隐黄质;k:玉米黄质;l:叶黄质;m:环氧玉米黄质;n:紫玉米黄质;o:新黄质;p:角黄素;q:硅藻黄 素;r:硅甲藻黄素;s:岩藻黄酮醇;t:岩藻黄素;u:虾青素。Note: a: Lycopene. b: Neurosporene. c: α-Carotene. d: β-Carotene. e: γ-Carotene. f: δ-Carotene. g: ε-Carotene. h: ζ-Carotene. i: α-Cryptoxanthin. j: β-Cryptoxanthin. k: Zeaxanthin. l: Lutein. m: Antheraxanthin. n: Violaxanthin. o: Neoxanthin. p: Canthaxanthin. q: Diatoxanthin. r: Diadinoxanthin. s: Fucoxanthinol. t: Fucoxanthin. u: Astaxanthin.图1 类胡萝卜素选择离子流图(A)和贻贝黄素二级质谱图(B)Fig.1 Selective ionization chromatogram of carotenoids (A) and MS/MS of mytiloxanthin (B)
2.2 不同饵料微藻中类胡萝卜素含量
饵料微藻作为双壳贝类主要的食物来源,其营养成分组成,尤其是类胡萝卜素的种类和含量对双壳贝类生长繁殖至关重要。比较分析金藻纲的湛江等鞭金藻、球等鞭金藻和叉鞭金藻,硅藻纲的牟氏角毛藻、小硅藻和三角褐指藻,绿藻纲的小球藻、青岛大扁藻和微拟球藻9种饵料微藻的类胡萝卜素组成,结果表明(表3),类胡萝卜素的种类和含量在不同饵料微藻间存在明显差异。金藻的主要类胡萝卜素为岩藻黄素、岩藻黄酮醇、β-隐黄质和β-胡萝卜素,其中叉鞭金藻的总类胡萝卜素含量最高,达到1 290.7 mg·kg-1,其次是湛江等鞭金藻(634.9 mg·kg-1),球等鞭金藻的总类胡萝卜素含量最低(424.1 mg·kg-1)。岩藻黄素、硅甲藻黄素、硅藻黄素和β-胡萝卜素是硅藻的主要类胡萝卜素,其中牟氏角毛藻中的总类胡萝卜素含量最高,为1 326.4 mg·kg-1,其次是小硅藻(635.1 mg·kg-1),三角褐指藻最低(544.0 mg·kg-1)。绿藻的主要类胡萝卜素为β-胡萝卜素和叶黄质,其中小球藻的总类胡萝卜素含量最高,达到94.1 mg·kg-1,其次是青岛大扁藻(65.7 mg·kg-1), 微拟球藻的含量最低(49.5 mg·kg-1)。 综上所述,金藻纲和硅藻纲微藻的总类胡萝卜素含量明显高于绿藻纲微藻,其中叉鞭金藻(除叶黄质外)和牟氏角毛藻(除环氧玉米黄质外)在类胡萝卜素种类与含量方面优势显著。因此选取这两种藻类作为厚壳贻贝人工投喂组饵料,分析微藻饵料的类胡萝卜素组成对厚壳贻贝幼虫体内类胡萝卜素吸收和代谢的影响。

2.3 不同生长阶段厚壳贻贝幼虫中类胡萝卜素分布与基因表达量
通过叉鞭金藻和牟氏角毛藻混合投喂试验,对不同生长阶段厚壳贻贝(幼虫)中类胡萝卜素的分布情况进行分析,结果表明(图2),幼虫中共鉴定得到5种类胡萝卜素:1种新合成类胡萝卜素——贻贝黄素,4种微藻来源类胡萝卜素——α-胡萝卜素、β-胡萝卜素、岩藻黄酮醇、岩藻黄素。在厚壳贻贝的不同生长阶段,对4种微藻来源类胡萝卜素的富集能力有显著差异。在担轮幼虫中未检测到类胡萝卜素,D形幼虫开始持续性积累类胡萝卜素,从D形幼虫到壳顶期类胡萝卜素的增长速度最快,而从壳顶期到稚贝期,类胡萝卜素仍持续性增长。作为新合成的类胡萝卜素,贻贝黄素的变化趋势与其他4种微藻来源的类胡萝卜素有所不同,贻贝黄素在壳顶期才开始被检出(图3),含量达到1.53 mg·kg-1。当发育到稚贝期时,其含量增加了1.13倍。总之,幼虫不同发育阶段的总类胡萝卜素整体呈现上升趋势,含量范围为1.68~26.12 mg·kg-1。
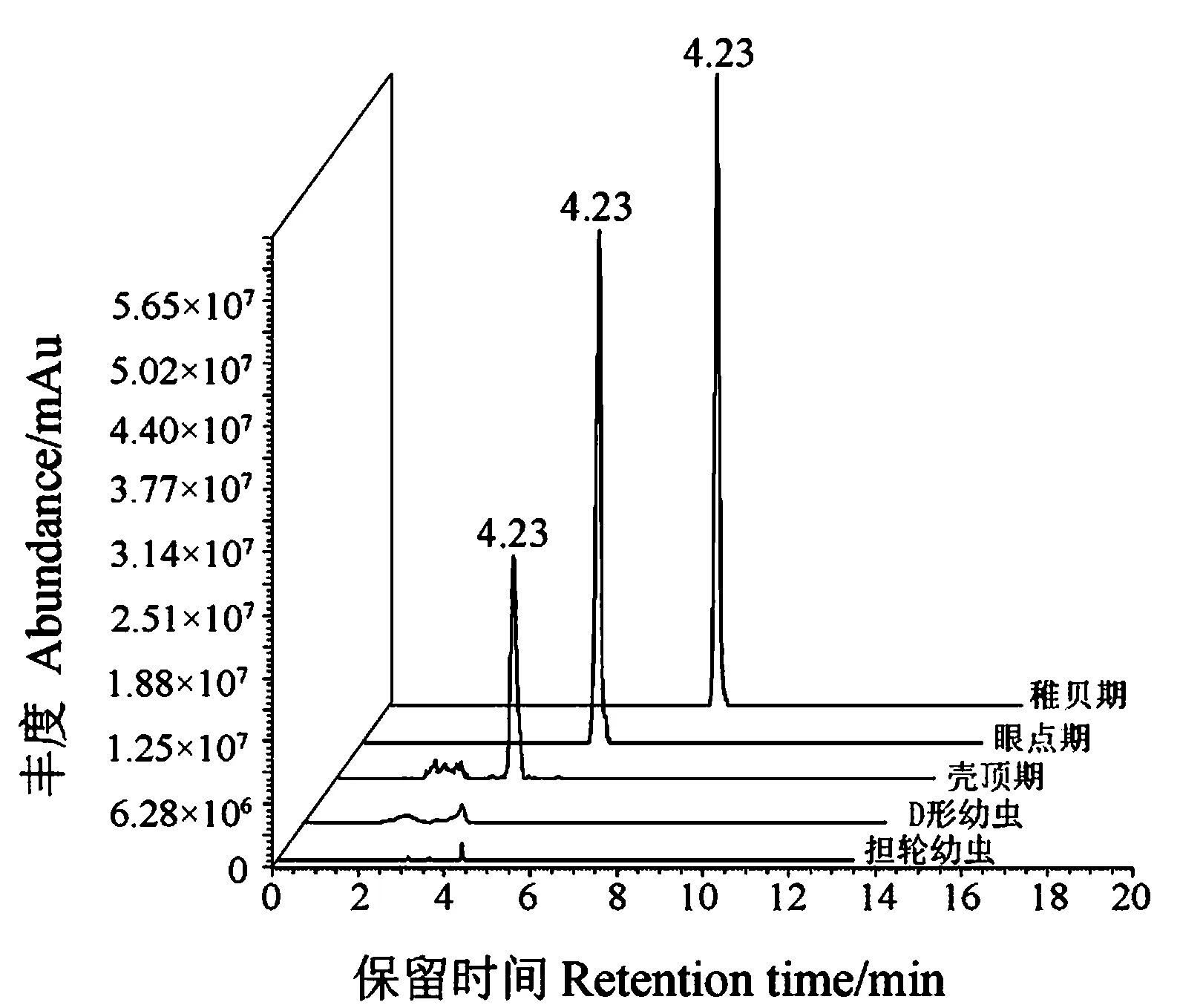
图2 不同厚壳贻贝幼虫发育阶段中贻贝黄素色谱图Fig.2 The chromatograms of mytiloxanthin in different larval stages of M.coruscus
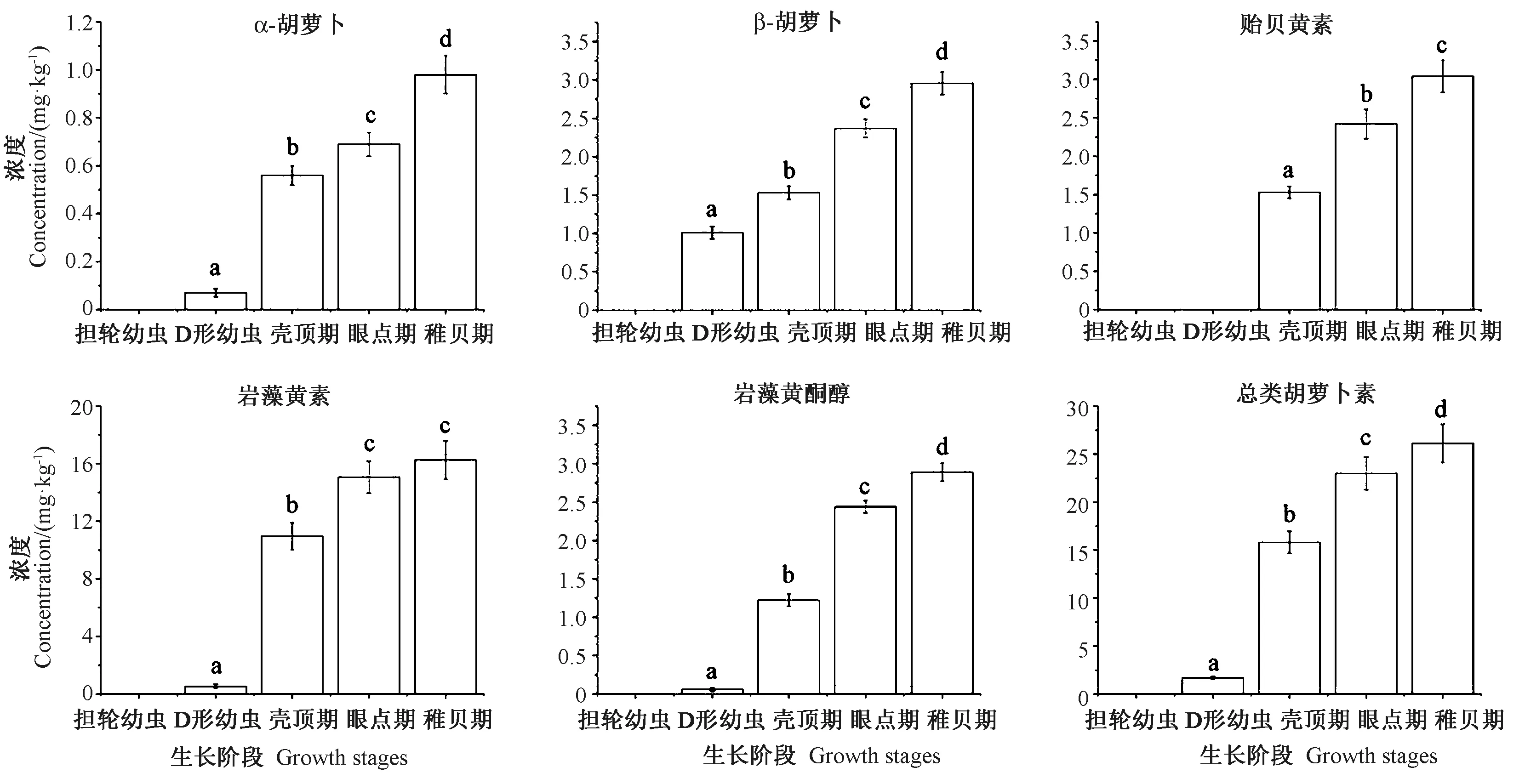
注:不同字母表示厚壳贻贝幼虫在不同生长阶段间的差异显著(P<0.05),相同字母表示差异不显著(P≥0.05)。下同。Note:Different letters mean significant differences (P<0.05) between the groups of different larval stages of M.coruscus and the same letters mean no significant differences(P≥0.05). The same as following.图3 不同生长阶段厚壳贻贝幼虫的类胡萝卜素组成Fig.3 The contents of carotenoids in different larval stages of M.coruscus
为深入了解类胡萝卜素在不同生长阶段分子机制的差异性,进一步分析了上述4个类胡萝卜素相关基因在厚壳贻贝幼虫阶段(担轮幼虫、D形幼虫、壳顶期、眼点期和稚贝期)中的表达量情况。结果表明(图4),类胡萝卜素合成相关的β-胡萝卜素-15,15′-加双氧酶βCDIOX基因在整个幼虫阶段均未表达,而参与类胡萝卜素吸收、代谢的相关基因——磷酸腺苷盒式A1(ABCA1)、B类I型清道夫受体(SR-BI)和β-胡萝卜素-15,15′-加单氧酶(βCMOOX)的表达水平随幼虫发育获得持续性积累,在稚贝期,其表达量达到最高,是担轮幼虫的7.66~54.36倍;其中,从D形幼虫到壳顶期的增长最为迅速,其表达量是担轮幼虫的5.61~38.69倍。异性分布可能与幼虫阶段消化系统逐渐完善,捕食更为积极相关:D形幼虫的体内出现收缩肌及闭壳肌原基,促使其游动活跃,体内消化道逐渐发达,胃部扩张,已初步具备捕食饵料能力,开始持续性积累类胡萝卜素;此外,壳顶期幼虫的规格是D形幼虫的3倍左右,捕食能力显著增强。因此,从D形幼虫到壳顶期,相关基因和类胡萝卜素均呈显著上升趋势。其中,参与类胡萝卜素合成代谢功能的βCMOOX基因表达量上升最为显著,在壳顶期表达量是担轮幼虫阶段的38.69倍,由此推测,该基因很可能参与了壳顶期新出现类胡萝卜素——贻贝黄素的合成过程。
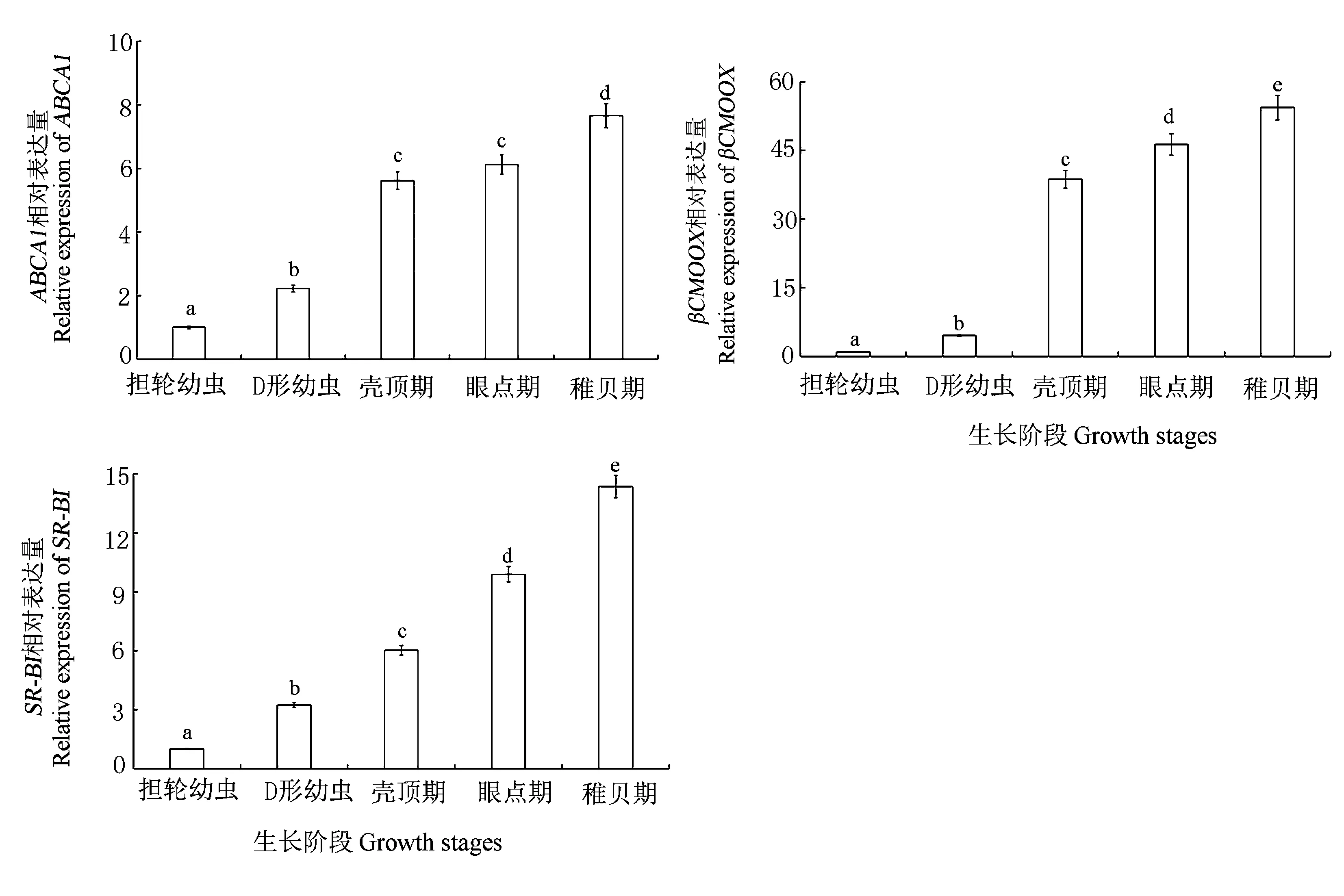
图4 不同厚壳贻贝幼虫发育阶段中类胡萝卜素相关基因表达量Fig.4 Expressions of carotenoid related genes in different larval stages of M.coruscus
3 讨论
水产生物自身不能合成类胡萝卜素,其来源仅靠食物摄入[23-24]。不同的食物来源造成水产生物中类胡萝卜素吸收和代谢的差异[25]。因此为了深入研究厚壳贻贝幼虫对类胡萝卜素利用率,本研究通过饵料微藻投喂试验,分析不同幼虫阶段对类胡萝卜素的吸收和代谢差异。在9种饵料微藻中,叉鞭金藻和牟氏角毛藻中的类胡萝卜素种类最多、含量最高,经这2种饵料微藻喂养后,担轮幼虫并无类胡萝卜素检出,而从D形幼虫到稚贝期,类胡萝卜素含量逐渐增加,且在壳顶期时类胡萝卜素累积速度最快,是担轮幼虫的20倍,这可能与D形幼虫已具备捕食饵料能力,且壳顶期消化系统逐渐完善,捕食更为积极相关。此外,相比于D形幼虫阶段,稚贝期中吸收的主要类胡萝卜素——岩藻黄素增加了30.1倍,这与岩藻黄素作为叉鞭金藻(33.80%)和牟氏角毛藻(54.24%)中主要类胡萝卜素相关。由此表明,厚壳贻贝幼虫体内摄入的类胡萝卜素种类和含量与饵料微藻中呈现一定的正相关性。
厚壳贻贝幼虫中鉴定到一种新合成类胡萝卜素——贻贝黄素,在壳顶期最先被检测到,而到了稚贝期,其含量增加了近1倍。据文献报道,贻贝黄素的代谢过程可能与贝类的两条类胡萝卜素合成途径相关,即乙烯基类胡萝卜素到乙炔基类胡萝卜素代谢途径和4-酮基氧化途径[20, 25]。如紫贻贝(Mytilusedulis)通过乙烯基到乙炔基类胡萝卜素代谢途径产生异黄素和贻贝黄素[25],扇贝经4-酮基氧化途径可将硅藻黄素氧化为果胶酮和梳黄质[26-27]。因此,在厚壳贻贝幼虫的壳顶期中发现的贻贝黄素可能也是通过乙烯基类胡萝卜素到乙炔基类胡萝卜素代谢途径合成的,且贻贝黄素重要前体物质——岩藻黄素含量急剧升高,也证实了该合成途径的存在。Li等[20]研究了厚壳贻贝的成贝以岩藻黄素和岩藻黄酮醇为前体化合物,经乙烯基到乙炔基类胡萝卜素代谢途径,合成贻贝黄素和梳黄质,以及经过4-酮基氧化途径合成果胶酮、虾青素、海胆酮和羟基海胆酮。但是这些类胡萝卜素的代谢速率仍不明确。而厚壳贻贝幼虫阶段仅检测到贻贝黄素,也证实了该化合物是厚壳贻贝吸收外源摄入的类胡萝卜素后,最先代谢而成的一种类胡萝卜素。
目前关于类胡萝卜素关键性酶的调控通路研究尚不够深入,部分研究发现类胡萝卜素被动物摄食后,大致经过3个过程:酶解过程、受体介导的胞吞过程和脂质选择性运输过程,参与的基因主要包括ABCA1、SR-BI、载脂蛋白(Apolipoprotein)、βCMOOX和βCDIOX等[28-31]。SR-BI和分化抗原簇36(CD36)为肠吸收类胡萝卜素过程中的重要基因[28-29],βCMOOX和βCDIOX是肠上皮细胞中类胡萝卜素代谢关键酶,其中,βCMOOX催化β-胡萝卜素断裂生成 2分子的视黄醛,继续代谢成视黄醇,βCDIOX催化β-胡萝卜素生成长链β-阿朴胡萝卜素醛和短链β-阿朴胡萝卜素醛,然后进一步转化为阿朴视黄酸[30-31]。本研究发现厚壳贻贝幼虫中的ABCA1、SR-BI和βCMOOX从担轮幼虫阶段开始表达,其中βCMOOX在壳顶期的表达量最大,分别是ABCA1和SR-BI的6.9和6.4倍,由此也进一步证明βCMOOX可能参与了吸收外源摄入的类胡萝卜素进行贻贝黄素代谢合成。但贻贝黄素合成路线上的关键性酶、代谢通路的完整性仍需进一步研究。
4 结论
本研究建立了常见的21种类胡萝卜素的高效液相色谱-质谱联用分析方法,比较不同饵料微藻的类胡萝卜素种类和含量,选择叉鞭金藻和牟氏角毛藻作为厚壳贻贝幼虫的最佳饵料。结果表明,担轮幼虫不具有吸收类胡萝卜素能力,而从D形幼虫起,厚壳贻贝幼虫的类胡萝卜素累积能力随着发育进程的推进而逐渐增强,且岩藻黄素是其主要的吸收色素。此外,在参与类胡萝卜素合成代谢的βCMOOX作用下,贻贝黄素是厚壳贻贝幼虫阶段唯一体内合成的类胡萝卜素。该结果可为进一步研究类胡萝卜素在水产生物中的代谢途径提供依据,且有助于为高品质厚壳贻贝培育工作提供技术支撑。

