环割对葡萄VvNCED基因的表达和果实成熟的影响
董昳伶 肖旭腾 张 敏 沈乐意 陈天池 贾永红 吴月燕
(浙江万里学院生物与环境学院, 浙江 宁波 315000)
成熟期调控是目前鲜食葡萄(VitisviniferaL.)的研究热点,通过关键基因调控果实提前或延迟成熟、进入市场,拉长供应期,达到最大经济效益。大量研究已证实,果实发育成熟受植物内源激素的调控,其中脱落酸(abscisic acid, ABA)在调节果实成熟和衰老中起关键作用。ABA的生物合成途径分为2种,一种是类萜途径,主要存在于一些植物致病真菌中[1-2];另一种是类胡萝卜素途径,为植物ABA合成的主要途径[3]。9-顺式-环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)是调节植物ABA合成途径的关键限速酶[4],参与ABA生物合成和信号转导[5],首个编码NCED的基因在玉米突变体中分离得到[6]。研究表明,NCED在胞质内合成,在转运肽的引导下进入质体,催化叶绿醇的氧化裂解反应[7]。葡萄中VvNCED1基因在果实成熟时启动ABA的生物合成[8],目前已经发现NCED家族中有12条基因[9],但VvNCED基因家族如何通过调节ABA从而影响葡萄果实发育尚不明确。前人研究表明,在果实成熟期前对葡萄进行环割处理可以增加果实中的ABA含量[10],提高果实糖酸比、可溶性固形物含量[11-12],促进果实成熟[13-14]。本试验以鄞红葡萄为材料,研究环割处理对葡萄成熟期的影响、内源ABA含量的变化和VvNCED6条家族基因表达量的差异,并进行基因过表达的验证,旨在深入了解VvNCED家族基因在ABA合成中的作用,揭示其在葡萄果实成熟中的调控机制。
1 材料与方法
1.1 试验材料与试剂
鄞红葡萄来源于浙江省宁波市镇海滴翠园农场。
RNA提取试剂盒来自天根生化科技(北京)有限公司。CTAB植物基因组DNA快速提取试剂盒来自北京艾德莱生物科技有限公司。引物合成由杭州擎科生物技术有限公司完成。反转录试剂盒、一步克隆试剂盒、DH5α来自上海近岸科技有限公司。质粒提取Omega Bio-Tek试剂盒来自Omega(美国)。内切酶NcoI-HF来自美国NEBiolabs。GV3101农杆菌来自昂羽生物(上海)。荧光酶Perfect StartTM Green qPCR Super Mix、琼脂糖凝胶纯化回收试剂盒EasyPure Quick Gel Extraction Kit购自北京全式金生物技术有限公司。植物激素脱落酸(ABA)酶联免疫分析(ELISA)试剂盒来自上海科兴生物科技有限公司。
1.2 试验方法
1.2.1 试验设计 选取果园内生长栽培管理一致、处于开花期后50 d的30株5年生鄞红葡萄。5株为一小区,在离地面1.2 m的主干上进行环割,环割深度0.3 mm、宽度0.5 mm,以不环割为对照,重复3次,随机排列。在处理后0、7、15、23、35和48 d分别随机采集5穗处理与对照的葡萄果实、连接果穗处10 cm左右茎段和该茎段处的叶片。采集后一部分用于果实品质测定,一部分于-80℃保存,用于后续试验。
1.2.2 果实品质指标的测定 处理与对照每穗随机取10粒果实,测定果实品质。果实可溶性固形物(total soluble solids, TSS)含量、总酸含量和糖酸比利用PAL-BX|ACID2便携式数显糖酸一体酸度计(日本爱拓)测定。果肉中的可溶性蛋白含量测定使用考马斯亮蓝法,可溶性糖含量测定使用蒽酮比色法[15]。
1.2.3 果肉、茎段和叶片中的ABA含量测定 处理与对照每穗随机取9粒果实、3个茎段和3片叶片,根据(ELISA)酶联免疫试剂盒说明书测定葡萄果肉、茎段和叶片中的ABA含量,3次重复。
1.2.4VvNCED基因表达特性分析 根据鉴定的葡萄NCED家族基因[9],在EnsemblPlants(http://plants.ensembl.org/index.html)上搜索NCED家族基因编码区(表1),利用Primer 6软件设计实时荧光定量PCR引物(real-time quantitative reverse transcription PCR, qRT-PCR)(表2)。提取处理与对照的葡萄果肉、茎段和叶片的RNA,逆转录成cDNA,分组后于-20℃保存备用。qRT-PCR按照PerfectStartTMGreen qPCR SuperMix说明书操作,选用葡萄Actin为内参,反应在CFX96荧光定量PCR仪(美国伯乐)上进行。3次重复,数据处理时,设置处理0 d为初始值1,后所有数值倍数比较。
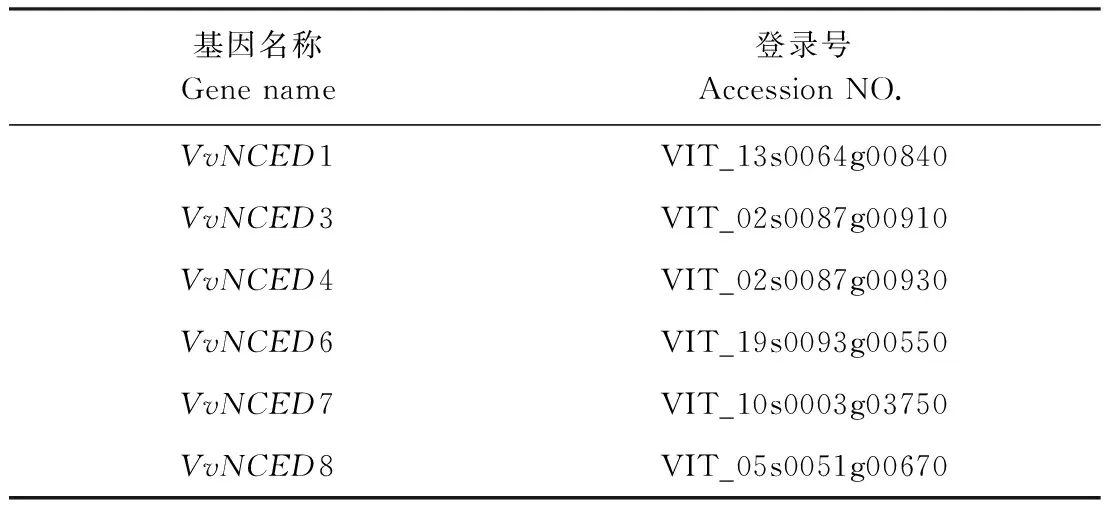
表1 基因序列信息Table 1 Information of gene sequences
1.2.5 pCambia1302-VvNCEDs植物过表达载体的构建 根据NCED基因家族完整编码区,pCambia1302质粒序列和一步克隆试剂盒方法,设计插入位点以及引物(图1、表1)。提取pCambia1302质粒,NcoI-HF单酶切后回收线性化载体。提取鄞红葡萄果肉RNA,逆转录成cDNA后,PCR获得带有载体同源序列的VvNCED基因编码区目的片段,体系为50 μL:cDNA 2 μL,正反引物各2 μL,2×Fast Pfu MAster Mix 25 μL,无核酸酶水补足至50 μL。反应条件:94℃预变性1 min 30 s;94℃变性20 s,55℃退火20 s,72℃延伸1 min,35个循环;72℃终延伸5 min,4℃条件下保存。利用一步克隆试剂盒将目的片段与线性化载体进行连接。得到重组过表达植物载体pCambia1302-VvNCEDs。连接后转化DH5α,通过菌液PCR和测序鉴定阳性重组子。将获得的带有不同目的片段的重组过表达载体按照携带的目的片段命名为pCambia1302-VvNCED1、pCambia1302-VvNCED3、pCambia1302-VvNCED4、pCambia1302-VvNCED6、pCambia1302-VvNCED7和pCambia1302-VvNCED8。
1.2.6 GV3101转化与葡萄花序侵染 将所构建的pCambia1302-VvNCEDs载体与pCambia1302通过冻融法转化GV3101,阳性筛选验证成功后,获得7个携带不同载体的农杆菌菌株。取200 μL菌液加入含有1 mg·L-1卡那霉素和1 mg·L-1利福平的50 mL LB培养液中,于28℃、200 r·min-1摇床中摇至浑浊,然后用加入0.1 mol·L-1乙酰丁香酮(acetosyringone, AS)、0.5 mol·L-12-吗啉乙磺酸(2-morpholinoethanesulfonic acid, MES)和1 mol·L-1的MgCl2的MS液体培养液(pH值5.8)调至OD600=0.8,得到农杆菌侵染液。在田间随机选择24株生长一致的5年生鄞红葡萄,3株为一区组,其中6组分别单独被携带重组过表达载体的农杆菌侵染,1组被携带空载的农杆菌侵染,1组保持自然生长(野生型)。农杆菌菌液浸泡花蕾期花序5 min,报纸遮光3 d后去除,每个处理重复3次。
1.2.7 DNA验证与qRT-PCR检测基因表达水平 根据质粒设计验证引物(表1)。过表达(over-expressed)、空载对照(empty vector, EV)和野生型(wild type, WT)于果实转色期各采3穗,采样后立即置于4℃条件下保存,采用植物DNA提取试剂盒对所有葡萄果肉进行基因组DNA提取。通过PCR反应筛选阳性转基因葡萄果肉,体系为25 μL:cDNA 1 μL,正反引物各1 μL,2xEasyTaq PCR Super Mix 12.5 μL,无核酸酶水补足至25 μL。反应条件:94℃预变性5 min;94℃变性30 s,55℃退火2 min,72℃延伸2 min,40个循环;72℃终延伸10 min,4℃条件下保存。取阳性的葡萄果肉进行总RNA提取,反转录生成cDNA,用1.2.4的方法,通过qRT-PCR检测目的基因的表达量。
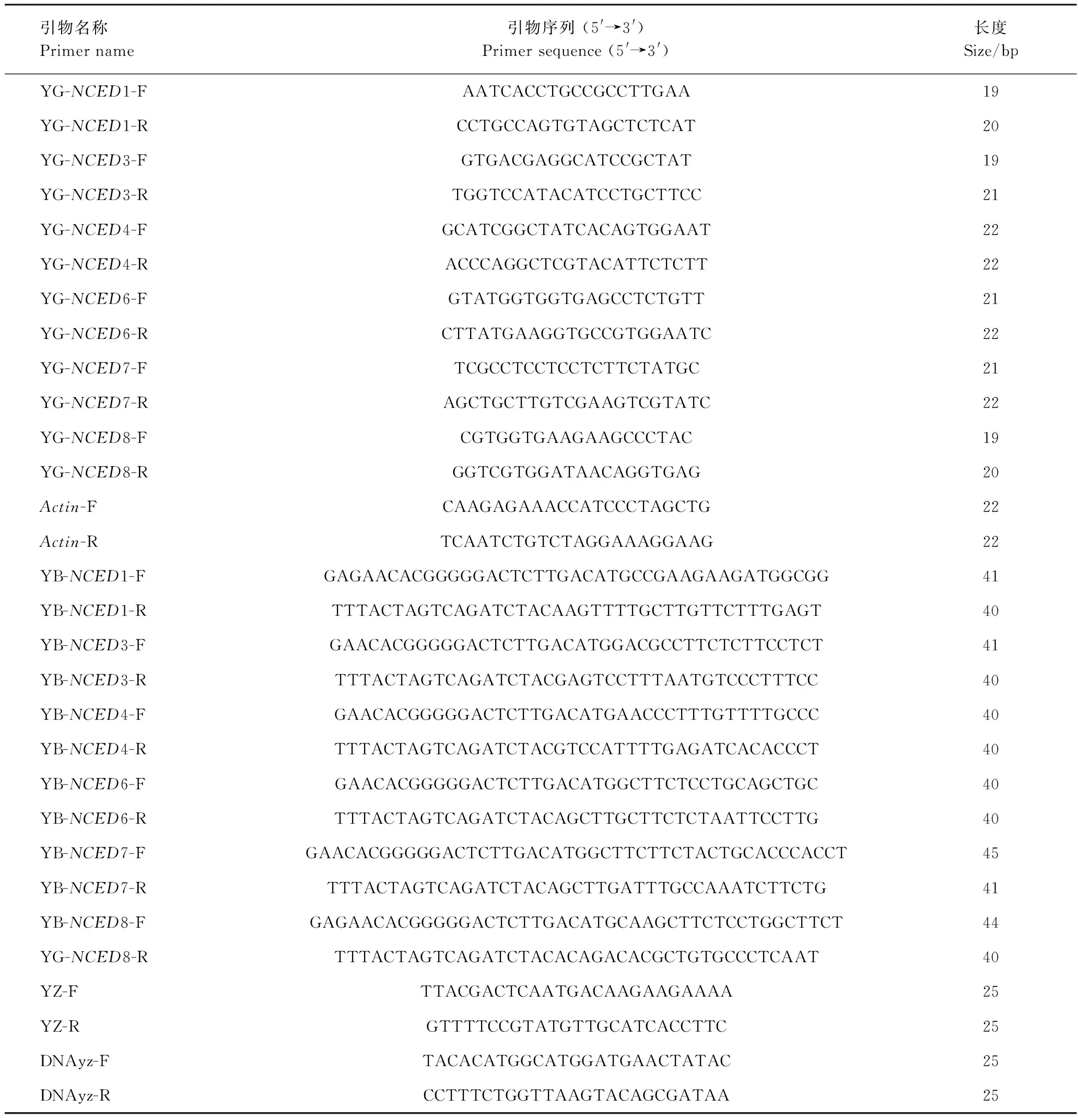
表2 引物序列Table 2 Primer sequences
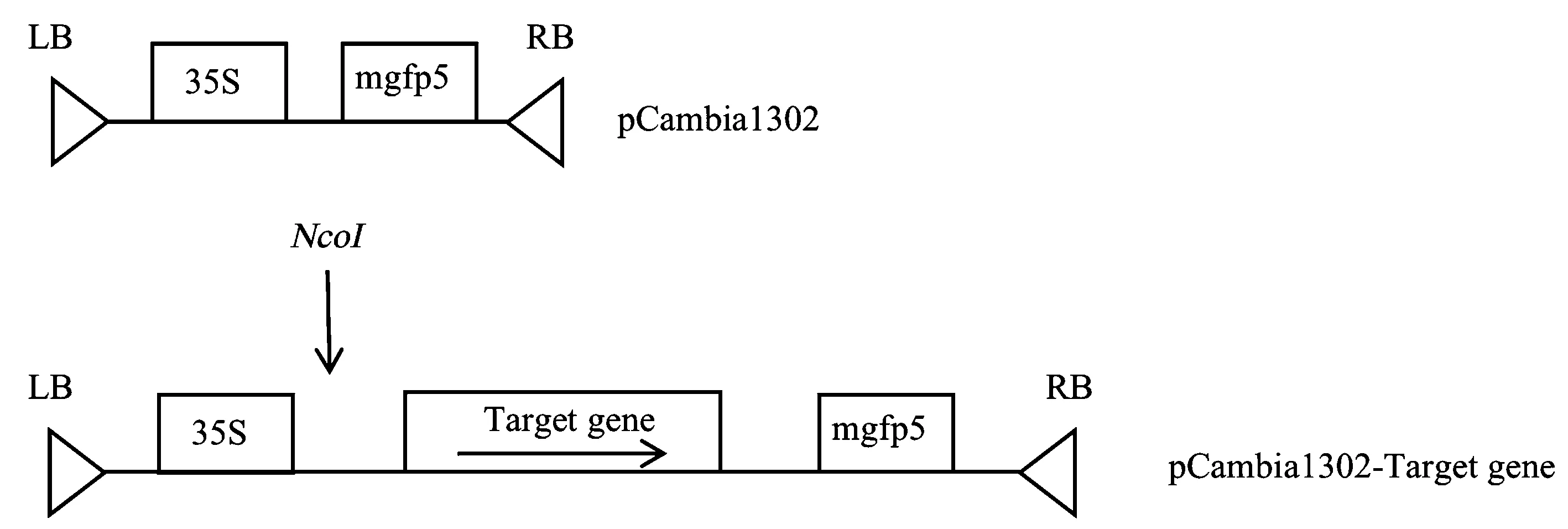
注:35S是启动子; mgfp5是荧光位点; LB和RB分别为左右边界; NcoI是酶切位点。Note: 35S is promoters. mgfp5 is fluorescent marker site. LB and RB are the left and right borders respectively. NcoI is the restriction site.图1 过表达载体构建示意图Fig.1 Schematic diagram of overexpression vector construction
1.2.8 ABA含量的测定 使用ELISA法测定阳性转基因葡萄果肉中的ABA含量,重复3次。
1.2.9 阳性转基因葡萄果肉果实品质指标的测定 取DNA检测结果为阳性的转基因葡萄果肉测定果实品质相关指标,测定方法同1.2.2,重复3次。
1.3 数据处理
用WPS Office 19进行数据整理和绘图,使用SPSS 24.0进行差异分析。
2 结果与分析
2.1 环割处理对葡萄果实品质的影响
环割处理后,葡萄果实提前着色(图2)。处理和对照组葡萄果实进入转色期的时间分别为15和23 d;处理35 d葡萄果实达到完全转色,对照则在48 d达到完全转色,可知处理后的葡萄果实转色时间比对照提前13 d。

图2 鄞红葡萄果实外观比较Fig.2 Yinhong grape fruit appearance comparison
随着果实的发育,处理与对照组果实硬度、总酸和糖酸比以及果肉中的可溶性固形物、可溶性糖和可溶性蛋白的含量均呈现较大的差异(表3)。处理后的果实成熟时间为35 d,对照果实成熟时间为48 d。处理15 d,果肉中的可溶性固形物含量是处理7 d的2.13倍;处理35 d是处理23 d的1.52倍,是对照35 d的1.23倍。处理35 d与处理48 d的总酸含量和糖酸比均无显著差异。对照48 d的糖酸比显著高于处理48 d。果肉中的可溶性糖含量在处理15 d是同时期对照的1.73倍;处理35 d含量最高,是同时期对照的1.28倍。处理35 d、处理48 d和对照48 d时果肉中的可溶性蛋白含量无显著差异。
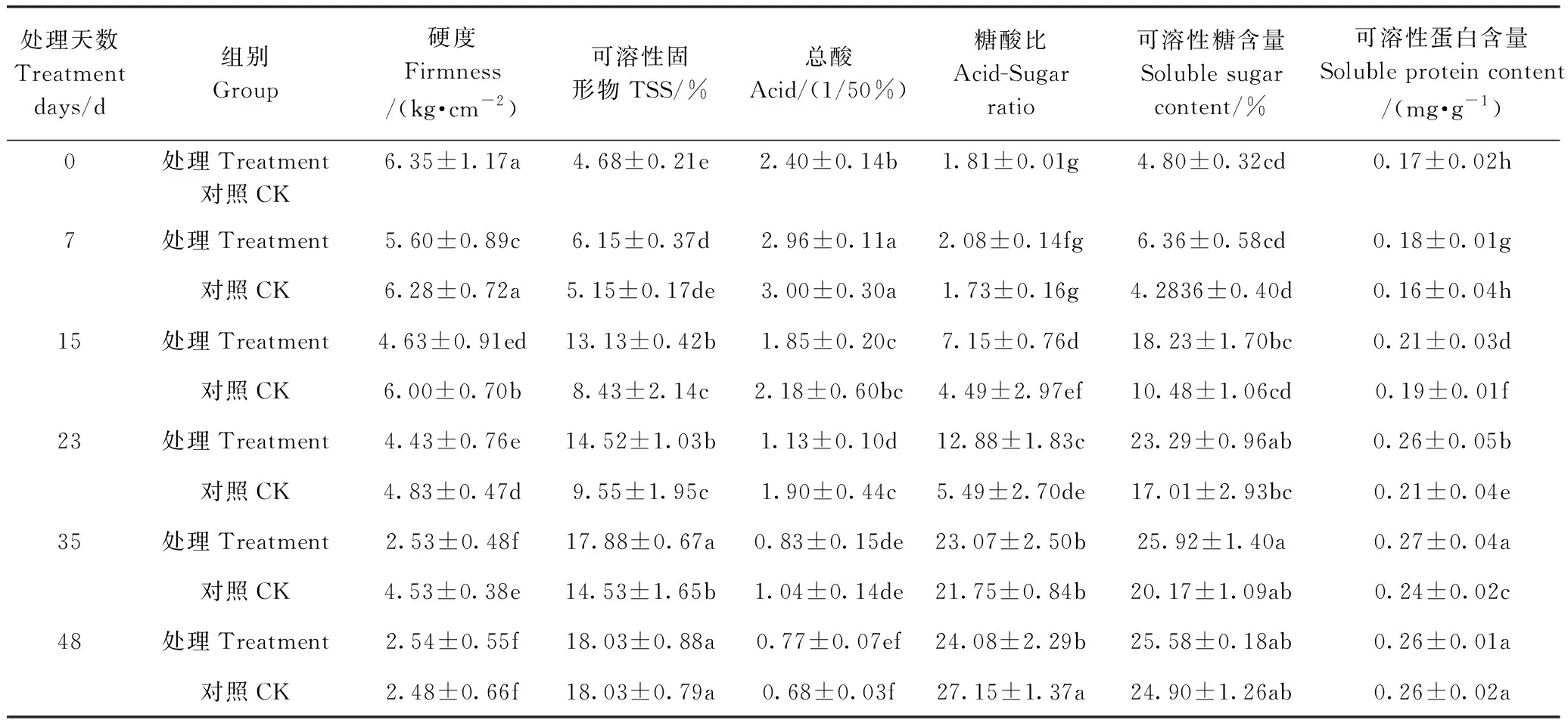
表3 环割处理对果实品质的影响Table 3 The effect of girdling treatment on fruit quality
上述结果表明,环割处理果实着色进程明显较快,但当处理后的果实完全着色时,果实的总酸含量偏高,糖酸比偏低,说明处理后糖酸转化进程慢于着色进程。
2.2 环割处理对葡萄不同组织中ABA含量的影响
葡萄果肉中,处理后ABA含量变化趋势与对照相同,均呈先上升后下降的变化,但达到峰值的时间有所提前。处理23 d时ABA含量显著高于对照,是其1.27倍;处理35 d是对照的0.83倍;处理48 d与对照无显著差异(图3-A)。ABA含量在环割处理茎段中的趋势与果肉中相似,处理7 d上升趋势明显,是对照7 d的1.21倍;处理23 d低于对照,是其0.93倍(图3-B)。ABA含量在环割处理的叶片中含量持续高于对照,且趋势均为先上升后下降;处理23 d是对照的1.27倍,处理48 d是对照的1.94倍(图3-C)。综上所述,环割处理影响不同时期不同组织中ABA含量。
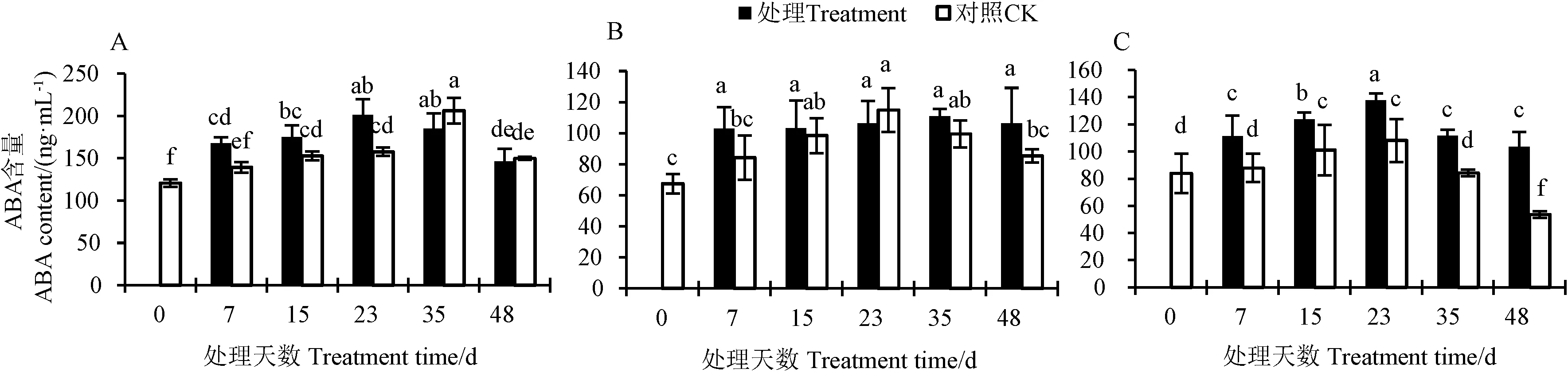
注:A:环剥后葡萄果肉中ABA含量的变化; B:环剥后葡萄茎中ABA含量的变化; C:环剥后葡萄叶片中ABA含量的变化。不同小写字母表示在P<0.05水平差异显著。下同。Note: A: Changes in ABA content in grape pulp after girdling. B: Changes in ABA content in grape stems after girdling. C: Changes in ABA content in grape leaves after girdling. Different lowercase letters indicate significant differences at 0.05 level. The same as following.图3 鄞红葡萄同组织中ABA含量的变化Fig.3 Changes of ABA content in different tissues of Yinhong grape treatment and control
2.3 环割处理对VvNCEDs表达的影响
为鉴定VvNCED基因在葡萄果实生长发育过程中的调控作用,采用qRT-PCR分析环割处理后VvNCED基因在葡萄果肉、茎段和叶片中的表达水平(图4)。
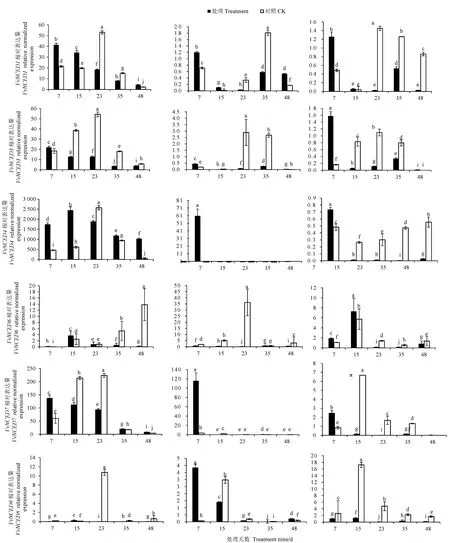
注:图中基因名称的横向从左到右分别为果肉、茎段、叶片。Note: The horizontal bar graph of gene names in the figure shows the pulp, stem and leaves from left to right.图4 VvNCED家族基因在鄞红不同组织中表达量变化Fig.4 Variation of VvNCEDs expression in different tissues between Yinhong grape
果肉中,环割处理7 d,VvNCED1、VvNCED3、VvNCED4和VvNCED7表达量显著高于对照。处理15 d,VvNCED1、VvNCED4、VvNCED6和VvNCED8表达量显著高于对照。处理后VvNCED1、VvNCED3和VvNCED7的表达量变化趋势与对照不同,为持续下降。
茎段中,处理7 dVvNCED1、VvNCED3、VvNCED4、VvNCED7和VvNCED8表达量显著高于对照。处理48 dVvNCED1表达量显著高于同时期对照,是其3.12倍。其余时期处理后的表达量均低于对照。
叶片中,处理7 dVvNCED1、VvNCED3、VvNCED4、VvNCED6和VvNCED7表达量显著高于对照。处理15 dVvNCED6表达量显著高于同时期对照,是其3.25倍。其余时期处理后的表达量均低于对照。
综上所述,果肉中的VvNCED1、VvNCED3、VvNCED4和VvNCED7的表达量在环割处理7 d后上升,表明环割处理短时间内对这4条基因在果肉中的表达量有影响,推测其可能是葡萄果肉成熟的关键因子。环割后的茎段和叶片中不同基因在不同处理组中的不同时间表达量也存在变化。结果表明家族基因具有组织特异性。
2.4 重组质粒与转化农杆菌验证结果
为了进一步验证VvNCEDs在鄞红葡萄果实成熟期的作用,构建VvNCEDs过表达载体。重组子PCR验证的电泳结果如图5所示,条带bp数正确且完整单一,测序后证明pCambia1302-NCEDs的6个重组子构建成功。重组子构建成功后,与pCambia1302空载一同转入农杆菌GV3101后再次PCR验证(图6),条带完整且单一,证明重组子成功转入农杆菌中。
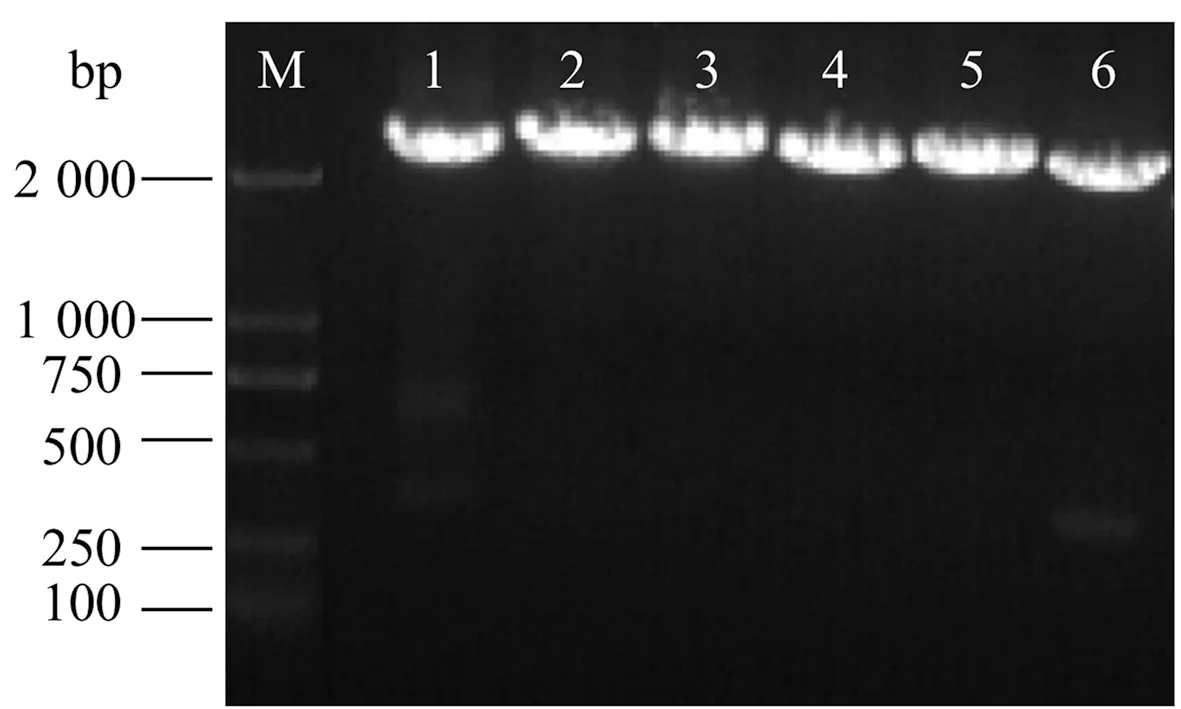
注:M:Marker;1:pCambia1302-VvNCED1; 2:pCambia1302-VvNCED3; 3:pCambia1302-VvNCED4; 4:pCambia1302-VvNCED6; 5:pCambia1302-VvNCED7; 6:pCambia1302- VvNCED8。图5 pCambia1302-VvNCED载体构建验证Fig.5 pCambia1302-VvNCED vector construction verification
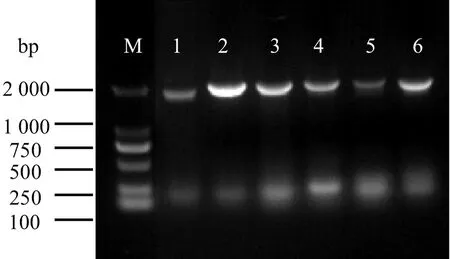
注:M:Marker;1:pCambia1302-VvNCED8;2:pCambia1302-VvNCED7;3:pCambia1302-VvNCED6;4:pCambia1302-VvNCED4;5:pCambia1302-VvNCED3;6: pCambia1302-VvNCED1。图6 pCambia1302-VvNCED载体转入GV3101验证Fig.6 pCambia1302-VvNCED vector transferred to GV3101 verification
2.5 阳性转基因葡萄果肉的筛选鉴定
提取转基因葡萄果肉DNA,PCR反应扩增结果显示,阳性pCambia1302-VvNCEDs转基因葡萄果肉中含有1 664 bp单一条带,在野生型和转空载体的葡萄果肉中未检测到(图7)。
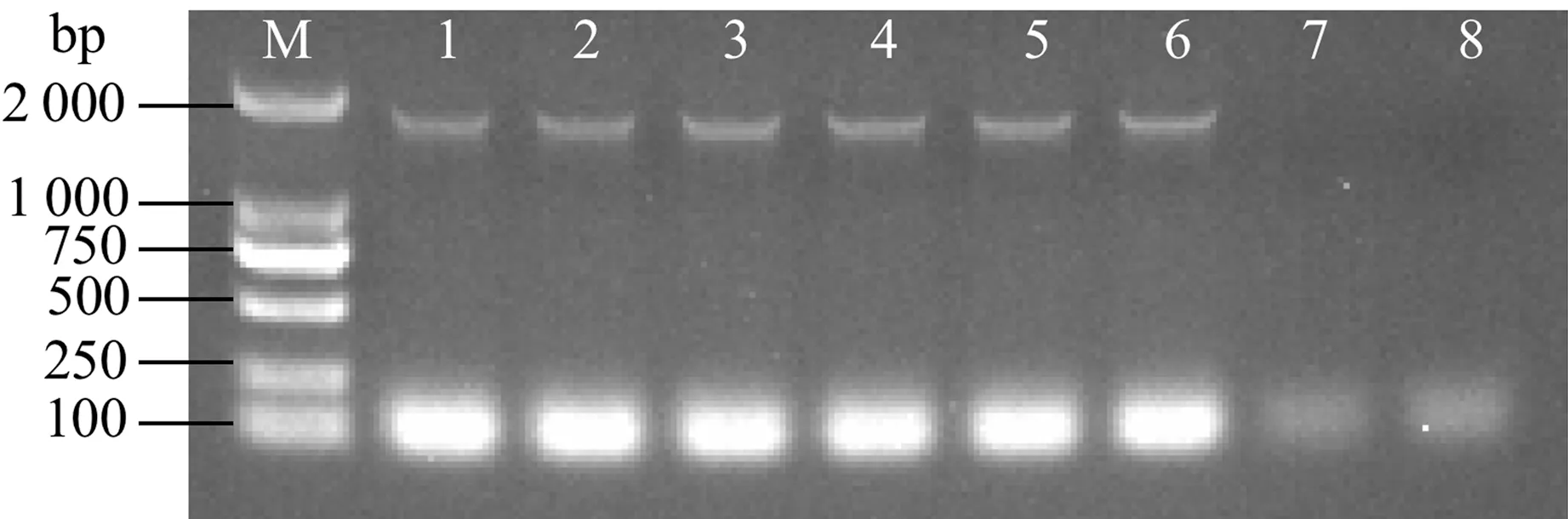
注:M: Marker;1: pCambia1302-VvNCED1. 2: pCambia1302-VvNCED3. 3: pCambia1302-VvNCED4. 4: pCambia1302-VvNCED6. 5: pCambia1302-VvNCED7. 6: pCambia1302-VvNCED8. 7: EV,空载pCambia1302转化的葡萄花序. 8: WT: 野生型。Note: M: Marker. 1: pCambia1302-VvNCED1. 2: pCambia1302-VvNCED3. 3: pCambia1302-VvNCED4. 4: pCambia1302-VvNCED6. 5: pCambia1302-VvNCED7. 6: pCambia1302-VvNCED8. 7: EV, grape inflorescence transformed with pCambia1302. 8: WT: Wild type.图7 转基因葡萄果肉DNA的PCR验证Fig.7 PCR verification of transgenic grape pulp DNA
应用qRT-PCR分析阳性转化的葡萄果肉中VvNCED基因的表达水平(图8)。结果显示,与野生型相比,被不同重组子侵染得到的阳性转基因葡萄果肉的基因表达量显著提高,证明不同的目的基因在各自的阳性转基因果肉中被过表达,尤其是VvNCED1、VvNCED4、VvNCED6和VvNCED7这4个基因,过表水平较野生型增加明显。
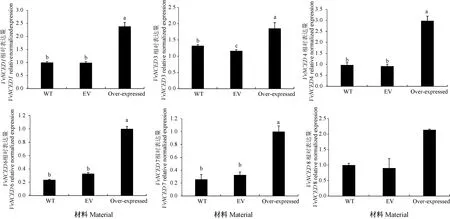
注:EV: 空载pCambia1302转化的葡萄花序;WT: 野生型。下同。Note: EV: Grape inflorescence grape inflorescence transformed with pCambia1302. WT: Wild type. The same as following.图8 阳性转基因葡萄果肉中目的基因表达分析Fig.8 Analysis of target gene expression in positive transgenic grape pulp
2.6 阳性转基因葡萄果肉中ABA含量分析
为阐述VvNCEDs在葡萄果肉中过表达是否会引起ABA含量的改变,对阳性转基因葡萄果肉中的ABA含量进行测定(图9)。结果显示,与野生型相比,不同转基因葡萄的果肉ABA含量呈不同程度的升高,过表达VvNCED1、VvNCED3、VvNCED4和VvNCED7葡萄果肉ABA含量显著提高,平均较野生组上调30%,过表达VvNCED6与VvNCED8葡萄果肉中的ABA平均较野生型上调10%,略低于上述4个基因。
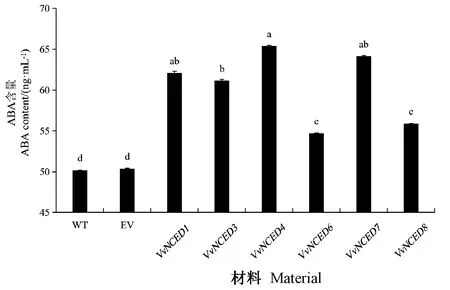
图9 阳性转基因葡萄果肉中ABA含量Fig.9 ABA content in positive transgenic grape pulp.
2.7 阳性转基因葡萄果实品质分析
为了阐述VvNCEDs在葡萄果肉过表达会引起葡萄果实品质的改变,选择阳性转基因葡萄果肉中ABA含量增幅较大(VvNCED1、VvNCED3、VvNCED4和VvNCED7)的进行果实品质测定。同天采集的同处于转色期的阳性转基因果实和野生型果实外观对比,阳性转基因葡萄果实果皮颜色偏紫(图10)。通过果实品质比较后发现(表4),阳性转基因果实的硬度、总酸均显著低于野生型,可溶性固形物、糖酸比、可溶性糖和可溶性蛋白均显著高于野生型。上述结果说明阳性转基因果实会提前进入成熟期。

图10 阳性转基因葡萄果实外观比较Fig.10 Comparison of the appearance of positive transgenic grapes
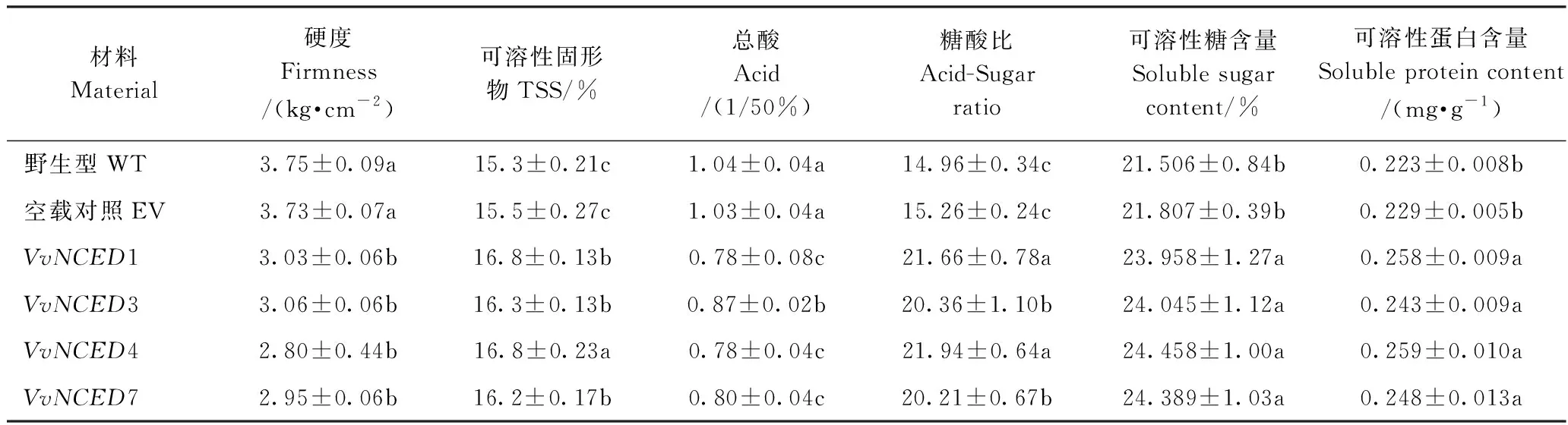
表4 阳性转基因葡萄果实品质分析Table 4 Analysis of fruit quality of positive transgenic grape
3 讨论
在本研究中,环割处理后的葡萄果实提前着色,处理35 d已呈现成熟的外观品质,较对照提前13 d成熟。ABA含量随着葡萄果实成熟进程的推进逐渐上升后下降,处理后不同时间葡萄果肉、茎段和叶片中的ABA含量与对照相比均发生了变化。ABA是葡萄果实成熟的一项重要内源性指标[8],与种子萌发、休眠、叶片衰老、器官脱落和果实成熟等各种生理活动进程调节密切相关[16]。环割推进葡萄果实成熟进程,同时葡萄果肉中的ABA含量增加显著,因此,初步断定通过调控内源ABA的含量有可能改变葡萄成熟进程。这与前人在不同物种中的研究取得了相同的结果,如不同柑橘叶中ABA含量在环割后会产生变化[17]。
NCED作为决定着ABA的合成与积累[18-21]的重要基因家族,其中VvNCED1、VvNCED3、VvNCED4和VvNCED7的表达量在果肉中环割处理7 d的果肉中,较同时期对照显著增加,推测其表达与内源ABA含量的变化存在相关性,表明上述基因可能参与了果肉中的ABA合成。葡萄VvNCED家族中不同的基因在环割后的不同组织中存在不同表达模式,这是因为基因的组织特异性[22],也存在基因响应环境胁迫的可能[9]。类似的,柑橘(Citrusclementiva)CcNCED3会在水分胁迫时特异性上调,CcNCED5则在成熟果实中被诱导表达[23];单子叶植物水稻(OryzasativaL.)OsNCED3在叶片形态和发育方面具有额外的功能,OsNCED5异位表达能够改变种子发芽与开花时间[24]。环割处理类似于环境胁迫作用,导致不同组织中NCED基因表达的改变,可能会间接或直接导致组织中内源ABA含量变化。由此可见,本研究中VvNCED基因家族表达具有组织特异性,与前人研究结果相似,如PpNCED1与PpNCED5在桃(Prunuspersica)果实的成熟中差异表达,却拥有协同调节ABA生物合成的能力[25],PpeNCED2和PpeNCED3单独的成熟诱导表达模式[26]。因此,本研究推测果肉中VvNCED1、VvNCED3、VvNCED4和VvNCED7表达可调控内源ABA含量,从而影响果实成熟进程。
为了证实这一推测,本研究构建VvNCEDs过表达体系,得到过表达VvNCEDs阳性转基因葡萄果实,并通过qRT-PCR验证过表达果肉中目的基因表达量,测定内源ABA含量和相关果实品质。研究发现,阳性转基因葡萄果肉中的目的基因表达水平显著高于野生型,ABA含量也显著高于野生型;此外,过表达VvNCED1、VvNCED3、VvNCED4和VvNCED7后的葡萄果实生长发育提前,先野生型进入成熟期。该结果进一步证实了上述4个VvNCED基因的高表达有利于提高果肉中的ABA含量,由此推测VvNCEDs的表达具有调控果实内源ABA的能力,同时VvNCEDs可以参与葡萄果肉ABA合成,促进葡萄果实提前成熟。目前已有前人研究证明了上述推测,Leng等[27]发现DkNCED1(DiospyroskakiThumb.)在与果实分离后出现高表达,与ABA含量增加相吻合;Mojtahedi等[28]研究百合休眠时发现,LlNCED(Liliumlongiflorum)在高表达时,内源ABA表现较高浓度;BnNCED3(BrassicanapusL.)的过表达有助于转基因拟南芥植物中ABA的积累[29];抑制NtNCED3(NicotianatabacumL.)表达的同时内源性ABA含量降低[30]。但不是所有VvNCED基因都会在过表达后响应果实中的ABA变化,推测与基因表达特异性有关,VvNCED6与VvNCED8可能参与不同组织与不同生长发育时期的ABA合成。综上所述,VvNCED1、VvNCED3、VvNCED4和VvNCED7的表达在鄞红葡萄果肉中具有促进ABA生物合成、调控葡萄成熟期的作用。
本研究证实了NCED基因家族中VvNCED1、VvNCED3、VvNCED4和VvNCED7表达可调控葡萄果肉中的ABA合成,促进果实成熟,明确了鄞红葡萄中VvNCEDs与ABA和果实成熟之间的关系,为鄞红葡萄成熟期调控提供了理论依据,为进一步得到葡萄新种质奠定了基础。
4 结论
本研究发现环割处理能够促进葡萄果实成熟,增加不同组织不同时期中的内源ABA含量,提高VvNCED1、VvNCED3、VvNCED4和VvNCED7基因在葡萄果肉中表达水平。同时,过表达VvNCED1、VvNCED3、VvNCED4和VvNCED7能够显著增加葡萄果肉中的ABA含量,促进果实的生长发育。证明VvNCED1、VvNCED3、VvNCED4和VvNCED7的表达在葡萄果实发育过程中具有调控ABA含量的作用。

