载P/Ag微结构Ti表面的生物学性能和抗菌性能
贾术峰,郝建华,李宝娥,王东辉,李海鹏,梁春永,王洪水
(河北工业大学 材料科学与工程学院,天津 300401)
0 引言
钛(Ti)因其优良的强度/重量比、耐蚀性和生物相容性成为医用临床上广泛使用的硬组织修复和替换材料,成功用作人工关节和牙科种植体等。但由于其不具有生物活性,植入肌体后不能与组织形成骨性结合,容易被纤维组织包裹,延长愈合时间,长期服役还可能出现植入物松动、脱落的现象。此外,钛不具有抗菌性,植入肌体后引发术后感染的几率为1%~4%,术后感染不仅严重影响植入物在体内的服役效果,而且加重患者的痛苦、提高了治疗成本。因此,对钛表面进行改性,赋予其良好的生物活性和抗菌性,对提高其综合性能、改善临床使用效果,具有重要意义。
成分和表面结构是决定材料表面性能的两个重要因素。在过去的几年中,研究者们采用各种物理和化学方法(如喷砂和酸蚀[1]、微弧氧化[2]、等离子喷涂[3]、阳极氧化[4]等)处理Ti表面以引入不同的微结构和化学成分,来提高其生物学性能和抗菌性。大量研究已表明,在Ti表面引入一定的微结构或者生物活性成分可有效改善其生物学性能,而各种有机、无机抗菌剂也常被引入到Ti表面以制备抗菌植入体。研究证实,P 可显著提高植入材料的生物学性能,载P 植入体材料相比未载P 材料,其与骨组织的接触增加率高达232%[5]。另外,银是当前应用最广泛的无机抗菌剂,已被安全应用于创伤外科手术中,可杀死多种细菌而不引起耐药性[1]。因此,在具有微结构的Ti表面引入P和Ag有望提高其生物活性和抗菌性能,获得良好的综合性能。但如何将微结构与活性成分、抗菌成分同时引入到钛表面,使其兼具良好的生物学性能和抗菌性能,是近几年的研究热点。
阳极氧化是在金属表面制备可控微结构的常用方法,成本低、操作方便,并且由于阳极氧化层是由体材部分转化而成,与致密体相之间没有截然的分界面,可以具有高的结合强度和稳定性[6]。此外,在阳极氧化过程中,电解液中的生物活性成分也可通过反应过程中的动力学和热力学梯度力引入到材料表面,进而改善材料的生物学性能[7]。因此,本研究首先利用阳极氧化技术将元素P和一种新型微结构引入到Ti表面,然后通过离心和紫外辐照的方法将Ag掺杂到该表面。本研究采用模拟体液(SBF)浸泡试验考察材料的生物活性,MC3T3-E1细胞培养实验研究其生物相容性,并采用细菌培养实验评价其对大肠杆菌的抑菌效果。
1 材料和方法
1.1 样品制备
采用TA1纯钛作为基体材料,线切割为10 mm×10 mm×1 mm的钛片,然后用不同等级的SiC砂纸对其进行打磨,至表面光亮、无明显划痕后,再将钛片依次放入丙酮、乙醇和去离子水中进行超声清洗。随后,将该钛片置于含有1 mol/L NaF的42%(质量分数)磷酸电解液中进行阳极氧化处理。该阳极氧化处理采用可程控直流电源(WYK-1206,扬州),板状高纯石墨为阴极,钛片为阳极,两电极平行放置,间距为4 cm。其他实验参数为:氧化电压50 V,氧化时间1 h,反应温度为室温。反应结束后,钛表面获得载P的微结构阳极氧化层(命名为P-Ti)。然后将该样品置于1 mol/L 的AgNO3溶液中进行离心处理,离心过程中转速设置为8 000 r/min,离心时间为30 min,随后再通过高压汞灯进行紫外光照射30 min,以在Ti表面引入抗菌剂Ag,最终得到的样品命名为Ag-P-Ti。
1.2 材料表征
分别采用扫描电镜(SEM,HITACHI S-4800)和电子能谱仪(EDS)考察样品的表面形貌和元素组成。采用X射线衍射仪(XRD,Rigaku D/max2500)测量样品的物相组成,具体参数为Cu-Kα辐射、40 kV、40 mA,扫描角度为2θ=20°~80°,步长为0.02°。材料的表面粗糙度由原子力显微镜(AFM,Agilent 5500)进行测定,亲水性通过用接触角仪(KRUSS DAS30)在室温下测量去离子水和样品表面的接触角来评估。
1.3 Ag 缓释实验
Ag的缓释曲线测定方法如下:将载Ag样品置于10 mL去离子水中,在37 ℃避光、静置保存。在预定时间,取出样品置于新的10 mL去离子水中,再次避光静置保存。重复这一过程直至得到不同时间点的银缓释溶液。然后采用电感耦合等离子体原子发射光谱(ICP-AES,PerkinElmer Optima 8300)测定溶液中Ag的含量,从而得到载Ag样品在不同时间的Ag释放量。
1.4 SBF 浸泡实验
样品的生物活性通过SBF浸泡实验进行考察。SBF溶液与人体血浆的离子浓度非常接近,研究中通常以材料能否在SBF中诱导类骨磷灰石在其表面生成作为其是否具有生物活性的判据[8]。本研究中所用SBF为1.5SBF盐溶液(离子浓度是SBF的1.5倍,并且保持了各离子之间的相对比例),以加速类骨磷灰石的形成过程,缩短实验周期。将样品浸泡于30 mL 的1.5 SBF中,在37 ℃下培养2周,然后,将样品从溶液中取出,用去离子水轻轻冲洗,空气中自然干燥后,通过扫描电镜观察样品表面类骨磷灰石的形成情况。
1.5 细胞培养实验
样品置于高压灭菌器中,在121 ℃下灭菌30 min,然后放入到24孔培养板中。将MC3T3-E1细胞(中科院上海细胞库提供)以1×104cells/cm2的密度接种在样品表面,于37 ℃、5%CO2培养箱中静置1 h,待细胞充分黏附后,加入1 mL/孔的DMEM 培养液(Gibco),该培养液中含10%胎牛血清和3%青霉素链霉素,然后再置于37 ℃、5%CO2的孵育箱中继续培养1 d、3 d、5 d。用细胞增殖计数盒(CCK-8,Dojindo,Kumamoto,Japan)检测细胞增殖情况。并将培养5 d的细胞用磷酸盐缓冲液(PBS,pH=7.4)冲洗后浸泡在2.5%戊二醛中固定过夜,随后放置在不同等级的梯度乙醇中逐级脱水[9],通过扫描电镜观察细胞形态。
1.6 细菌培养试验
通过细菌培养实验检测样品对大肠杆菌的抑制效果。将20 μL浓度为1×105cfu/mL的大肠杆菌溶液滴于样品表面,37 ℃孵育24 h。培养结束后,用生理盐水超声清洗分离样品表面的细菌。将盐溶液中的细菌重新培养于琼脂平板上24 h,观察存活菌落数[10]。
1.7 统计分析
每个样品进行3次实验,所得数据偏差都用误差棒表示。采用SAS软件对数据的统计性进行分析,当p<0.05时可认为差异有统计学意义。
2 结果与讨论
图1为Ti处理前后的表面形貌图。可以看出,作为对照样品的抛光Ti,表面相当光滑(图1a)),经阳极氧化处理后,Ti表面形成了分布均匀、直径为(120±30)nm的微孔层(图1b)),EDS能谱证实该阳极氧化层上存在一定的P元素。进一步载Ag后,表面形貌没有明显变化,但在Ti表面可见一些细小的白色颗粒(图1c))。在较高的放大倍数下,通过背散射扫描电镜观察(图1c)右上),发现该白色颗粒均匀地分布于微孔中,表明抗菌剂Ag 被成功引入到P-Ti 表面的微结构中。EDS 能谱也测得P 和Ag 元素的存在(图1d)),进一步证实样品Ag-P-Ti的成功制得。
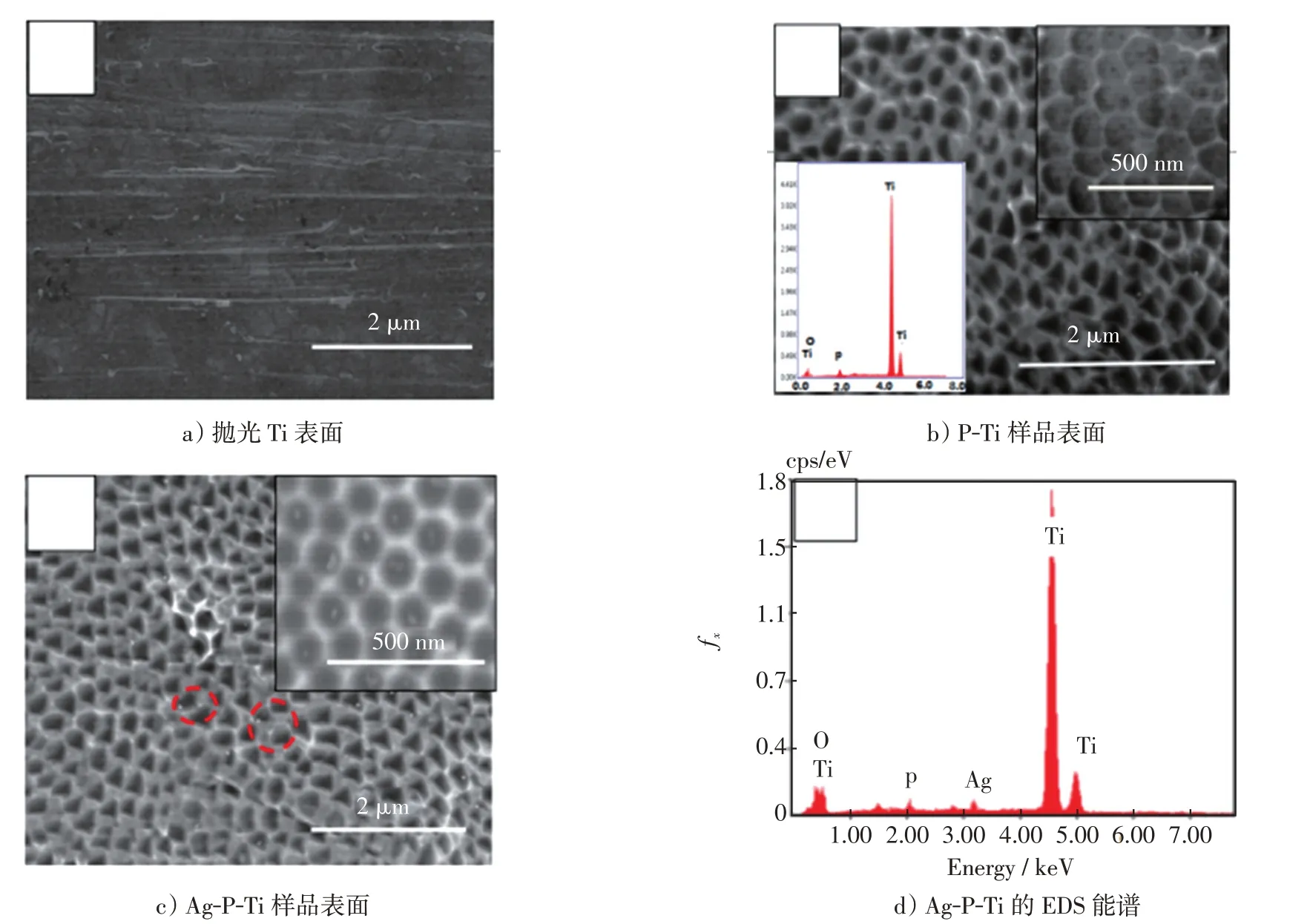
图1 Ti 处理前后的表面形貌图Fig.1 Surface morphology of the different Ti samples
然而,通过分析样品的XRD谱图,图2所示,只检测到了Ti的特征峰,这是由基体材料产生的。X射线衍射图中P 和Ag 的缺失,表明它们的含量可能太少,无法检测到。但是通过图1 中EDS 分析结果及背散射图片,可以证实一定量的P 和Ag 均已成功负载到钛表面微纳结构上。
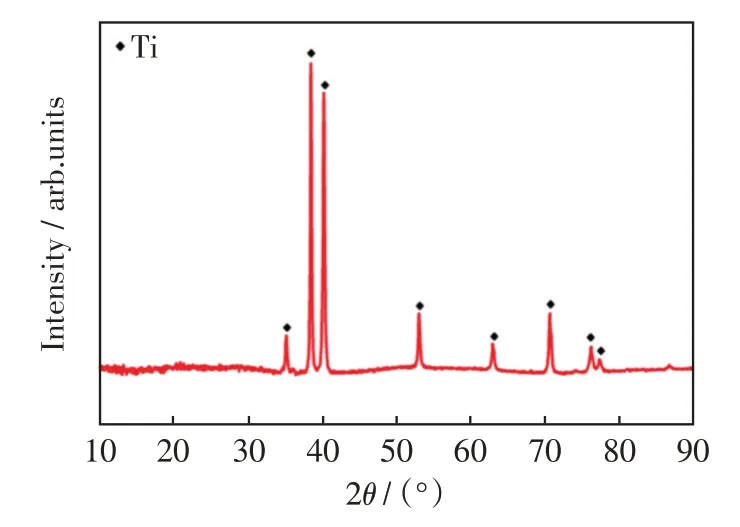
图2 Ag-P-Ti 样品的表面XRD 图谱Fig.2 XRD pattern of Ag-P-Ti samples
由于表面粗糙度和亲水性是影响材料生物学性能的关键因素。本研究考察了不同样品的表面粗糙度和亲水性,如图3所示。抛光Ti表面的粗糙度(Ra)约为(40±5)nm,阳极氧化后,表面粗糙度增加至(67±7)nm,进一步的Ag 加载过程对表面粗糙度没有明显影响。相应样品的表面水接触角分别为89°±2°、57°±5°和64°±3°。改性后的Ti表面比抛光Ti 表面具有更高的表面粗糙度和亲水性,其原因是Ti 表面存在亲水性的P 元素和多孔结构。与阳极氧化钛表面(P-Ti)相比,Ag 加载的过程并没有明显改变表面粗糙度,这可能是由于负载的Ag颗粒尺寸细小且数量较低所致,然而,在Ag的加载过程中,表面张力和一些P会被部分释放,从而导致表面自由能降低,亲水性下降[1]。大量文献证实,一定的粗糙度和良好的亲水性有利于提高材料的生物活性和生物相容性[11],因此,我们预计本研究中所制得的载P 和Ag 的多孔Ti 表面具有良好的生物学性能,能够在SBF 中诱导类骨磷灰石形成,并加速细胞在该表面的黏附和增殖。
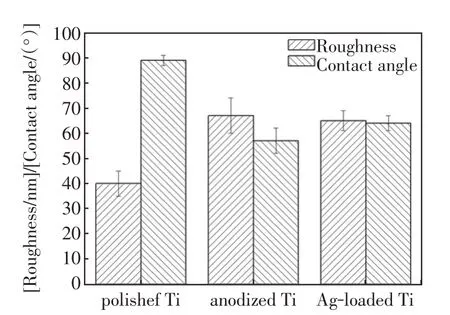
图3 不同样品的表面粗糙度和水接触角Fig.3 Surface roughness and water contact angles of the different samples
将上述不同样品在SBF中浸泡2周后,表面形貌如图4所示。可以观察到,抛光Ti表面浸泡前后没有明显的变化(图4a)),而对于阳极氧化钛表面(P-Ti)和载银钛表面(Ag-P-Ti),浸泡2周后均被一层类骨磷灰石均匀覆盖,二者的表面形态没有明显的差异(图4b)),证实Ti表面经改性处理后均具有良好的生物活性,加载Ag 不会破坏阳极氧化后Ti 表面的生物活性。基于文献,改性Ti 表面的良好生物活性可归因为,阳极氧化在Ti表面引入了亲水性较好的P和微结构,良好的亲水表面含有丰富的Ti-OH,使表面电荷为负,有利于钙、磷离子的先后沉积,最终使得磷灰石在Ti表面成核和生成。SBF浸泡的实验结果与文献和我们之前的工作结论[11]相一致。

图4 抛光Ti 样品和Ag 负载Ti(Ag-P-Ti)样品在SBF 中浸泡2 周后的表面形貌Fig.4 Surface morphologies of the polished Ti and Ag-P-Ti after immersion in SBF for 2 weeks
图5a)显示了细胞在不同样品表面的黏附和增殖情况。与MC3T3-E1细胞共培养一段时间后,发现所有样品均能促进细胞增殖。然而,多孔钛表面上的细胞增殖速度明显高于抛光钛表面(p<0.05),且阳极氧化Ti表面的细胞数量略高于Ag负载Ti表面的细胞数量(尽管统计差异不显著)。不同样品表面上细胞黏附和增殖的差异与图3所示的样品表面亲水性很好地吻合,再次证实亲水性的改善有利于细胞的黏附和增殖。观察细胞形态发现,所有样品表面均有利于细胞的黏附和铺展,细胞形态无明显差异。细胞呈典型的多角形状,从细胞体中可见大量的指状突起和丝状伪足(图5b)~d)),证实样品表面均体现出良好的细胞相容性。抗菌剂Ag的加载未对细胞的黏附、铺展和生长产生不良影响。据报道,过量的银会破坏细胞内功能,引起细胞毒性,如何在植入材料表面控制适当的银含量一直是研究的难题。在本研究中,加载的Ag颗粒没有产生明显的细胞毒性,这可能是由于材料表面的Ag含量和/或Ag的释放速率较低所致。
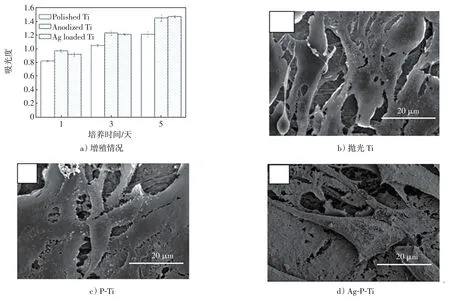
图5 MTT 法表征MC3T3-E1 细胞在不同Ti 表面的增殖情况及抛光Ti、P-Ti 和Ag-P-Ti 表面上的细胞形态Fig.5 MTT assay representing the MC3T3-E1 cell proliferation on different Ti samples,and cell morphologies on the polished Ti,P-Ti and Ag-P-Ti surfaces
图6 显示了Ag 的释放量与浸泡时间的关系。可见第1 天样品表面释放的Ag 含量较高,随时间延长,释放量逐渐降低,到第3天时,银的释放量小于第1 天释放量的一半。之后随着时间的进一步延长,Ag 的释放量减少更多,但2 周后仍能检测到Ag 的释放。有研究者指出,术后2周是植入物相关感染的高发期,因此,本研究中Ag 的释放周期对于预防术后感染是适合的。此外,在实验周期内,Ag 的总释放量为10-6水平,证实了Ag 的含量和释放率较低,不至于产生毒副作用,这也是载Ag 试样具有良好生物活性(图4)和细胞相容性(图5)的原因。
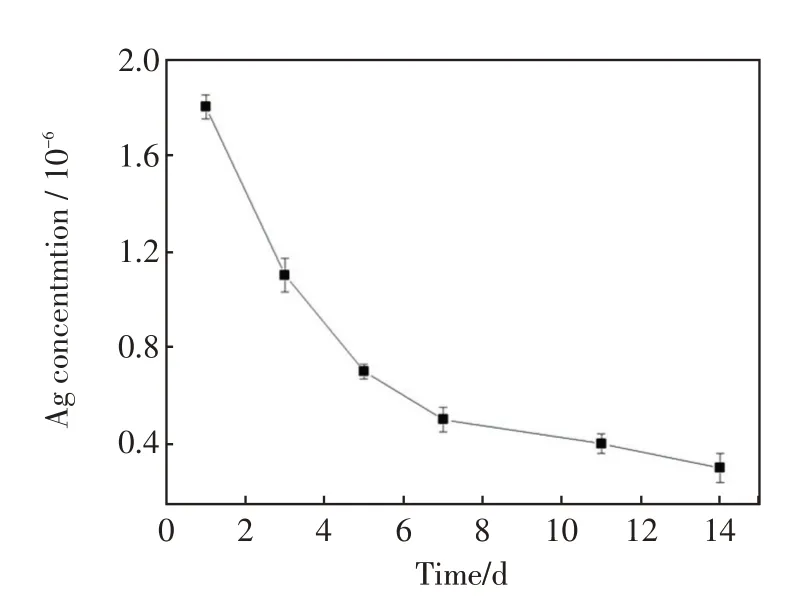
图6 Ag 的释放量随浸泡时间的变化(Ag-P-Ti)Fig.6 Ag release rate as a function of immersion time from Ag loaded Ti(Ag-P-Ti)
采用细菌培养实验考察不同样品的抗菌效果,菌落数图片如图7所示。可以看出,载Ag样品上生长的菌落数量远远小于抛光Ti表面。而阳极氧化Ti表面和抛光Ti表面的菌落数没有统计学差异。经24 h培养后,载Ag钛表面对大肠杆菌的抑菌率高达99%以上,表明其具有良好的抗菌性。
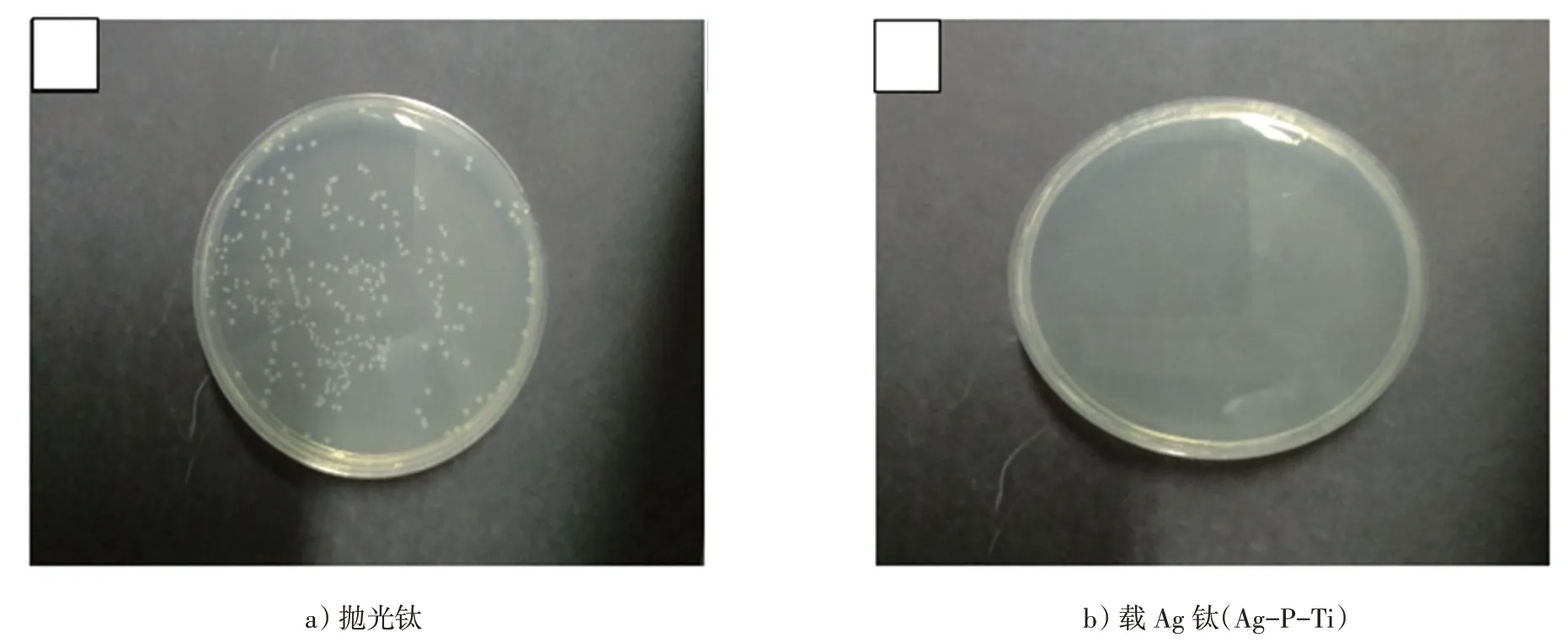
图7 抛光钛和载Ag 钛(Ag-P-Ti)表面的菌落数图片Fig.7 The number of bacterial colonies grown on polished Ti and Ag loaded Ti(Ag-P-Ti)
对于Ag 纳米颗粒的抗菌机制已有很多研究,通常认为它是通过与细菌细胞直接接触,释放Ag 离子,从而破坏细菌细胞膜、内部蛋白质和酶,导致细菌的死亡。Ag纳米颗粒可以固定在细菌的细胞壁上,通过损伤细胞膜,使得细菌死亡。银纳米颗粒也可以穿透微生物细胞内部,与蛋白质相互作用,进而导致细胞功能障碍和细菌死亡。Ag纳米颗粒和Ag离子均能产生高水平活性氧(ROS),从而抑制细菌细胞的呼吸和生长。
3 结论
1)成功在Ti表面制备了载有P和Ag的多孔微结构,Ag颗粒均匀分布在直径120±30 nm的微孔中。
2)该载P和Ag的多孔微结构具有良好的生物活性和细胞相容性,其良好的生物学性能是由于引入的磷和多孔微结构改善了表面亲水性。
3)该载P和Ag的多孔微结构中,Ag颗粒含量和释放率都很低,没有检测到明显的细胞毒性,但对大肠杆菌表现出良好的抗菌性能,且抗菌性能持续2周以上。

