高、低剂量右美托咪定对缺血性脑卒中患者取栓术后早期神经功能的改善作用及其机制
蔡伯涛,唐吉伟,廖莎,张柏银,汤霆
湖南省脑科医院麻醉手术科,长沙 410007
急性缺血性脑卒中是最常见的脑卒中类型,且病死率和致残率较高。尽早实现血管再通,恢复脑组织血流灌注是缺血性脑卒中患者的救治关键。相比溶栓治疗,堵塞血管取栓术是治疗缺血性脑卒中的主要手术方法,其创伤小、效果佳、术后恢复好[1]。但由于脑组织缺血、缺氧,患者术后常常出现不同程度的神经功能缺损。由于缺血性脑卒中发生神经功能缺损的病因和机制尚不明确,并且没有精准可靠的早期预测指标,故临床预防比较困难。右美托咪定(Dex)是α2肾上腺素受体激动剂,具有中枢性抗交感作用,能产生近似自然睡眠的镇静效果[2]。近年来,随着Dex在围手术期的应用,其改善神经元损伤发挥神经保护作用的优势也越发明显。因此,在缺血性脑卒中患者血管内支架机械取栓术中合理利用Dex,可能对减少患者术后神经功能缺损具有重要意义。本研究观察了不同剂量的Dex对缺血性脑卒中患者取栓术后早期神经功能的改善作用并探讨其可能机制,以期为此类患者临床麻醉用药提供参考。
1 资料与方法
1.1 临床资料 本研究经湖南省脑科医院医学伦理委员会批准(K2017040),选择2019年1月—2021年10月我院行血管内支架机械取栓术的缺血性脑卒中患者。纳入标准:①脑卒中6 h 内;②年龄50~65岁;③体质量55~70 kg;④美国麻醉医师协会(ASA)分级Ⅱ级或Ⅲ级;⑤术前中国脑卒中神经功能缺损程度评分量表评分<30 分;⑥患者或家属签署知情同意书。排除标准:①有严重心、肺、肝、肾及内分泌系统疾病;②有神经、精神疾病史或应用相关药物史。共选取符合标准的缺血性脑卒中患者60例,采用随机数字表法分为对照组、低剂量Dex 组、高剂量 Dex 组各 20例。对照组男 9例、女 11例,年龄(57.85 ± 4.03)岁,体质量(64.30 ± 4.74)kg,手术时间(82.55 ± 29.87)min;低剂量Dex 组男10例、女 10例,年龄(59.50 ± 4.17)岁,体质量(62.55 ±5.40)kg,手术时间(85.90 ± 33.83)min;高剂量Dex组男 12例、女8例,年龄(58.55 ± 4.29)岁,体质量(63.65 ± 4.20)kg,手术时间(76.90 ± 30.05)min。三组性别、年龄、体质量及手术时间具有可比性。
1.2 麻醉方法 低剂量Dex组和高剂量Dex组于麻醉诱导前10 min静脉注射Dex(江苏恒瑞医药股份有限公司,批号:20190062)负荷量1 μg/kg,继之分别以 0.2 μg/(kg·h)、0.5 μg/(kg·h)注射至术毕前 30 min;对照组给予等容量的生理盐水静脉注射。三组均采用咪达唑仑(0.05 mg/kg)、丙泊酚(1.5 mg/kg)、舒芬太尼(0.3 μg/kg)、顺苯磺酸阿曲库铵(0.2 mg/kg)行麻醉诱导,气管插管后连接麻醉机控制呼吸。术中通气参数设置:潮气量6~8 mL/kg,频率12~14次/分,吸呼比为1∶2,呼气末二氧化碳分压维持在35~40 mmHg,吸入氧浓度为80%,根据术中情况及动脉血气分析结果调整参数。麻醉插管后行足背动脉穿刺,持续监测有创动脉血压。术中吸入七氟烷1%~2%,持续泵入丙泊酚4~8 mg/(kg·h)、瑞芬太尼 0.1~0.3 μg/(kg·min)、顺苯磺酸阿曲库铵 0.1 mg/(kg·h)维持麻醉,并根据血流动力学指标进行调整,维持血压在术前基础血压的20%上下。术中监测麻醉深度,维持脑电双频指数值40~55,手术结束后送麻醉恢复室并常规监测。
1.3 观察指标 ①血流动力学指标:分别于麻醉诱导前(T1)、手术开始时(T2)、取栓拔管后(T3)三个时间点记录三组患者的平均动脉压(MAP)和心率(HR)。②血清脑损伤标志物及炎症因子水平:于T1、T3、术后24 h(T4)三个时间点采集患者静脉血,注入真空抗凝试剂管,静置离心后,取上层清液保存;采用ELISA法测定血清脑损伤标志物神经元特异性烯醇化酶(NSE)、S100β 蛋白及炎症因子白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)水平。③神经功能缺损程度:于T1和T4采用中国脑卒中临床神经功能缺损程度评分量表对患者神经功能进行评定,该量表共包括8个维度,分别是意识、水平凝视功能、面肌、言语、上肢肌力、手肌力、下肢肌力和步行能力;最高分45分、最低分0 分,轻型0~15 分、中型16~30 分、重型31~45 分,分数越高神经功能受损越严重[4]。
1.4 统计学方法 采用SPSS20.0 软件。计量资料以K-S检验正态性,正态分布的资料以表示,组间比较采用单因素方差分析,组内比较采用重复测量的方差分析,计数资料以例表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组各时点MAP、HR比较 见表1。
表1 三组各时点MAP、HR比较()
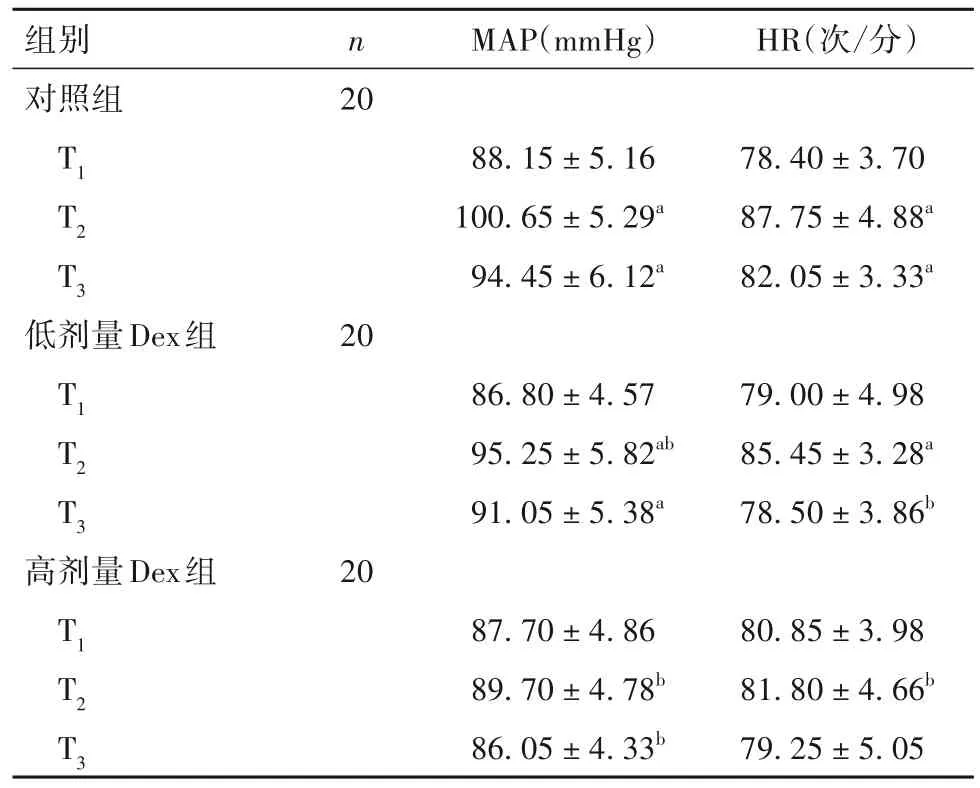
表1 三组各时点MAP、HR比较()
注:与同组T1时点比较,aP<0.05;与对照组同时点比较,bP<0.05。
组别对照组n MAP(mmHg)HR(次/分)20 T1 T2 T3 88.15±5.16 100.65±5.29a 94.45±6.12a 78.40±3.70 87.75±4.88a 82.05±3.33a低剂量Dex组20 T1 T2 T3 86.80±4.57 95.25±5.82ab 91.05±5.38a 79.00±4.98 85.45±3.28a 78.50±3.86b高剂量Dex组20 T1 T2 T3 80.85±3.98 81.80±4.66b 79.25±5.05 87.70±4.86 89.70±4.78b 86.05±4.33b
2.2 三组各时点血清NSE、S100β、IL-6、TNF-α水平比较 见表2。
表2 三组各时点血清NSE、S100β、IL-6、TNF-α水平比较()
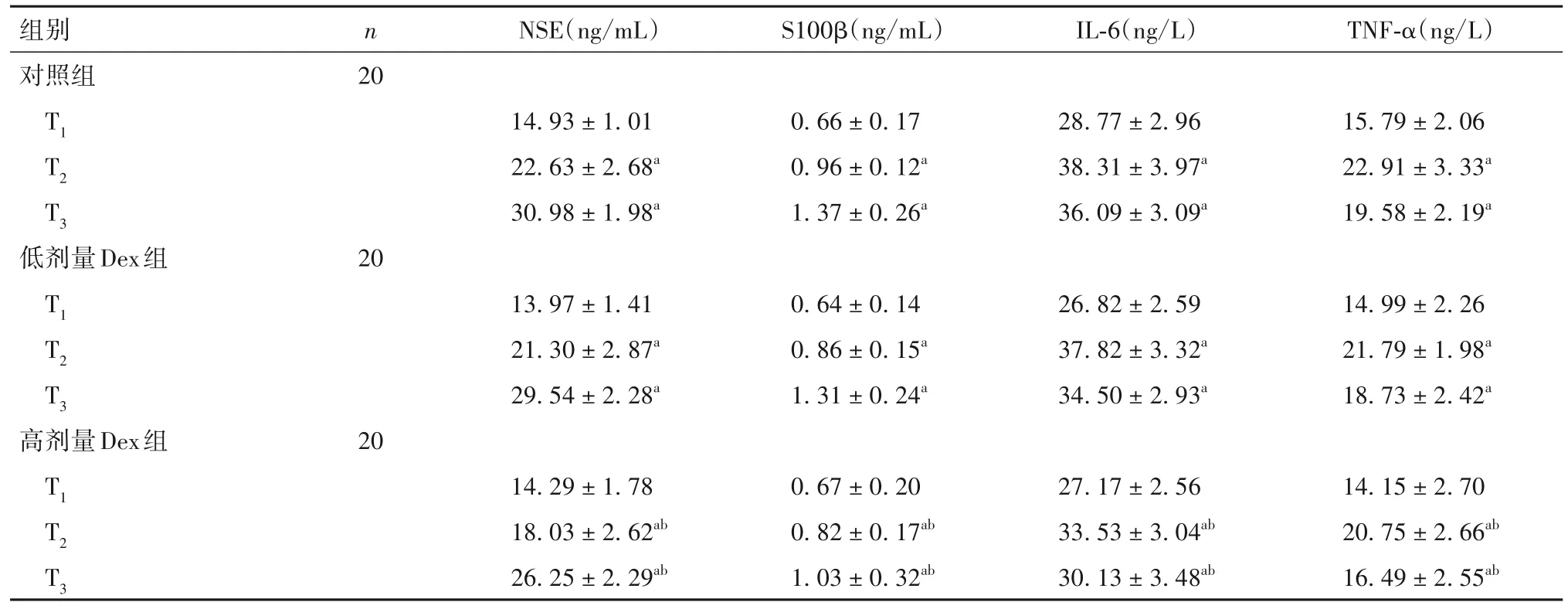
表2 三组各时点血清NSE、S100β、IL-6、TNF-α水平比较()
注:与同组T1时点比较,aP<0.05;与对照组同时点比较,bP<0.05。
组别对照组n NSE(ng/mL)S100β(ng/mL)IL-6(ng/L)TNF-α(ng/L)20 T1 T2 T3低剂量Dex组T1 T2 T3高剂量Dex组20 20 14.93±1.01 22.63±2.68a 30.98±1.98a 13.97±1.41 21.30±2.87a 29.54±2.28a 0.66±0.17 0.96±0.12a 1.37±0.26a 0.64±0.14 0.86±0.15a 1.31±0.24a 28.77±2.96 38.31±3.97a 36.09±3.09a 26.82±2.59 37.82±3.32a 34.50±2.93a 15.79±2.06 22.91±3.33a 19.58±2.19a 14.99±2.26 21.79±1.98a 18.73±2.42a T1 T2 T3 14.15±2.70 20.75±2.66ab 16.49±2.55ab 14.29±1.78 18.03±2.62ab 26.25±2.29ab 0.67±0.20 0.82±0.17ab 1.03±0.32ab 27.17±2.56 33.53±3.04ab 30.13±3.48ab
2.3 三组各时点脑卒中临床神经功能缺损程度评分比较 对照组、低剂量Dex 组、高剂量Dex 组T1时脑卒中临床神经功能缺损程度评分分别为(18.95±1.85)、(19.80 ± 2.24)、(18.60 ± 1.70)分,T4时脑卒中临床神经功能缺损程度评分分别为(12.50 ±2.44)、(11.55 ± 1.64)、(10.70 ± 1.98)分;T4时三组脑卒中临床神经功能缺损程度评分均低于T1时,T4时高剂量Dex组脑卒中临床神经功能缺损程度评分低于对照组(P均<0.05)。
3 讨论
缺血性脑卒中患者常常伴发强烈的应激反应,同时交感兴奋性增强,严重影响患者心脏功能。此外,缺血性脑卒中患者脑组织缺血、缺氧,产生大量炎症因子通过血脑屏障进入脑内,导致脑组织炎性改变,不断损伤神经细胞,引起脑水肿,导致患者出现早期神经功能缺损[3]。相关研究表明,我国缺血性脑卒中患者早期神经功能缺损的发生率约为28%,但其发生机制尚不明确,可能与脑卒中复发、脑水肿、侧支循环不良、血管再闭塞、出血性转化等机制相关[4]。
近年来,随着血管介入技术和设备的不断发展,应用血管内支架机械取栓术治疗缺血性脑卒中已取得很好的临床疗效。郑文富等[5]研究表明,支架取栓术可有效恢复缺血性脑卒中患者的神经功能,改善患者预后,且疗效显著优于溶栓治疗。但取栓术过程中对血管的机械刺激和扩张,可能引起患者血压和心率急剧增高,造成血流动力学剧烈波动,导致脑血管损伤[6]。此外,麻醉药物和手术本身引起的创伤、应激与内分泌功能紊乱可能进一步加重脑功能损害,影响患者术后早期神经功能恢复。目前,治疗缺血性脑卒中神经功能缺损的方法主要有神经保护药物、神经调节、干细胞疗法、运动康复疗法等,但是尚无有效的方法或药物预防缺血性脑卒中神经功能缺损的发生[7]。因此,取栓术后改善神经功能缺损的方法成为了研究热点。
Dex 是有效的α2肾上腺素受体激动剂,临床上适用于重病监护治疗期间开始插管和使用呼吸机患者的镇静。研究显示,Dex 可能通过多种机制发挥神经保护作用:①抑制TLR-4/NF-κB 信号通路,减轻组织炎症反应[8];②抑制神经元细胞凋亡[9];③增强机体清除氧自由基的能力,减少自由基损伤程度[10];④修复血脑屏障,调整小神经胶质细胞亚型[11];⑤降低脑组织中兴奋性氨基酸的水平[12];⑥下调神经生长抑制因子Nogo-A、低氧诱导因子1α(HIF-1α)、血管内皮生长因子(VEGF)的表达[13]。本研究将不同剂量的Dex用于缺血性脑卒中取栓术中,旨在通过药物干预减轻缺血性脑卒中患者神经功能缺损,并探究其最佳剂量。
既往研究表明,Dex 能有效抑制围术期应激反应,维持围术期循环稳定[14]。本研究中,高剂量Dex组各时点MAP 和HR 平稳,提示高剂量Dex 可减弱缺血性脑卒中取栓术中患者血流动力学波动,减轻围术期应激反应。NSE是临床中常用的脑损伤标志物,是评估脑损伤的可靠指标。大脑缺血、缺氧后,脑细胞可释放S100β 蛋白进入脑脊液,随后进入外周血,故S100β 蛋白水平也与脑损伤有关。研究发现,血清NSE、S100β 水平随神经功能缺损程度增加而呈递增趋势[15]。本研究结果显示,高剂量Dex 组NSE、S100β 蛋白水平均显著低于对照组,提示高剂量Dex 可减轻缺血性脑卒中患者取栓术后的脑损伤。IL-6 是多效能的细胞因子,在炎症反应及免疫应答中均具有重要作用。研究显示,脑缺血、缺氧后IL-6 水平升高,缺血再灌注后IL-6 水平仍维持较高水平。TNF-α 是多效性促炎细胞因子,能够促进脑缺血区炎症细胞浸润。研究表明,TNF-α 可诱导神经细胞凋亡,进一步加重脑缺血性损伤[16]。本研究结果显示,高剂量 Dex 组 IL-6 和 TNF-α 水平均低于对照组,提示高剂量Dex可减少炎症因子释放,减轻炎症反应。
中国脑卒中临床神经功能缺损程度评分量表是根据我国人群特点而制定的临床中常用的评估脑卒中患者神经功能受损严重程度的指标,能够客观反映神经功能受损情况,评分越高表示神经功能受损越严重,也提示患者病情越危急。本研究中,高剂量Dex 组在术后24 h 的脑卒中临床神经功能缺损程度评分显著低于对照组,而低剂量Dex 组与对照组评分差异无统计学意义,提示高剂量Dex 更有助于患者术后神经功能的恢复。
综上所述,缺血性脑卒中取栓术中持续输注0.5 μg/(kg·h)的 Dex 可维持血流动力学平稳、促进患者术后神经功能恢复,其机制可能与减轻炎症反应有关。本研究的不足之处在于样本量较少,且未对患者术后远期神经功能进行评估,因此需要采取更大样本量及更长随访时间的临床研究来证实Dex 对脑卒中患者取栓术后神经功能恢复的影响。

