抑制 TGF-β1/Smads 通路中 Smad7 泛素化降解改善小鼠肺纤维化的作用机制
杨珣 ,邵松军 ,崔妙雅 ,李霜 ,张湘燕 ,饶珊珊
1 贵州省人民医院呼吸与危重症医学科,贵州贵阳 550002;2 贵州航天医院呼吸与危重症医学科;3 国家卫生健康委员会肺脏免疫性疾病诊治重点实验室;4 贵黔国际总医院呼吸与危重症医学科
肺纤维化病因复杂、发病机制不清,主要病理特点为肺泡损伤、大量炎症细胞浸润、组织反复修复、细胞外基质过度沉积,致肺功能不可逆性损伤,发病率及病死率较高[1-2]。临床常用的治疗肺纤维化药物吡非尼酮、尼达尼布均只能延缓肺功能损伤,并不能延长患者生命。目前除肺移植外,仍缺乏对肺纤维化的有效治疗手段。TGF-β1/Smads 信号通路与肺纤维化的发生关系密切,Smad7 是该通路的负调控因子,可通过直接或间接作用阻止该通路转导,抑制肺纤维化进程[3-4]。根据本课题组前期实验结合文献报道发现,Smad7 蛋白表达水平在肺纤维化中下降,但基因转录水平并未下降,我们推测其机制可能与蛋白降解过多有关。研究显示,Smad7 蛋白降解主要通过泛素化降解实现[5]。MG132是一种泛素蛋白酶体抑制剂,可有效阻断靶蛋白泛素化降解[6]。2019年9月—2021年10月,本研究通过博来霉素气管内一次性给药建立了小鼠肺纤维化模型,并使用MG132 抑制 TGF-β1/Smads 通路中 Smad7 泛素化降解,观察其对小鼠肺纤维化的改善作用并分析其机制,以期为肺纤维化的治疗提供新的方向。
1 材料与方法
1.1 主要材料 体质量18~20 g 雄性C57BL/6(6周龄)小鼠,由中国第三军医大学实验动物中心提供,动物使用许可号:SCXK(yu)2012-0005。饲养于(22± 2)℃,50% ± 5%湿度,12 h 光照/黑暗循环,自由饮水和食物。10%水合氯醛溶液购自江苏艾康生物医药研发有限公司,10%多聚甲醛购自青岛捷世康生物科技有限公司,RIPA 裂解液购自碧云天生物科技公司,博来霉素购自美国Gibco,MG132 购自美国MCE,RNA提取剂TRIzol Reagent购自美国Thermo Fisher Scientific,一抗 α-平滑肌肌动蛋白(α-SMA)购自美国CST、Smad7 购自美国SANTA、胶原蛋白Ⅰ(Collagen Ⅰ)购自英国ABCAM、β-actin 购自武汉Servicebio,泛素抗体anti-Ubiquitin 购自英国ABCAM;羟脯氨酸测定试剂盒购自南京建成生物有限公司;超敏ECL化学发光试剂盒购自美国Affinity;反转录试剂盒购自美国Thermo Fisher Scientific。本研究所有动物方案均符合伦理标准。
1.2 动物建模与分组处理 将30 只小鼠试养1 周后按随机数表法分为对照组、模型组及MG132 干预组,每组10只。模型组及MG132干预组小鼠通过腹腔注射水合氯醛(4%水合氯醛,0.01 mL/g)进行麻醉,5 mg/kg博来霉素一次性气管内缓慢滴入建立肺纤维化模型,空白组小鼠不做处理。MG132 干预组于造模后第2 天起给予MG132(0.1 mg/kg)腹腔注射,1 次/天,对照组及模型组给予等量生理盐水腹腔注射。造模28 d后将各组小鼠麻醉处死,采用4%多聚甲醛将小鼠的左肺下叶组织固定,制作石蜡切片。余左肺上叶及右肺组织保存于-80 ℃冰箱用于后续实验。
1.3 肺纤维化程度观察方法 ①肺组织形态学观察:采用HE 染色。将制作好的石蜡切片脱蜡液脱蜡、透明、脱水,去离子水浸洗后,苏木素染色1 min,1%盐酸乙醇分化,蒸馏水冲洗;1%伊红染色30 s,脱水、脱蜡液透明、中性树胶封片,显微镜观察。②肺组织胶原含量观察:采用Masson 染色。将制作好的石蜡切片脱蜡至水,苏木素染5~10 min,PBS 漂洗后酸性乙醇分化液分化,Masson 蓝化液返蓝3 min,流水冲洗后品红染液染色5~10 min,蒸馏水稍冲洗,1%磷钼酸水溶液处理1 min;苯胺蓝液或绿液复染2 min,0.2%冰醋酸处理1 min,90%乙醇脱水,无水乙醇脱水,Xylenes 透明,中性树胶封片,显微镜观察。③肺组织中羟脯氨酸含量检测:采用ELISA 法。使用羟脯氨酸测定试剂盒测定肺组织匀浆中羟脯氨酸含量,每个样品的吸光度用酶标仪在550 nm 处读取。使用已知羟脯氨酸含量的样品生成标准曲线,并根据标准曲线计算肺组织中羟脯氨酸的含量(以肺湿组织质量μg/g 为单位)。每只小鼠用不同的肺组织标本重复实验3次。肺组织羟脯氨酸含量越高,代表小鼠肺纤维化程度越高。
1.4 肺组织α-SMA、Smad7、Collagen Ⅰ蛋白表达检测 采用Western blotting 法。取出在-80 ℃冰箱中保存的肺组织,将组织块用冷PBS 洗涤2~3 次后剪成小块放入匀浆管中,用细胞裂解液(含PIPA 裂解液、蛋白酶抑制剂混合物和磷酸酶抑制剂混合物)提取各组肺组织总蛋白,制成蛋白样品后,SDS-PAGE电泳分离蛋白,转膜,封闭。分别孵育相应一抗α-SMA(1∶400)、Collagen Ⅰ(1∶400)、Smad7(1∶400)、β-actin(1∶1 000),4 ℃冰箱过夜,次日洗膜,室温孵育辣根过氧化物酶标记的羊抗兔IgG(1∶6 000)和羊抗小鼠IgG(1∶6 000),ECL 显影液曝光。灰度值采用Image Lab扫描并记录,以目的蛋白条带与β-actin条带灰度值的比值表示α-SMA、Smad7、Collagen Ⅰ蛋白相对表达量。
1.5 肺组织 α-SMA、TGF-β1、Collagen Ⅰ、Smad7 mRNA表达检测 采用qRT-PCR法。取各组肺组织约 100 mg 到无 RNA 酶匀浆管中,加入 1 mL 的TRIzol Reagent,根据 TRIzol Reagent 说明书上的步骤提取各组肺组织的总RNA,然后按照反转录试剂盒说明书步骤将总RNA 反转录为cDNA,以cDNA为模板进行PCR 扩增。引物序列:α-SMA 上游引物为5′-CCAGCACCATGAAGATVAAG-3',下游引物为 5′-TGGAAGGTAGACAGCGAAGC-3′;TGF-β1上游引物为5′-ACCATGCCAACTTCTGTCTG-3′,下游引物为 5′-CGGGTTGTGTTGGTTGTAGA-3′;Collagen Ⅰ 上 游 引 物 为 5′-AAAGACGGACTCAACGGTCTC-3',下游引物为 5′-AAGCTGAAGTCATAACCGCCA-3′;Smad7上游引物为5′-AGCCCTCCCTGGATATCTTCT-3′,下游引物为 5′-CTTGCTCCGCACTTTCTGTAC-3′;GAPDH 上游引物为 5′-GGTTGTCTCCTGCGACTTCA-3',下游引物为5′-TGGTCCAGGGTTTATTACTCC-3′。以 GAPDH 为内参,按2-ΔΔCt计算α-SMA、TGF-β1、Collagen Ⅰ、Smad7 mRNA相对表达量。
1.6 肺组织Smad7 泛素化水平检测 采用免疫沉淀(IP)将 Smad7 蛋白分离,免疫印迹(IB)观察Smad7泛素化降解情况。取小鼠肺组织放入匀浆管中,加入 PIPA 裂解液中及 1.0 μg IgG(与 IP 实验用于沉淀的抗体种属来源相同的普通IgG)和20 μL A/G 磁珠,将混合液混匀,4 ℃摇转孵育1 h 后离心5 min(4 ℃,2 000 r/min);取上清液加入Smad7 一抗(1∶1000),使相互作用的两种蛋白质其中一种沉淀,4 ℃孵育过夜;加入 80 μL A/G 磁珠,混匀后 4 ℃摇转孵育2 h,离心5 min(4 ℃,1 000 r/min);取上清液收集免疫复合物,用1 mL IP 裂解液洗涤4 次,每次均离心5 min(4 ℃,1 000 r/min),洗涤后去除上清;加入80 μL 上样缓冲液沸水煮10 min,沸水浴后离心5 min(4 ℃,1 000 r/min)取上清液,用免疫沉淀得到的Smad7 蛋白上清液样品,孵育一抗为泛素抗体(1∶1 000),上样做Western blotting 检测。Input 道上样为未做IP 前的对照组蛋白样品,余电泳步骤同“1.4”。
1.7 统计学方法 采用SPSS16.0 统计软件。计量资料通过Sample K-S 进行正态检验,符合正态分布的以表示,组间比较行t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠肺纤维化程度比较 HE染色结果显示,对照组小鼠肺组织肺泡间隔、肺泡腔无明显异常,结构完整;模型组小鼠肺泡腔狭窄、塌陷,肺泡间隔增厚,肺泡、气管周围血管见较多中性粒细胞、巨噬细胞浸润,肺组织正常结构遭到破坏;MG132 干预组小鼠肺泡腔破坏、肺泡间隔增厚等改变减轻,炎症细胞浸润减少,肺组织结构破坏程度减轻。见OSID码图1a。Masson染色结果显示:对照组镜下蓝紫色面积最小,肺泡间隔、肺泡间质、肺泡壁结构基本完整,无明显胶原纤维沉积;模型组镜下见大片蓝紫色视野分布在肺间质、肺泡间隔,显示胶原纤维大量沉积。MG132 干预组蓝紫色视野面积较模型组缩小,肺组织纤维化病变程度较模型组轻。见OSID码图1b。羟脯氨酸含量检测结果显示,对照组、模型组及MG132 干预组小鼠肺组织羟脯氨酸含量分别为(1.23 ± 0.61)、(2.25 ± 0.82)、(1.79 ± 0.52)μg/mg,肺组织羟脯氨酸含量模型组>MG132 干预组>对照组(P均<0.05)。
2.2 各组小鼠肺组织α-SMA、Smad7、Collagen Ⅰ蛋白表达比较 各组小鼠肺组织α-SMA、Collagen Ⅰ蛋白表达比较,模型组>MG132 干预组>对照组;Smad7 蛋白表达比较,对照组>MG132 干预组>模型组(P均<0.05)。见表1。
表1 各组小鼠肺组织α-SMA、Smad7、Collagen Ⅰ蛋白表达比较()
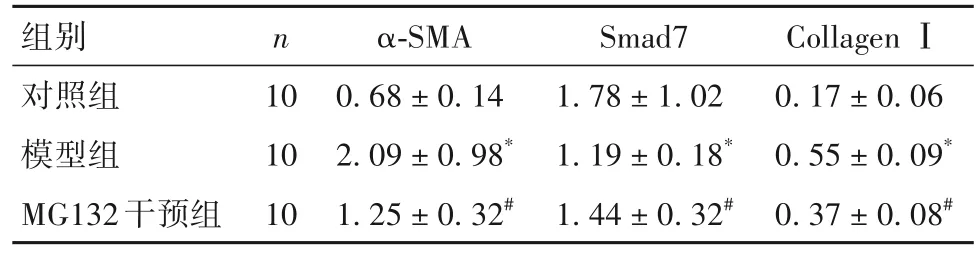
表1 各组小鼠肺组织α-SMA、Smad7、Collagen Ⅰ蛋白表达比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别对照组模型组MG132干预组Collagen Ⅰ0.17±0.06 0.55±0.09*0.37±0.08#n 10 10 10 α-SMA 0.68±0.14 2.09±0.98*1.25±0.32#Smad7 1.78±1.02 1.19±0.18*1.44±0.32#
2.3 各组小鼠肺组织α-SMA、Smad7、CollagenⅠ、TGF-β1mRNA 表达比较 各组小鼠肺组织α-SMA、Smad7、Collagen Ⅰ、TGF-β1mRNA 表达比较,模型组>MG132 干预组>对照组(P均<0.05)。见表2。
表2 各组小鼠肺组织α-SMA、Smad7、Collagen Ⅰ、TGF-β1 mRNA表达比较()
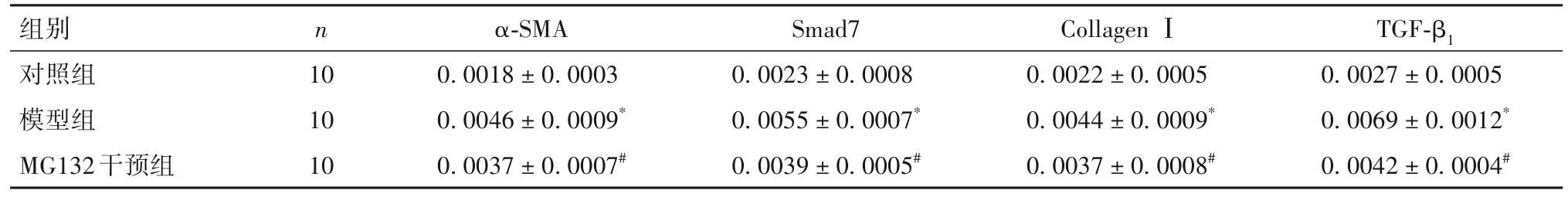
表2 各组小鼠肺组织α-SMA、Smad7、Collagen Ⅰ、TGF-β1 mRNA表达比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别对照组模型组MG132干预组TGF-β1 0.0027±0.0005 0.0069±0.0012*0.0042±0.0004#n 10 10 10 α-SMA 0.0018±0.0003 0.0046±0.0009*0.0037±0.0007#Smad7 0.0023±0.0008 0.0055±0.0007*0.0039±0.0005#Collagen Ⅰ0.0022±0.0005 0.0044±0.0009*0.0037±0.0008#
2.4 各组小鼠肺组织Smad7 泛素化水平比较 各组小鼠肺组织Smad7 泛素化水平比较,模型组>MG132干预组>对照组。见图1。
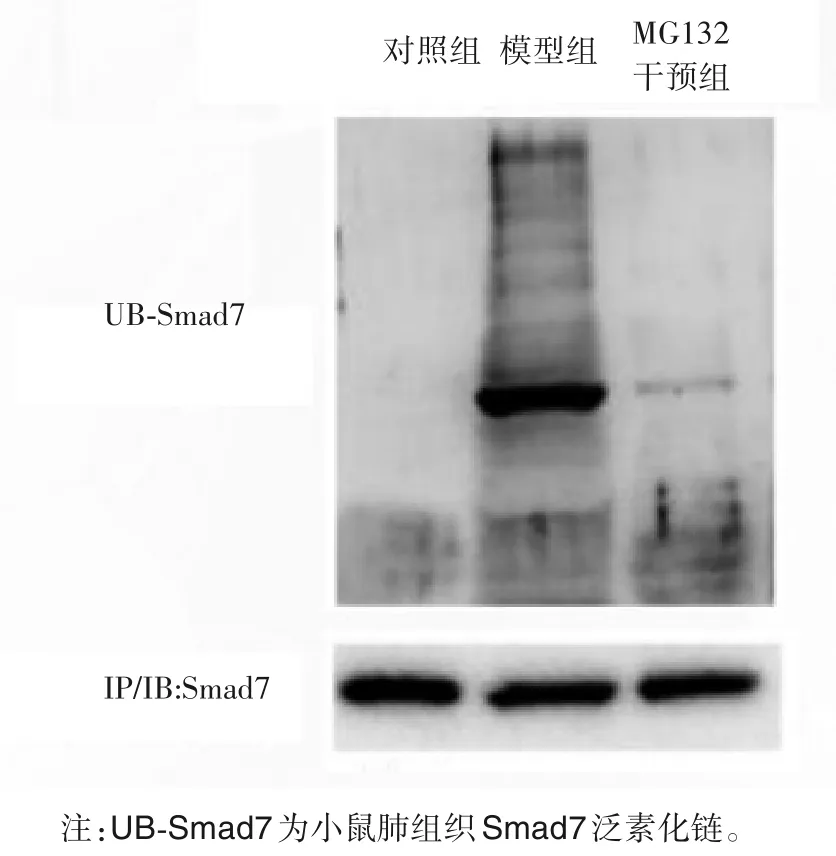
图1 各组小鼠肺组织Smad7泛素化水平比较
3 讨论
博来霉素气管内一次性给药是目前常用的构建肺纤维化模型的方法,肺纤维化的病理生理特征包括肺泡炎症损伤后异常纤维化性修复[7-8]。肺泡损伤后,TGF-β/Smads通路激活,肺泡上皮细胞向间充质细胞转化,α-SMA 表达减少,诱导成纤维细胞活化增殖、转化,产生大量胶原,异常沉积在细胞外基质引起肺纤维化。Collagen Ⅰ是肺纤维化组织中主要成分之一,而羟脯氨酸是Collagen Ⅰ的重要组成成分,仅在弹性蛋白和胶原蛋白中表达,但在动物组织胶原中几乎均存在,因此胶原含量的多少可以判断肺组织肺纤维化的程度。本实验结果显示,建模28 d后,模型组肺组织HE染色可见肺组织结构遭到破坏,肺泡腔出现塌陷狭窄,肺泡间隔异常增厚,肺间质中较多炎性细胞浸润;Masson 染色镜下显示胶原蛋白呈现为蓝紫色,模型组蓝紫色面积明显扩大,提示胶原蛋白含量增多;同时,模型组肺组织羟脯氨酸含量增多也表示模型组肺组织胶原蛋白含量增多。而根据我们的观察,MG132 干预组肺纤维化程度较模型组有一定的改善,提示抑制Smad7 泛素化降解对改善小鼠肺纤维化有积极的作用。
肺纤维化的发病机制尚不清楚,大多数学者认为主要与TGF-β1/Smads 信号通路激活、自噬不足、氧化损伤、端粒缩短及表观遗传学改变(DNA 甲基化、组蛋白去乙酰化)等有关[9-10]。TGF-β1mRNA 和蛋白表达在肺纤维化中均升高,其与上皮间充质转化过程关系密切,在肺纤维化中发挥关键作用。本实验结果也显示,模型组肺组织中TGF-β、α-SMA Collagen ⅠmRNA 及蛋白表达水平均有升高,提示给予小鼠博来霉素气管滴注后,TGF-β1/Smads 信号通路激活并发挥了致纤维化效应,与本课题组前期研究及文献报道一致[6]。
有研究显示,在肺纤维化中,Smad7蛋白表达下降,上调Smad7 表达水平能减轻肺纤维化[11]。本研究发现,模型组肺组织中Smad7 蛋白表达水平较对照组明显降低,但是其基因转录水平并未下降。与对照组比较,模型组Smad7 mRNA 表达上调,与其蛋白表达水平相反。这与本课题组前期肺纤维化模型实验结果一致,也与其他学者实验结论相符合[6]。Smad7 的mRNA 表达增多,说明基因转录并未受到抑制,而Smad7 的蛋白水平下降可能与其降解增多有关。有研究发现,泛素化是Smad7 蛋白的主要降解方式[12]。泛素蛋白酶体抑制剂MG132 可阻断靶蛋白泛素化降解,有研究显示MG132 具有抗纤维化作用,但其抗纤维化机制至今尚不明确[13-14]。泛素蛋白酶体途径蛋白降解的重要途径之一,真核细胞内蛋白质可被该途径特异性降解。泛素连接酶中的Smad 泛素化调节因子2(Smurf2),在TGF-β1/Smads信号通路中能够选择性泛素化降解Smad7,从而调节TGF-β1/Smads 信号通路的转导,影响脏器纤维化的发生发展[15]。我们的研究结果显示,在模型组肺组织中,Smad7 蛋白泛素化水平明显增高。这提示Smad7基因转录和蛋白表达水平不一致的现象可能与Smad7蛋白泛素化水平增高导致Smad7蛋白降解增多有关,在一定程度上解释了为什么Smad7 在肺纤维化中基因转录活化增强但是其蛋白水平降低的原因。Smad7蛋白水平下降导致其对TGF-β1/Smads的负性调节作用减弱,从而与本实验结果中纤维化基因α-SMA、Collagen Ⅰ表达增多,羟脯氨酸含量增加相符合。
本研究使用MG132 干预小鼠肺纤维化模型,发现Smad7 泛素化水平下降,Smad7 蛋白表达增高,小鼠肺纤维化病理改变减轻,α-SMA、Collagen Ⅰ基因表达下调、蛋白表达减少,羟脯氨酸含量减少,这可能是MG132 抑制了Smad7 蛋白泛素化降解,从而提高了Smad7 对TGF-β1/Smad 信号通路的负向调控作用。研究显示,Smad7 可以在细胞核内与Smurf2 形成复合物,该复合物与TGF-β1受体TβRⅠ在细胞质内脂质小囊结合,在Smurf2的作用下,TβRⅠ泛素化降解。且有研究发现,MG132 可通过调节Smurf2/Smad7信号传导调控小鼠肺血管内皮细胞向间充质细胞转化,从而抑制肺纤维化的发生发展[14]。因此,MG132 可能作用于Smurf2-Smad7 复合物,通过抑制Smurf2 从而抑制Smad7 泛素化降解,但其具体机制需要结合体外实验进一步研究。
综上所述,本研究通过博来霉素气管内一次性给药建立了小鼠肺纤维化模型,并给予泛素蛋白酶体抑制剂MG132 进行干预。研究结果显示,MG132可改善博来霉素诱导的小鼠肺纤维化,下调纤维化基因α-SMA、Collagen Ⅰ等的表达,该机制可能与MG132 抑制 Smad7 泛素化降解,从而上调 Smad7 蛋白表达,增强 Smad7 对 TGF-β1/Smads 信号通路的负性调节作用有关。

