乳腺癌中PGRMC1表达与临床病理参数的相关性
赵 越 阮祥燕 程姣姣 谷牧青 许 新 王月姣
(首都医科大学附属北京妇产医院/北京妇幼保健院内分泌科,北京 100026)
每位女性都会经历绝经,其中大部分会出现绝经相关症状,这影响了中老年女性的健康并显著降低了其生活质量。到目前为止,绝经激素治疗(menopausal hormone therapy, MHT)是治疗绝经相关症状和预防骨质疏松等最有效的方法[1-2]。然而,MHT的安全性问题,如乳腺癌,仍是困扰医生和患者的重要问题[3]。在我国,乳腺癌是女性发病率最高的恶性肿瘤。近年来,乳腺癌发病率呈明显上升趋势,55~65岁为第二个发病高峰,已逐渐成为威胁女性生命健康最常见的疾病之一[4-5]。目前,全球对乳腺癌发病机制做了很多研究,而对于激素应用过程中乳腺癌风险增高的原因,则没有定论。乳腺癌是激素依赖性肿瘤,其生长受雌激素受体、孕激素受体调控。现今普遍认为其受体表达对判断乳腺癌患者的预后、选择治疗方案和预测疗效等方面都有重要意义[6]。
本课题组在前期预实验研究[7-10]中发现孕激素受体膜组分1(progesterone receptor membrane component 1, PGRMC1)在乳腺癌组织中高表达,很可能是乳腺癌的独立预后因子。基于PGRMC1在乳腺癌的发生、发展中可能具有重要的作用,尤其是预测肿瘤的大小、淋巴结转移及组织学分级等重要的与侵袭转移和预后密切相关的指标,本研究将分析乳腺癌组织、乳腺良性肿瘤组织中PGRMC1表达的差异情况,同时分析乳腺癌患者中PGRMC1与人类表皮生长因子受体2(human epidermal growth factor receptor-2, Her-2)、细胞增殖核抗原(nuclear-associated antigen, Ki-67)及雌激素受体(estrogen receptor, ER)、孕激素受体 (progesterone receptor, PR)表达之间可能存在的联系,为明确PGRMC1与乳腺癌恶性增殖间的相关性提供相应的临床数据。
1 对象与方法
1.1 研究对象
选取2017年9月至2019年1月间于首都医科大学附属北京妇产医院乳腺外科就诊诊断为乳腺癌的患者的乳腺癌组织标本90例,患者年龄24~70岁,年龄中位数为47岁。乳腺良性疾病标本60例,正常乳腺组织60例(来自经乳腺麦默通微创旋切良性疾病周围1 cm左右的正常组织,病理证实乳腺组织无异常者),60例乳腺良性疾病患者年龄26~65岁,年龄中位数为45岁,均为女性,所有组织来源者在术前经空心针活检或经术后病理组织学检查确诊。本研究经首都医科大学附属北京妇产医院伦理委员会批准(伦理批号:IEC-B-03-V01-FJ1),所有入组参加研究者均自愿签署知情同意书。
1)纳入标准:①乳腺癌:病理诊断乳腺癌(无论有无淋巴结转移),无其他恶性肿瘤治疗史,所有患者均未经过任何术前针对性治疗,足够可利用的组织标本。②乳腺良性疾病:乳腺纤维腺瘤,乳腺导管内乳头状瘤,乳腺囊性增生病。
2)排除标准:男性乳腺癌,术前接受任何形式新辅助化学药物治疗(以下简称化疗)、靶向治疗等的患者,近3个月内接受激素替代治疗者。
1.2 蜡块制备、免疫组化检测
实验组织取材1.0×1.0×0.5 cm3,以4%(体积分数)多聚甲醛固定1周。组织流水冲洗过夜,脱水、透明及浸蜡。石蜡包埋的病理组织块,行4 μm厚连续切片7张,进行免疫组化及苏木精-伊红(hematoxylin-eosin, HE)染色。采用磷酸盐缓冲溶液(phosphate buffer saline, PBS)代替一抗作为阴性对照,用一只阳性切片作为阳性对照,实验步骤按照试剂盒方法介绍进行。ER 1∶100、PR 1∶50、Her-2 1∶200、Ki-67 1∶300、PGRMC1 1∶100稀释原液备用。石蜡切片脱蜡至水后进行抗原修复、内源性过氧化物酶阻断、血清封闭、加一抗、二抗[一抗是山羊来源的用10%(体积分数)正常兔血清封闭,一抗其他来源的用3%(体积分数)牛血清白蛋白封闭]。二氨基联苯胺(3,3’-diaminobenzidine, DAB)显色、苏木精复染细胞核后脱水封片。采用组织切片扫描仪及Pannoramic viewer软件存储切片,免疫组织化学半定量评分进行阅片[11]。
1.3 病理诊断及评估
所有患者病理诊断依据术后病理诊断结果。乳腺癌组织学类型:浸润性导管癌80例,浸润性小叶癌5例,导管内癌1例,乳头状癌3例,髓样癌1例;病理诊断和分期按照美国癌症联合会(American Joint Committee on Cancer, AJCC)修订的乳腺癌分期(第7版)标准[12];组织学病理分级依照世界卫生组织 (World Health Organization, WHO)的标准[13]进行分级:Ⅰ级21例,Ⅱ级38例,Ⅲ级31例。乳腺良性疾病组织学类型:乳腺腺病(瘤)24例,乳腺纤维腺瘤28例,乳腺导管内乳头状瘤8例。
1.4 免疫组化结果的判读和评估
将未经化疗的阳性乳腺癌组织切片作为阳性对照,同时用抗体稀释液代替一抗作为阴性对照。每张切片随机选择5个具有代表性的视野观察阳性细胞着色强度,其中ER、PR、Ki-67的阳性以细胞核呈现棕黄色颗粒状染色为主,少数为较弱的细胞质染色;PGRMC1、Her-2表达产物主要定位在细胞质和(或)细胞膜,以细胞膜/细胞质呈棕褐色或者棕黄色判定为阳性,阳性细胞数>5%为阳性(+),≤5%为阴性(-)。苏木精染细胞核为蓝色,DAB显出的阳性表达为棕黄色。
1.5 统计学方法
采用SPSS 19.0统计软件对数据进行分析。组间率的比较采用χ2检验或者Fisher确切概率法。PGRMC1阳性表达与相关因子间的关系采用配对χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 3组患者基本信息、临床病理特征及PGRMC1表达情况比较
乳腺癌组织、乳腺良性疾病组织及正常乳腺组织患者基本信息、临床病理特征及PGRMC1等相关蛋白表达情况,详见表1。乳腺癌组织HE染色镜下显示,乳腺癌组织学Ⅰ级:癌细胞以腺样、索状结构为主,核仁均不明显,核分裂罕见(图1A)。乳腺癌组织学Ⅱ级:癌细胞以索状和巢团状排列为主,腺样少见,核分裂易见(图1B)。乳腺癌组织学Ⅲ级:癌细胞以巢团为主,细胞核多形性和分裂象均较显著,核仁易见(图1C)。乳腺浸润性导管癌组织中PGRMC1的表达阳性率为63.33%(57/90),乳腺良性疾病组织中的表达阳性率为28.33%(17/60),正常对照组PGRMC1表达阳性率仅为6.67%(4/60),3组间PGRMC1的表达阳性率差异有统计学意义(P<0.05)。

表1 PGRMC1、ER、PR、Her-2、Ki-67蛋白表达情况及临床基本特征Tab.1 Expression of PGRMC1, ER, PR, Her-2, Ki-67 and clinical basic characteristics n(%)
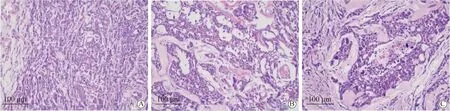
图1 不同分级的乳腺癌组织Fig.1 Different grade of breast cancer tissue (HE staining,200×)
各组PGRMC1的免疫组织化学染色结果显示,乳腺癌组织中细胞膜棕色深染、着色强度明显(图2A、2D);乳腺良性疾病组织中细胞膜淡黄色染色,着色强度中等(图2B、2E);正常乳腺组织中细胞膜几乎无染色,着色强度弱(图2C、2F)。
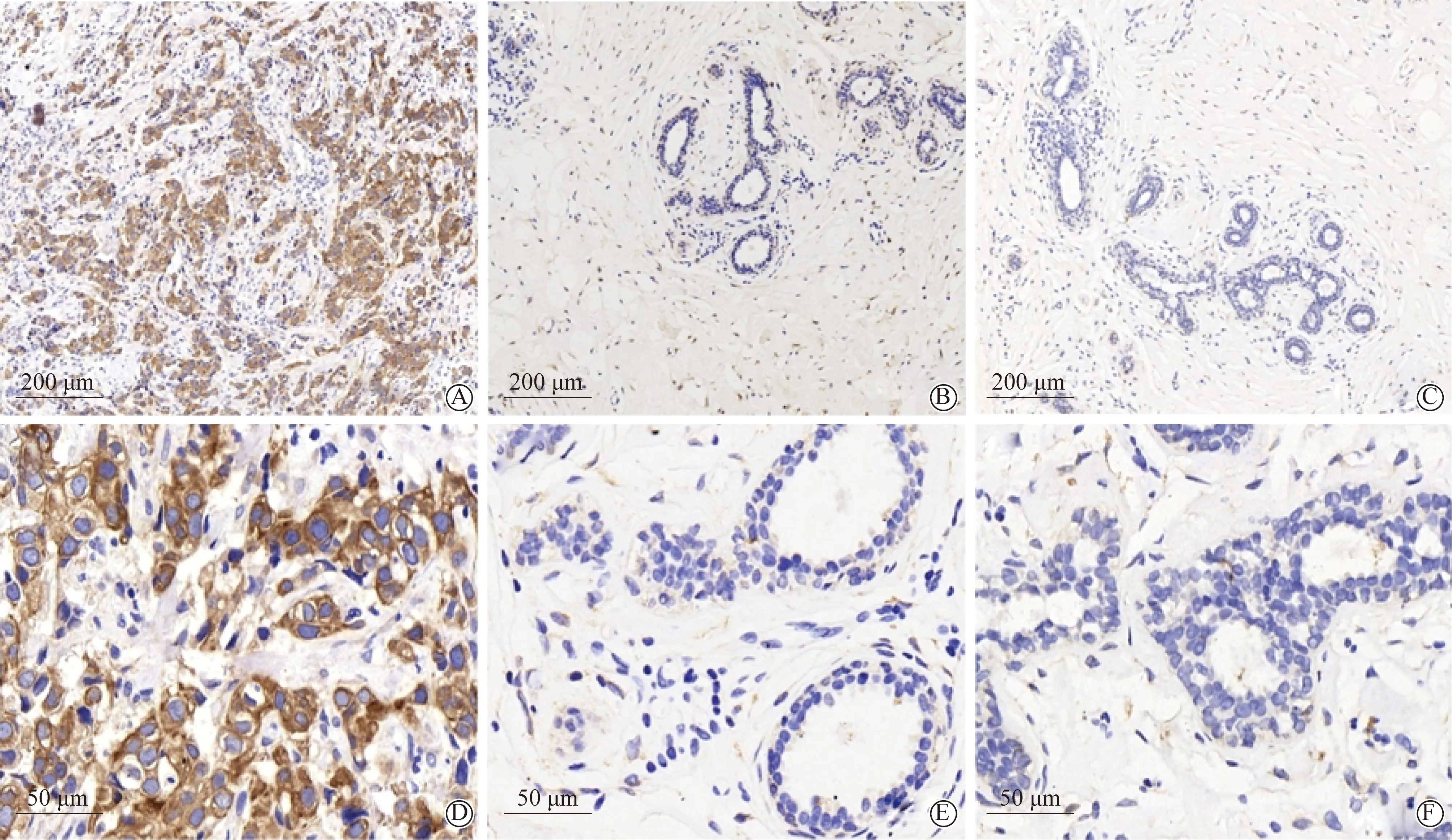
图2 PGRMC1在乳腺癌、乳腺良性疾病及正常乳腺组织的表达Fig.2 Expression of PGRMC1 in breast cancer, benign breast diseases and normal breast tissues
2.2 PGRMC1在乳腺癌中的表达与临床病理生物学特征的关系
肿瘤直径大、有淋巴结转移、组织学分级高的乳腺癌患者,PGRMC1阳性表达率升高,组间比较差异有统计学意义(P<0.001),而与患者的月经情况无关(P>0.05),详见表2。

表2 PGRMC1在乳腺癌中的阳性表达及与临床病理特征的关系Tab.2 PGRMC1 expression and the correlation between PGRMC1 expression and clinicopathological features n(%)
2.3 PGRMC1与相关受体、标志物表达间的相关性
配对χ2检验结果显示,乳腺癌组中的PGRMC1表达与ER、Ki-67、PR、Her-2的表达差异无统计学意义(P>0.05),Spearman相关分析结果显示,乳腺癌组中PGRMC1表达与ER的关系最为密切,其次是Ki-67,而与PR、Her-2表达的关系较弱,详见表3。

表3 PGRMC1在乳腺癌中的表达及与其他指标的关系Tab.3 Correlation between PGRMC1 expression and ER, PR, Ki-67 and Her-2 expression in breast cancer
乳腺良性疾病组中,PGRMC1表达与ER、PR的表达差异有统计学意义(P<0.05),而PGRMC1表达与Ki-67及Her-2表达的差异无统计学意义(P>0.05),Spearman相关分析结果显示,乳腺良性疾病组中PGRMC1表达与Ki-67(r=0.569)表达关系的密切程度大于Her-2(r=0.228)表达,详见表4。
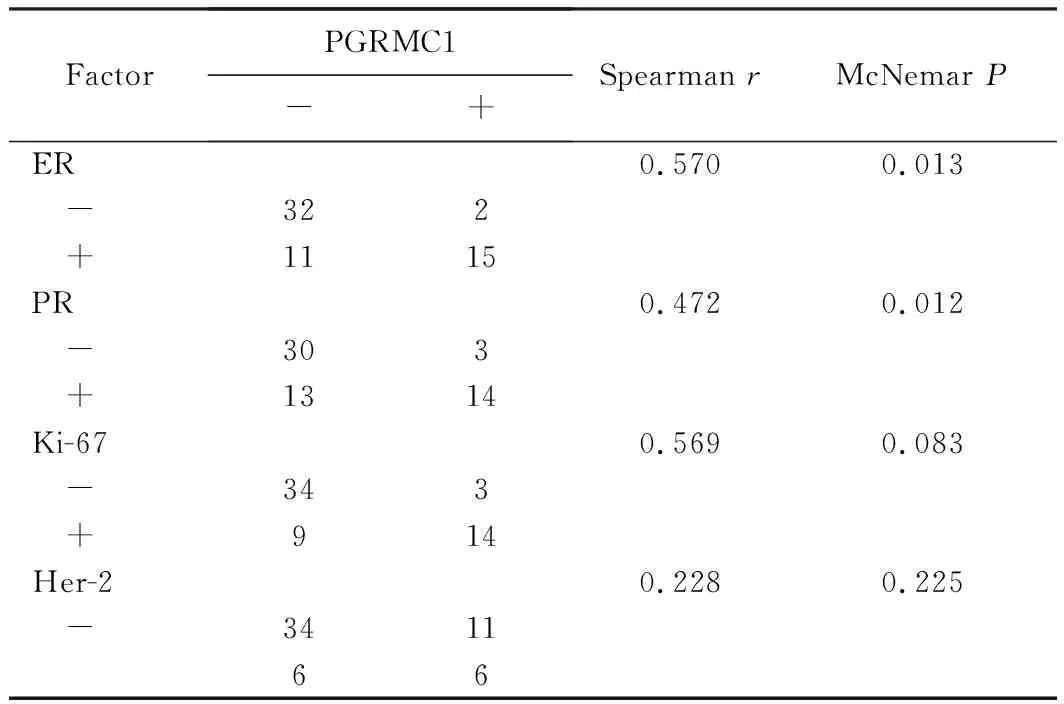
表4 PGRMC1在乳腺良性疾病中的表达及与其他指标的关系Tab.4 Correlation between PGRMC1 expression and ER, PR, Ki-67 and Her-2 expression in benign breast disease
3 讨论
规范的绝经激素治疗自20世纪始应用于临床,现已成为全面解决绝经相关健康问题首选的临床医疗措施。MHT是一种性激素补充治疗方案,针对女性因生殖功能衰老,性激素缺乏引起的身体异常症状,预防心脑血管疾病、骨质疏松、早老性痴呆、改善性生活质量,是目前其他任何单一药物不能替代的,但广大女性在考虑MHT的风险时仍然将乳腺病变列为重中之重。我国诊断为乳腺癌的年龄为45~55岁,其中62.9%的女性被诊断为乳腺癌时还未绝经[14-15]。因此临床需求的客观存在使得人们不可能放弃MHT。因此多年来研究者关注MHT的焦点实际上在于其治疗所带来的一系列风险,尤其是乳腺癌的风险在最近10余年更成为研究的热点。
随着肿瘤分子生物学的发展,临床上可通过肿瘤分子生物学因子在肿瘤细胞中的表达来评估肿瘤的生物学特征,从而进一步指导肿瘤的临床治疗。ER、PR、Her-2具有指导乳腺癌临床内分泌治疗和评估预后的作用[16]。PGRMC1是近年发现的新型膜激素受体,可能与激素相关肿瘤的恶性增殖及化疗敏感性密切相关,尤其是作为乳腺癌发生风险的新的生物学标志物具有良好前景[17-18]。明确PGRMC1与乳腺癌恶性增殖间的相关性,这是本研究力求解决的科学问题。本实验应用免疫组织化学法检测了乳腺癌组织、乳腺良性疾病组织及正常乳腺组织中PGRMC1的表达情况,发现PGRMC1在乳腺癌组织中阳性率为63.33%,在乳腺良性疾病中为28.33%,在正常乳腺组织中仅为6.67%,可见PGRMC1在乳腺癌组织中呈高表达,但表达水平不一,部分强阳性表达,部分仅可见淡黄色阳性颗粒,故进一步深入探讨了PGRMC1的表达与乳腺癌临床指标的相关性。结果显示PGRMC1的表达与乳腺癌淋巴结转移、肿瘤大小及组织学分级间高度相关,这提示PGRMC1可能可以作为指导乳腺癌治疗及预后的新指标。
本研究同时显示在乳腺癌组织中PGRMC1的表达与ER的关系最为密切,其次是Ki-67,而与PR、Her-2表达的关系较弱,这也进一步提示:孕激素与PGRMC1结合促乳腺癌细胞恶性增殖可能与参与调控ER信号通路有关。但具体机制不明,相关机制研究仍亟待解决。
在接下来的研究中,笔者将进一步筛选出ER+乳腺癌中PGRMC1调控蛋白如Akt、IkB、Bad、c-Jun、Caspase-3等,阐明PGRMC1与ER相关信号通路的相互作用机制。同时免疫组化检测Her-2的表达只是从蛋白水平上做一初步筛查,而联合荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测才是检测有无Her-2基因扩增的金标准[19],接下来的研究中笔者将采用FISH检测法检测乳腺癌组织中Her-2表达情况,分析PGRMC1与经典Her-2间表达的相关性。为将来建立一套关于PGRMC1对乳腺癌风险评估的预测系统,指导临床激素治疗的安全应用奠定基础。

