不同水提取方法对金钗石斛成分及抗氧化活性的影响
李梅梅,欧水平,刘欣旸,赵 云,宋宝宝,张 力,王 森,杨 明,3
(1.遵义医科大学 药学院,贵州 遵义 563099;2.遵义医科大学附属医院 药剂科,贵州 遵义 563099;3.江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004)
金钗石斛(DendrobiumnobileLindl.)为兰科石斛属植物,具有益胃生津、滋阴清热等功效。金钗石斛的主要化学成分包括多糖、生物碱、黄酮、倍半萜苷、氨基酸及酚酸类、联苄类、菲类等化合物,研究发现这些化合物具有抗肿瘤、降血糖以及保护神经系统等药理作用[1]。金钗石斛可作为天然抗氧化剂的候选药材,研究表明,金钗石斛总多酚[2]、总多糖[3]、总黄酮[4]、总生物碱[5]均有不同程度的自由基清除能力。但关于多成分分析与抗氧化活性之间的相关性未见报道,且不同的提取方法对于不同成分的溶出影响各异,各类成分与抗氧化活性之间关联程度亦不明确。本研究采用超声波法、浸渍法、水回流法、亚临界水萃取法、闪式提取法、酶解法提取金钗石斛,分析不同提取方法对成分差异性的影响,测定其抗氧化活性,通过相关性分析初步确定金钗石斛的主要发挥抗氧化活性的物质。
1 材料与方法
1.1 材料与试剂 金钗石斛饮片(产品批号:201202,广西神力制药有限公司);没食子酸(98%,成都埃法生物科技有限公司);石斛碱(98%,成都植标化纯生物技术有限公司);芦丁(98%,成都乐美天医药科技有限公司);D(+)-无水葡萄糖、赖氨酸(98%,上海源叶生物科技有限公司);纤维素酶(酶活力≥15 000 U/g,国药集团化学试剂有限公司);其余试剂均为国产分析纯。
1.2 仪器与设备 GENESYS 180紫外-可见分光光度计(赛默飞世尔科技公司);DL-820D超声仪(上海之信仪器有限公司);HH-S6水浴锅(郑州长城科工贸有限公司);BPG-9070A精密鼓风干燥箱(上海一恒科学仪器有限公司);800Y型多功能不锈钢粉碎机(永康市铂殴五金制品有限公司);水热反应釜(绍兴艾麦实验仪器有限公司)。
1.3 金钗石斛饮片预处理 将金钗石斛饮片放入烘箱中60℃干燥后粉碎,过50目筛,备用。
1.4 样品制备
1.4.1 超声波法 精密称取金钗石斛粉末2 g,加60 mL水,超声功率320 W提取20 min,提取3次,抽滤,合并滤液,浓缩,定容于100 mL量瓶[6]。
1.4.2 浸渍法 精密称取金钗石斛粉末2 g,加60 mL水,70℃浸提90 min,提取3次,抽滤,合并滤液,浓缩,定容于100 mL量瓶[7]。
1.4.3 水回流法 精密称取金钗石斛粉末2 g,加60 mL水,在80℃的条件下水浴回流提取2 h,提取3次,抽滤,合并滤液,浓缩,定容于100 mL量瓶[8]。
1.4.4 亚临界水萃取法 精密称取金钗石斛粉末2 g,加60 mL水,使用水热反应釜置烘箱130 ℃(水饱和蒸汽压0.27 Mpa)进行亚临界水萃取操作20 min,提取3次,反应完成后使用流水对反应釜降温,取出反应液,离心(4 000 r/min,10 min),抽滤,合并滤液,浓缩,定容于100 mL量瓶[9]。
1.4.5 闪式提取法 精密称取金钗石斛粉末2 g,加60 mL水,浸泡30 min后,使用高速剪切机10 000 r/min常温闪提3次,每次2 min,抽滤,合并滤液,浓缩,定容于100 mL量瓶[10]。
1.4.6 酶解法 精密称取金钗石斛粉末2 g,加60 mL水,调节pH至5.0,加入纤维素酶0.6 g,50 ℃水浴2 h,充分酶解后取出,置90 ℃水浴灭酶10 min,冷却后离心(4 000 r/min,10 min),抽滤,滤渣添加纤维素酶0.3 g同样条件再次酶解2次,合并滤液,浓缩,定容于100 mL量瓶[11]。
1.5 含量测定方法
1.5.1 总多酚 以没食子酸为对照品,采用福林酚比色法。样品溶液1 mL,加入0.4 mol/L福林酚试剂0.4 mL,涡旋1 min,静置3 min,再加入15%碳酸钠溶液0.3 mL,涡旋1 min,室温下静置60 min,定容至2 mL,测定波长750 nm处的吸光度A。[12]
1.5.2 总多糖 以无水葡萄糖为对照品,采用二硝基水杨酸法。单糖、总糖样品溶液各200 μL,加入0.5 mL DNS溶液,摇匀90 ℃水浴5 min,冷水浴10 min,定容至2 mL,测定波长540 nm处的吸光度A[13]。
1.5.3 总黄酮 以芦丁为对照品,采用三氯化铝比色法。样品溶液100 μL,加入1%三氯化铝溶液200 μL,用50%乙醇溶液补足1 mL,摇匀,室温下静置15 min,测定波长274 nm处的吸光度A[14]。
1.5.4 总氨基酸 以赖氨酸为对照品,采用茚三酮比色法。样品溶液100 μL,分别加入1 mol/L醋酸-醋酸钠缓冲溶液(pH=6.5)80 μL和2%茚三酮溶液120 μL,置沸水浴加热30 min,取出放冷5 min后,加水定容至2 mL,测定波长570 nm处的吸光度A[15]。
1.5.5 总生物碱 以石斛碱为对照品,采用酸性染料比色法。生物碱样品溶液(三氯甲烷萃取)1 mL,加入0.2 mol/L邻苯二甲酸氢钾缓冲液(pH=4.5)0.5 mL和0.04%溴甲酚绿溶液0.4 mL,涡旋3 min萃取,静置40 min待分层,测定波长415 nm处的吸光度A[16]。
1.6 体外抗氧化活性测定
1.6.1 DPPH自由基清除能力测定 将各提取液用蒸馏水稀释成不同浓度梯度。取EP管3支,P1中加入DPPH无水乙醇溶液(0.04 mg/mL)和样液各1.0 mL;P2中加入样液和无水乙醇各1.0 mL;P3中加入DPPH无水乙醇溶液和蒸馏水各1.0 mL;摇匀后置于暗处反应30 min,测定波长517 nm处的吸光度值[17]。
式中:Ap1为实验组的吸光度;Ap2为对照组的吸光度;Ap3为空白组的吸光度。
1.6.2 铁原子还原力测定 将各提取液用蒸馏水稀释成不同浓度梯度。分别吸取100 μL不同浓度稀释液于2 mL EP管中,并加入900 μL FRAP工作液,摇匀并避光反应15 min,在593 nm波长下测定吸光度值[18]。对FeSO4标准液绘制标准曲线,以达到同样吸光度值所需标准液浓度为FRAP值。
1.7 统计学分析 采用SPSS 18.0对不同水提取方法处理的金钗石斛提取液中的成分进行单因素方差分析,Duncan多重比较来分析各提取方法的差异性;并通过相关系数法对提取液中成分和抗氧化活性进行相关性分析。
2 结果与分析
2.1 各成分标准曲线方程 以对照品质量浓度为横坐标,吸光度值为纵坐标,列出各成分标准曲线方程,结果见表1。

表1 金钗石斛水提取液5种成分及FeSO4标准液线性与范围表
2.2 不同水提取方法中各成分变化对比
2.2.1 总多酚 通过方差分析和多重比较可知,不同水提取方法处理的金钗石斛总多酚含量差异有统计学意义(P<0.05),其中酶解法处理的总多酚成分含量最高(8.992±0.517)mg/g,闪式提取法处理的总多酚含量次高(7.703±0.277)mg/g,含量最低的为亚临界水萃取法(6.563±0.036)mg/g(见图1)。酶解法与其余5种方法处理的金钗石斛总多酚含量差异有统计学意义(P<0.05);闪式提取法与浸渍法处理的金钗石斛总多酚含量差异无统计学意义;超声波法、水回流法、亚临界水萃取法处理的金钗石斛总多酚含量差异无统计学意义。

*:与闪提、浸提、回流、亚临界、超声组相比,P<0.05;#:与酶解、回流、亚临界、超声组相比,P<0.05;**:与酶解、闪提、超声、亚临界组相比,P<0.05;##:与酶解、闪提、浸提组相比,P<0.05。
2.2.2 总黄酮 通过方差分析和多重比较可知,不同水提取方法处理的金钗石斛总黄酮含量差异有统计学意义(P<0.05),其中水回流法处理的总黄酮成分含量最高(11.723±0.055)mg/g,酶解法处理的总黄酮成分含量次高(11.081±0.279)mg/g,浸渍法处理的总黄酮成分含量最低(9.513±0.091)mg/g(见图2)。水回流法、酶解法、闪式提取法处理的总黄酮含量差异无统计学意义;超声波法、浸渍法处理的总黄酮含量差异无统计学意义;亚临界水萃取法与其余几种方法处理的总黄酮含量差异有统计学意义(P<0.05)。

*:与亚临界、超声、浸提组相比,P<0.05;#:与回流、酶解、闪提、浸提、超声组相比,P<0.05;**:与回流、酶解、闪提、亚临界组相比,P<0.05。
2.2.3 总氨基酸 通过方差分析和多重比较可知,不同水提取方法处理的金钗石斛总氨基酸含量差异有统计学意义(P<0.05),其中酶解法处理的总氨基酸成分含量最高(20.828±0.390)mg/g,超声波法处理的总氨基酸成分含量次高(12.547±0.062)mg/g,水回流法处理的总氨基酸成分含量最低(10.099±0.079)mg/g(见图3)。酶解法与其余五种方法处理的金钗石斛总氨基酸含量差异有统计学意义(P<0.05);浸渍法与亚临界水萃取法的金钗石斛总氨基酸含量差异无统计学意义。

*:与超声、浸提、亚临界、闪提、回流组相比,P<0.05;#:与酶解、浸提、亚临界、闪提、回流组,P<0.05;**:与酶解、超声、闪提、回流组,P<0.05;##:与酶解、超声、亚临界、浸提、回流组,P<0.05;***:与酶解、超声、浸提、亚临界、闪提组相比,P<0.05。
2.2.4 总生物碱 通过方差分析和多重比较可知,不同水提取方法处理的金钗石斛总生物碱含量差异有统计学意义(P<0.05),其中水回流法处理的总生物碱成分含量最高(5.017±0.099)mg/g,酶解法处理的总生物碱成分含量次高(4.728±0.032)mg/g,闪式提取法处理的总生物碱成分含量最低(4.258±0.042)mg/g(见图4)。水回流法与其余五种方法处理的金钗石斛总生物碱含量差异有统计学意义(P<0.05);超声法、浸渍法、亚临界水萃取法、闪式提取法处理的金钗石斛总生物碱含量差异无统计学意义。

*:与酶解、超声、浸提、亚临界、闪提组相比,P<0.05;#:与回流、超声、浸提、亚临界、闪提组相比,P<0.05;**:与回流、酶解组相比,P<0.05。
2.2.5 总多糖 通过方差分析和多重比较可知,不同水提取方法处理的金钗石斛总多糖含量差异有统计学意义(P<0.05),其中亚临界水萃取法处理的总多糖成分含量最高(54.747±0.203)mg/g,水回流法处理的总多糖成分含量次高(49.45±0.674)mg/g,超声法处理的总多糖成分含量最低(23.731±0.177)mg/g(见图5)。6种方法处理的金钗石斛总多糖含量差异均具有显著性(P<0.05)。

*:与回流、浸提、闪提、超声、酶解组相比,P<0.05;#:与亚临界、浸提、闪提、超声、酶解组相比,P<0.05;**:与亚临界、回流、闪提、超声、酶解组相比,P<0.05;##:与亚临界、回流、浸提、超声、酶解组相比,P<0.05;***:与亚临界、回流、浸提、闪提、超声组相比,P<0.05;###:与亚临界、回流、浸提、闪提、酶解组相比,P<0.05。
2.3 体外抗氧化活性分析
2.3.1 各水提取液对DPPH自由基的清除能力 由图6可以看出,不同水提取方法的金钗石斛提取液均有较强的DPPH自由基清除能力,在样品质量浓度0.1~10 mg/mL时,随着样品浓度的增大,DPPH自由基清除率也随之增大。其中水回流法提取的金钗石斛提取液DPPH自由基清除能力最强,在质量浓度为10 mg/mL时,清除率达到98.76%。不同水提取方法的金钗石斛提取液的清除能力大小排序为:水回流法>闪式提取法>酶解法>超声波法>浸渍法>亚临界水萃取法,其清除DPPH自由基的IC50值分别为(0.896±0.018)、(0.987±0.021)、(1.004±0.020)、(1.281±0.023)、(1.300±0.011)及(1.311±0.043)mg/mL。
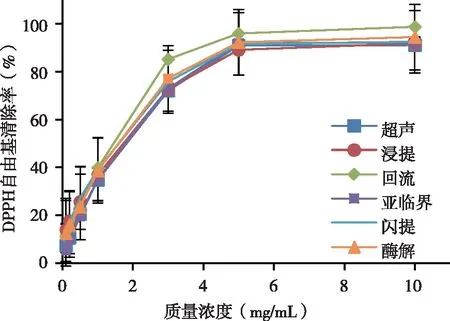
图6 不同水提取方法的金钗石斛提取液的DPPH自由基清除率
2.3.2 各水提取液的总还原力FRAP值 由图7可以看出,当不同水提取方法的金钗石斛提取液浓度为0.5~20 mg/mL时,FRAP值随着浓度的增加而增大,总还原力FRAP值与DPPH自由基清除率结果相似。在浓度20 mg/mL时,水回流法的金钗石斛提取液FRAP值最大,是浸渍法的1.43倍。不同水提取方法的金钗石斛提取液的总还原力FRAP值大小排序为:水回流法>闪式提取法>超声波法>酶解法>亚临界水萃取法>浸渍法。

图7 不同水提取方法的金钗石斛提取液的总还原力
2.4 抗氧化活性与各成分含量的相关性分析 由表2可以看出,不同水提取方法的金钗石斛提取液中的总多酚含量与DPPH自由基清除率、FRAP值呈弱度正相关;总黄酮含量与DPPH自由基清除率、FRAP值呈极显著中强度正相关(P<0.01),相关系数分别为0.819和0.704;总氨基酸含量与DPPH自由基清除率、FRAP值无相关性;总生物碱含量与DPPH自由基清除率、FRAP值呈中弱度正相关,其中与DPPH自由基清除率达到极显著性水平(P<0.01),与FRAP值达到显著性水平(P<0.05),相关系数分别为0.762和0.498;总多糖含量与DPPH自由基清除率、FRAP值呈弱度相关,其中与FRAP值呈负相关。上述分析说明,总黄酮、总生物碱是金钗石斛水提取液抗氧化活性的主要物质基础。

表2 金钗石斛成分含量与抗氧化活性相关性分析
3 讨论
大部分的酚类化合物以苷元、糖苷、甲基化残留物或者其他大分子的形式存在于细胞壁和细胞液泡等组织中[19],实验结果表明,借助纤维素酶降解细胞壁可促进多酚成分的溶出,提高提取效率。文献报道采用乙醇振荡提取金钗石斛总多酚提取量为0.862 mg/g[2],与本文中多酚含量相差较大,可能与金钗石斛的原产地(云南普洱)有关,本文原材料产自贵州赤水,说明贵州赤水金钗石斛多酚含量高于云南普洱。水回流法、闪式提取法及酶解法对总黄酮的提取效率差异不大,可参考其他成分的变化来对提取方法进行综合评价。目前黄酮成分大多采用有机溶剂提取,存在能耗大、环境污染等问题,蔡莉等[14]用乙醇超声提取不同采收期金钗石斛总黄酮含量范围为0.31%~0.68%,均低于本研究的6种提取方法,说明水可作为提取黄酮成分的备选溶剂,为今后金钗石斛总黄酮的绿色提取提供新思路。酶解法所提取的氨基酸含量是回流法的2倍,说明酶解法的条件温和,更适宜用于氨基酸的提取,不易破坏成分。文献报道赤水金钗石斛氨基酸总量范围为3.48~19.38 mg/g[20],与本文结果一致,但本研究仅采用茚三酮显色法测定总氨基酸含量,后续将进一步对氨基酸的具体种类进行分析,为金钗石斛营养价值评价提供参考。钱桂敏[21]、敖娇[11]分别采用闪式提取法、酶解法提取金钗石斛总生物碱,结果为0.45%、0.435%,与本文相差不大。生物碱的提取多采用传统的有机溶剂提取法,本研究采用水提取方法仍能达到较高提取效率,可为今后生物碱的提取提供新思路。邓维泽[22]、余芳[23]、曾宇馨等[24]采用超声提取法所得多糖含量分别为3.11%、6.945%、7.49%,均高于本研究中的超声提取法,对比工艺参数发现提取时间(均大于40 min)与提取温度(60 ℃以上)相差很大,结合亚临界水萃取法的总多糖提取量结果,推断提取温度是总多糖的提取效率的一个重要因素,将总多糖提取量与提取温度进行相关性分析,结果显示两者呈高度极显著正相关,相关系数为0.920,说明提取温度可能对于总多糖的提取有影响。本研究采用二硝基水杨酸法测定金钗石斛水提取液的单糖和总糖,通过总糖减去单糖得到总多糖的提取量。通过各提取液的单糖量对比发现,酶解法的单糖提取量最高(3.685±0.101)mg/g,是亚临界水萃取法(1.856±0.010)mg/g的1.99倍。酶解法主要通过纤维素酶将纤维素大分子分解成单糖和寡糖,所以单糖的溶出量会比其他方法高。
通过对不同水提取方法的金钗石斛提取液的成分对比分析可知,水回流法的总黄酮和总生物碱含量最高,酶解法的总多酚和总氨基酸含量最高,亚临界水萃取法的总多糖含量最高。水回流法主要通过持续不断的加热使金钗石斛茎的植物细胞壁软化破裂,使有效成分从细胞内再扩散到细胞外,再扩散到溶剂中,该方法设备简单,易操作;酶解法主要借助纤维素酶降解细胞壁,减少细胞壁对成分溶出的阻碍,并将纤维素大分子分解成单糖和寡糖,该方法反应条件温和,不易破坏成分;亚临界水萃取法通过借助特殊装置使水达到亚临界状态,氢键打开或减弱,降低水的极性,从而实现金钗石斛有效成分的快速溶出,此方法反应时间短,提取效率高。
通过对金钗石斛水提取液的各类成分与抗氧化活性相关性分析可知,金钗石斛总黄酮和总生物碱与DPPH自由基清除率、FRAP值呈极显著中强度正相关。文献报道铁皮石斛总多酚、总黄酮、总生物碱与抗氧化活性之间有明显的相关性,其中总黄酮为强相关,总多酚为弱相关[25];霍山石斛干花中粗多糖、总多酚、总黄酮、总氨基酸与DPPH自由基清除率呈显著正相关[26];齿瓣石斛总多酚、总黄酮与DPPH自由基清除率呈正相关,而总生物碱、总黄酮与之呈负相关[27]。不同种属石斛的成分与抗氧化活性相关性有所差异,金钗石斛总多酚与DPPH自由基清除率、FRAP值相关性不显著,原因可能是各种属石斛中总多酚组成不一样,同一个大类中的某一单体成分对于抗氧化活性影响大,这个有待进一步研究。
不同的水提取方法对金钗石斛各成分的影响各异,后续可根据不同需求选定提取方法进行优化达到某成分的最佳提取率,也可通过合适的两种或几种方法联用提取获得多成分高含量的金钗石斛提取物。目前可知金钗石斛总黄酮和总生物碱是重要的抗氧化活性物质,可作为天然抗氧化剂的候选物质,开发并应用于化妆品、食品和保健品中。本研究仅研究了各类成分含量与抗氧化活性的相关性,后续将进一步研究抑制酪氨酸酶活性、保湿性等其他活性与成分之间的关系,为金钗石斛多功能高活性相关产品的开发提供理论基础和数据支撑。

