息肉状脉络膜血管病变的新术语和非基于吲哚菁绿血管造影的诊断标准
——2021亚太眼科影像学会专家共识解读与思考△
文 峰 苏永悦
息肉状脉络膜血管病变(PCV)是亚洲人群的主要致盲性眼病,严重影响患者的视功能,导致不可逆的眼底损伤[1]。近十年来,在眼底影像技术高速发展的背景下,我们对PCV影像的研究不断深入,从传统的荧光素眼底血管造影到近年新型光学相干断层扫描(OCT)、OCT血管造影(OCTA),我们对PCV各部分组成成分的了解也更加透彻。PCV各成分的传统命名——“息肉” (polyps)、“分支血管网” (branching vascular network)——已无法完整地反映病灶的性质,亟待更新。同时,如何在无创的眼底影像检查中正确诊断PCV也成为当前临床工作者的期盼和挑战。
2021年,亚太眼科影像学会PCV工作组基于影像学和组织学报告的最新理解,更新共识命名,并提出不基于吲哚菁绿血管造影(ICGA)的新诊断标准,以区分PCV与典型的新生血管性年龄相关性黄斑变性(nAMD)[2]。本文将结合既往的研究,对该共识进行解读,旨在帮助临床工作者更快速地掌握PCV的影像学特点,推进PCV的早期诊断与防治。
1 PCV术语的更迭和制定共识术语的必要性
自PCV发现初期至今,国内外学者一直在探索PCV的本质和起源,随着研究的不断深入,其命名也不断变化。该疾病由Yannuzzi于1982年美国黄斑学会会议上首次描述[3]。1985年,Stern等[4]报道了3例黑人女性来源不明确的复发性多发性双侧的浆血性视网膜色素上皮脱离(PED)。随后,1990年,Kleiner等[5]报道了8例与视网膜下橘红色病灶相关的多发性复发性血性或浆液性PED合并玻璃体积血,命名为“后极部葡萄膜出血综合征”(posterior uveal bleeding syndrome)。同年,Yannuzzi等[6]报道了11例眼底呈特征性橘红色球状息肉样结构及脉络膜内层血管网的患者。Yannuzzi等[6]认为,这些病灶区别于nAMD,病灶的主要异常改变涉及脉络膜循环,因为发病机制尚不清楚,建议以“特发性息肉状脉络膜血管病变”(idiopathic polypoidal choroidal vasculopathy,IPCV)一词命名。
通过PCV发现史,可以看出PCV的临床表现纷繁复杂。这些橘红色的球状结构曾先后被命名为“脉络膜瘤”(choroidal excrescences)[6]、“橘红色视网膜下病变”(orange subretinal lesions)[5]、“后极部葡萄膜出血病变”(posterior uveal bleeding lesions)[5]。随着数字ICGA技术的进步,1995年,Spaide等[7]研究发现,PCV具有两部分独特解剖学结构:一是脉络膜内层的分支血管网;二是位于脉络膜内的血管网末端膨大的呈强荧光的息肉。人们对PCV的认识逐渐从罕见的仅发生于黑人女性的后极部葡萄膜出血综合征,发展为好发于有色人种的PCV。据估计,在白人人群中,PCV亚型在nAMD患者中的比例在10%到20%之间,但在亚洲人群中却高达50%[8-9]。国内自文峰2001年5月在大连第九届全国眼底病年会首次报道15眼国人PCV后[10],有关PCV的病例报道与研究也越来越多[11-14],国内的临床工作者也逐渐关注和重视这一在亚洲人群中具有高发病率的疾病。2004年后,Yannuzzi等建议将IPCV简称为PCV,并被广泛采用。目前,基于ICGA 的“息肉”和“分支血管网”是描述PCV结构最普遍采用的术语。
但随着眼底影像技术的飞速发展及病理组织学技术的进步,OCT、OCTA等影像技术的问世,“息肉”和“分支血管网” 的表述已难以与最新的临床进展完全吻合:(1)橘红色病灶并非是实质性的息肉病灶,而有可能是血管畸形扩张;(2)PCV并非完全位于玻璃膜下的脉络膜内层,也可位于玻璃膜上、视网膜色素上皮(RPE)下的空间,或部分突破RPE;(3)分支血管网并非完全是脉络膜内层血管的改变,有可能为脉络膜新生血管。综上,PCV各成分的传统术语显然不能完整准确地代表病灶的本质,也易导致初学者产生一些概念上的混乱。因此,使用更规范的术语势在必行,这有利于临床工作者更快速地理解和掌握病灶性质和其多模式影像学特征。
2 PCV多模式影像新进展
共识推荐的新术语是基于多模式影像的新发现、新结果设置的。近年来,PCV的影像学研究井喷式涌出,学者们结合多种影像模式以更全面、更深入地认识PCV病灶,探讨影像征象与PCV发病机制、诊断及治疗预后的关系。
2.1 OCT新征象OCT允许高分辨率的解剖可视化,这是之前基于染料的荧光素眼底血管造影所无法实现的,且具有无创成像的优势。PCV的各种OCT特征有助于将PCV与其他脉络膜新生血管相鉴别[15-17]:(1)双层征:由两个高反射层组成,代表被分支血管网分开的RPE及玻璃膜;(2)尖峰状PED或指突状隆起:RPE的峰状隆起,其内中等反射率,很可能是息肉状病灶本身;(3)PED切迹:PED边缘的息肉状病灶;(4)RPE下环状病变:PED下可见的圆形结构,可能呈低反射中心和高反射轮廓;(5)en face OCT复杂性RPE隆起:高反射分支血管网连接多个PED,与息肉状的病灶对应;(6)肥厚脉络膜:部分患眼可有增厚的脉络膜(通常>300 μm)。脉络膜毛细血管和Sattler层通常在病灶部位变薄,但Haller血管明显扩张。以上的OCT影像学发现支持PCV中的血管病变不都是位于脉络膜内部,而可位于RPE下间隙(玻璃膜之上),且息肉状的病灶并非实质性结构。因此,有学者认为PCV是1型脉络膜新生血管的变体,而不是最初认为的独立的临床疾病,但该观点仍存在争议[15]。
2.2 OCTA新征象OCTA提供了一种新的成像方式,无需染料注射即可实现多层次血流的分辨。虽然OCTA具有无创的优势且能够赋予OCT图像血流信号,提供更多信息;但较难做到精确分割PCV高度隆起、曲线型的PED病变,此外,多种型号OCTA血流算法存在差异,以及存在息肉状病灶内的湍流,这些因素使OCTA通常可以观察到分支血管网,但其对息肉状病灶的检出率较ICGA低[18-20],且OCTA上息肉状病灶及连接其的1型脉络膜新生血管的表现呈现多种多样,导致学者们对息肉状病灶的形态学特征存在分歧[19]。OCTA和ICGA之间结果的一致性仍需要大样本的进一步研究[18,20-22]。
在B扫描OCTA中可检测到的息肉状病灶呈圆形或环状的血流信号[23-24]。在en face OCTA可呈高血流或低血流信号或检测不到[25],其形态多变,如结节状、环状、簇状、点状、光环、玫瑰花结、血管网、肾小球样(新生血管缠结)等[26-29]。需要注意的是,这些OCTA上的形态可能并不代表息肉状病灶本身的形态,其形态对视力预后和治疗策略的影响也尚未阐明,未来成像工具分辨率的进一步提高可能会澄清息肉状病灶的性质。
2.3 ICGA新征象ICGA一直是诊断PCV的金标准。一些研究小组建议根据ICGA上的表现将PCV进一步分为不同的亚型,以探索不同亚型和视力预后的关系。(1)根据PCV累及部位的不同,可以分为黄斑区、视盘旁、血管弓区、中周部、结合型PCV,或分为中心凹下、中心凹旁、中心凹外、视盘旁、中周部PCV[11,30]。黄斑区PCV对视力预后影响最为严重。(2)根据PCV的活动性分为活动性和非活动性PCV[31]。活动性病灶常导致视网膜渗出、视网膜下出血和PED,最终导致视力丧失;而非活动性病灶,即静止性PCV,不伴有视网膜下或视网膜内液体或出血。在我们研究的具有非活动性息肉状病灶的40眼中,从注射吲哚菁绿到出现非活动性息肉状病灶的时间为8.2 ~25.1 min[32],长于EVEREST研究中标准的ICGA中6 min前出现的局灶性强荧光病变[33];同时,所有随访眼的非活动性息肉状病灶,随访(12.4±5.3)个月期间均没有进展,保持稳定或逐渐消退[32]。(3)根据ICGA显示的PCV形态,又有多种分类方法。根据PCV形态的分类复杂多样,如分为典型PCV与息肉状CNV,1型与2型PCV,A型、B型与C型PCV[34-35];单灶、簇状和葡萄串状息肉灶[30],搏动与非搏动的息肉灶[36]等。尽管研究表明这些分类与视功能预后之间存在一些关系(如典型PCV或A型PCV预后较好),但需要更多的研究来进一步验证这些分类对视力预后和治疗策略的影响。
ICGA影像也提供了对PCV发病机制的见解。相对于典型新生血管性AMD,PCV缺乏玻璃膜疣、色素改变、地图状萎缩和盘状瘢痕。脉络膜血管高通透性(CVH) 和较厚的脉络膜可能是PCV 发生的危险因素[37]。由于对肥厚脉络膜、1型新生血管和PCV之间的相互关系有了新的认识,部分学者认为PCV属于肥厚脉络膜疾病的范围[17,38]。但肥厚的脉络膜并不能完全地解释PCV的发病机制。现有研究也表明,并不是所有的PCV都具有CVH,无CVH的PCV相较有CVH的PCV黄斑中心凹下脉络膜厚度显著更薄、脉络膜血管指数显著更小[39-40]。PCV中脉络膜血管分布的显著差异提示不同脉络膜特征的PCV之间存在发病机制的差异。近期,我们研究报道了一种ICGA晚期年龄相关性弱荧光(ASHS-LIA)[41],ASHS-LIA可能代表玻璃膜中的脂质积累——基底线性沉积物 (BLinD)[42]。BLinD位于RPE基底层和玻璃膜内胶原层之间,是一种亚临床中性脂质沉积[43-44]。我们的研究表明,在PCV患者中ASHS-LIA发生比例较高(62.6%),推测其可能参与了PCV的发生发展;玻璃膜中的中性脂质积累(ASHS-LIA)阻碍了营养物质的运输,导致外层视网膜处于缺氧状态,为PCV的发生发展提供了病理条件[45]。
3 亚太共识推荐基于多模式影像的PCV术语
亚太眼科影像学会PCV工作组基于临床影像学观察结果和相关组织病理学研究的最新理解,就PCV的两个关键成分更新命名并达成共识。“息肉”和“分支血管网”的常用叫法与ICGA结果的观察相关。随着从OCT和组织病理学研究中获得的更多信息,专家组推荐使用术语“息肉状病灶”(polypoidal lesion)和“分支新生血管网”(branching neovascular network)来描述PCV中的两个病变成分(表1)。这一共识无疑规范和统一了目前PCV研究中混杂的用语,将会进一步提高眼科医生对PCV的理解。

表1 PCV病变的共识命名
共识建议避免使用“息肉”一词,是基于OCT和组织病理学的研究证据表明这些病变不是肉质或实性病变[46-48]。尽管部分专家提出了“动脉瘤病变”,基于动态ICGA可见息肉状病灶的搏动,提示部分病例可能起源于脉络膜动脉[36]。但共识专家组认为,扩张的血管或动脉瘤结构的RPE下低反射圆形结构并非在所有病例都可看到。“息肉状”和“动脉瘤”这两个术语都存在局限性,故共识专家组建议目前使用“息肉状病灶”来命名,直到更多的证据帮助理解息肉状病灶的内部结构。
共识建议使用 “分支新生血管网”,以更好地反映 PCV中血管网的新生血管性质。这是基于OCT和组织病理学的观察结果,即该血管网位于玻璃膜上方而不是脉络膜内[15-16]。专家组还认识到,PCV的分支新生血管网与脉络膜肥厚的1型新生血管(有时称为肥厚脉络膜新生血管病)之间可能存在重叠[38]。处于病因学的考虑,专家组决定应保留术语“肥厚脉络膜新生血管病”,并建议将“分支新生血管网”或“1型新生血管”用于PCV血管网的描述,而“肥厚脉络膜新生血管病”保留用于特定原因的描述。
4 亚太共识推荐非基于ICGA的PCV诊断标准
PCV与典型新生血管性AMD对抗血管内皮生长因子的治疗反应不同[49]。在临床上有必要将 PCV 与典型新生血管性AMD区分开来。ICGA不需要过敏预实验,其安全性比荧光素眼底血管造影更高,对脉络膜相关疾病的诊断与指导治疗仍具有不可替代的价值,目前PCV 的诊断金标准仍需要 ICGA,但其有侵入性且检测时间长的局限性,且有碘、贝壳类过敏或严重肝病的患者为ICGA禁忌证。OCT提供高分辨率图像,快速且无创。虽然其不具备血管成像的功能,但基于OCT 的PCV特征已逐渐为眼科医生所认知(见2.1 OCT新征象),加之目前我国对新生血管性AMD的医保报销也已可仅根据OCT结果进行诊断,OCT不失为一种诊断和监测PCV活动和指导治疗的有用手段。
亚太眼科影像学会PCV工作组提出了一套实用的、易于学习的非 ICGA 诊断标准,用于诊断AMD导致的黄斑新生血管眼中的 PCV。结合已报道的PCV的OCT和眼底彩照特征,专家组筛选出9个PCV体征,包含:(1)尖峰状PED;(2)RPE下环状病变;(3)复杂或多叶PED;(4)双层征;(5)伴有扩张Haller层血管的厚脉络膜;(6)积液;(7)en face OCT 示复杂RPE隆起;(8)广泛的视网膜下出血;(9)橘红色结节。各体征具体定义及眼底表现参照表2及图1。15 名眼底病学专家在包含有和没有 PCV患眼的测试集中对9个体征进行判断,计算每个体征的受试者工作特征曲线下面积(AUC)。3个特征——RPE下环状病变、尖峰状PED和en face OCT示复杂RPE隆起——被选为主要标准(满足AUC 0.75);4 个特征——橘红色结节、伴有扩张Haller层的厚脉络膜、复杂或多叶PED 和双层征——被选为次要标准(满足AUC为0.60~0.75)。应用所有3个主要标准,AUC可达到0.90,敏感性为 0.75,特异性为 0.91,阳性预测值为 0.93,阴性预测值为0.68(表3)。
这套诊断标准可以快速、实用且无创地区分PCV与典型的新生血管性AMD,尤其是在无法使用 ICGA 时,可以满足大多数临床诊断与指导治疗的需求。既往基于各种OCT特征组合来诊断PCV的研究主要与PED 特征有关[50-52]。PCV工作组提出的这套诊断标准,除基于以前共识的基础,还包括了其他层面检测(en face OCT、眼底彩照)的特征。值得注意的是,虽然这套诊断方法的阳性预测值为0.93,但阴性预测值为0.68。因此,在患眼缺乏这些特征时,不能草率地排除PCV的诊断,仍需要结合ICGA或其他多模式影像来进一步明确诊断。

表2 PCV的9个非ICGA特征
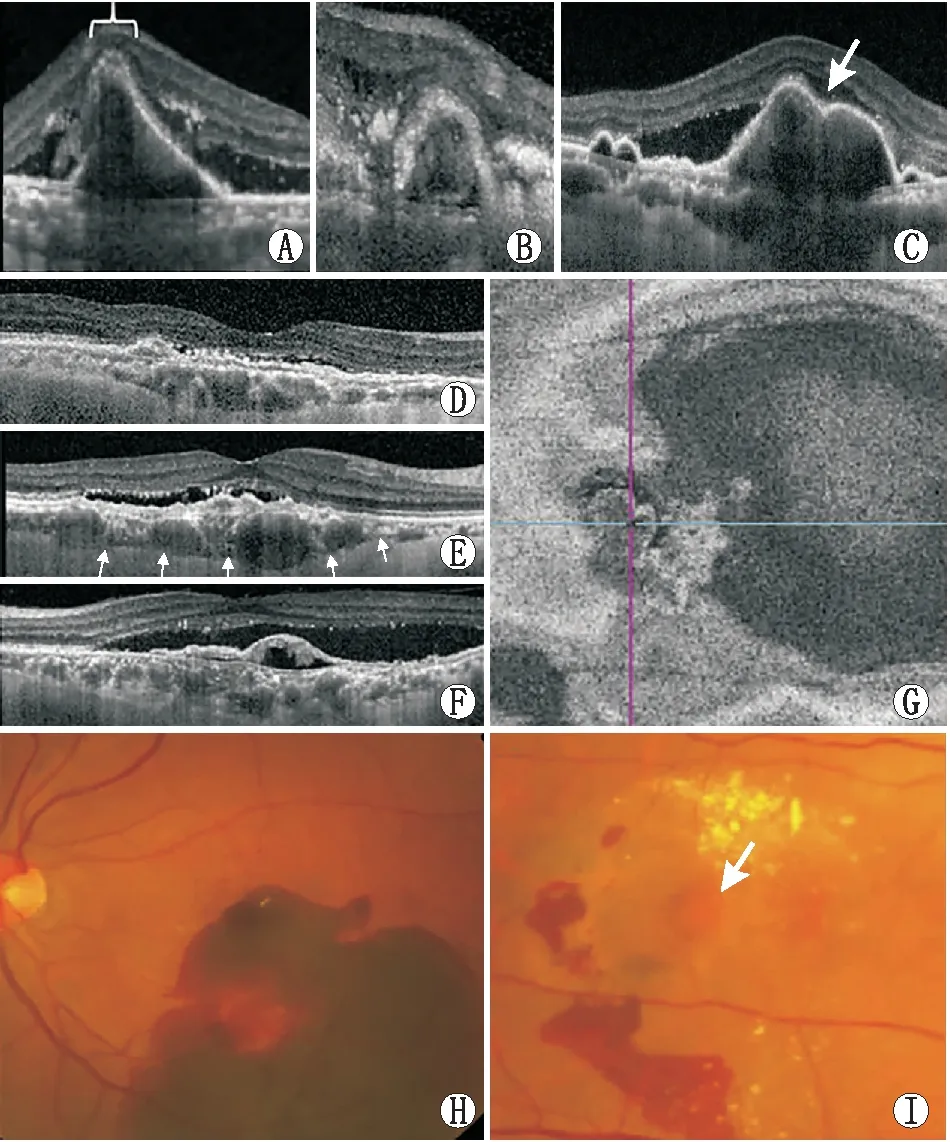
图1 PCV的9个非ICGA特征参考图 A-F:基于横断面OCT的6个特征;G:基于en face OCT的1个特征;H-I:基于眼底检查或眼底彩照的2个特征。A:尖峰状PED;B:PED下的环状病变;C:复杂或多叶PED(白色箭头示PED切迹);D:双层征;E:厚脉络膜伴扩张的Haller层血管(箭头所示为巩膜-脉络膜界面);F:明显的视网膜下液;G:en face OCT示复杂RPE隆起;H:广泛的视网膜下出血;I:橘红色结节(白色箭头)。
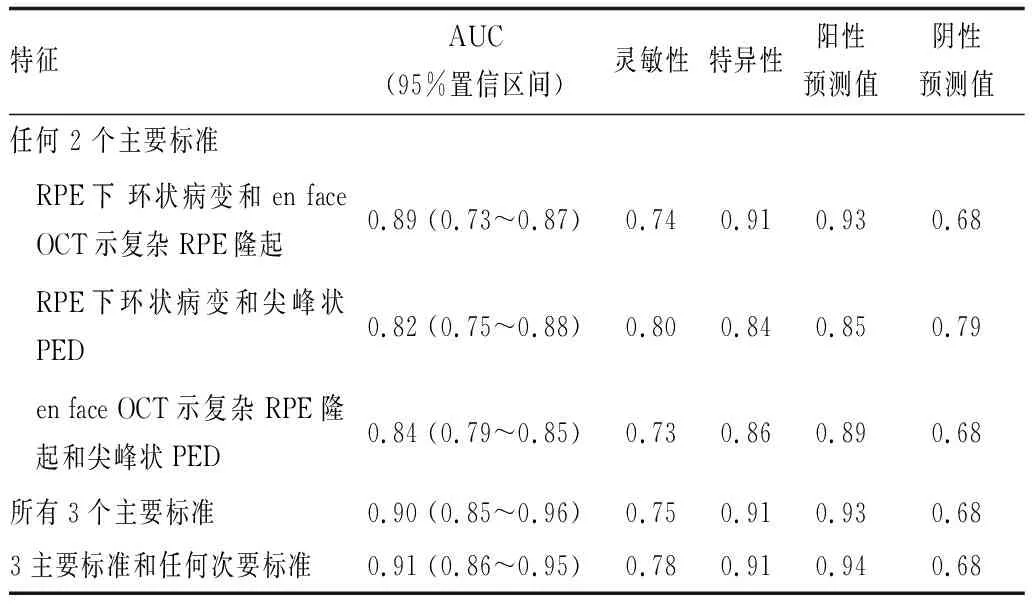
表3 特征组合的AUC、灵敏性、特异性、阳性预测值和阴性预测值
5 问题与展望
影像技术的蓬勃发展使我们对PCV的认识更为深入,现有的研究发现 已颠覆了最早对PCV的理解。亚太共识提出的“息肉状病灶”和“分支新生血管网”阶段性地规范和统一了临床术语,但息肉状病灶的本质和其发生的病理机制仍是未解之谜。目前多数学者认为PCV是1型脉络膜新生血管的变体,但为什么有些1型脉络膜新生血管会形成息肉状病灶而有些不会?这仍然是值得进一步探索的课题。
眼底检查技术的发展逐渐趋于无创和自动化。OCT、OCTA等无创检查手段因其方便、快捷,为众多临床工作者所喜爱,但目前来说, ICGA 仍然是确认 PCV 的最佳验证方法。同样,虽然传统的眼底血管造影有其诊断的价值优势,但仍具有耗时、有创及不良反应的局限性,不便作为频繁随访的检测工具。因此,我们不能完全依赖单一模式的眼底影像进行PCV诊断与随访,多模式影像的有效结合与互相印证才是临床诊断和指导治疗的最佳手段。
亚太眼科影像学会PCV工作组推荐的这套由多种无创影像相结合的诊断标准,值得我们学习与借鉴。我国PCV患者人群庞大,仍需利用该优势进行创新研究,以在国际PCV舞台发出更多中国PCV诊治新观点。眼底影像技术推陈出新、日新月异,高清OCTA、超广角眼底影像等新兴技术层出不穷,需要眼科同道不懈努力,使新技术不只是形式的新潮,而是需要提出新的临床诊治理念,给患者带来更多福音。

