HMGB1-RAGE通路调节Treg分化在结肠癌进程中的机制分析
黄建辉,蒋 晨,王兴超,钱 飞
结肠癌是消化系统常见的恶性肿瘤之一,其发病率和病死率分别位居全球恶性肿瘤的第3位和第4位[1]。结肠癌的发病机制是一个复杂的过程,涉及环境影响、基因改变、宿主免疫等。文献报道炎症反应和免疫紊乱在结直肠癌发生、发展中发挥重要作用[2-5]。高迁移率族蛋白-1(HMGB1)是DAMP家族的一员,细胞外HMGB1以两种不同的方式发挥作用:通过炎症细胞主动分泌,或通过坏死或应激细胞作为炎症介质被动释放。放疗和化疗会导致细胞死亡并促进HMGB1的被动释放[6-8]。晚期糖基化终末产物受体(RAGE)可作为晚期糖基化终末产物(AGE)的受体激活糖尿病诱发慢性炎症[9]。研究发现,RAGE可导致包括HMGB1和S-100β在内的多种分子的活化,在慢性炎症的维持和炎症介导的慢性疾病发展过程中扮演着至关重要的角色。RAGE对结肠癌进程中的炎症微环境是否发挥免疫调节作用,尚无定论。鉴于此,本实验通过人体标本和细胞实验,探究HMGB1-RAGE通路与调节性T细胞(Treg)分化的关系,初步探讨HMGB1-RAGE通路在结肠癌进程中可能的免疫调节作用。
1 材料与方法
1.1 临床资料收集2016年1月~2020年10月南通大学附属医院存档的66对结肠癌手术标本及其癌旁组织,其中男性33例,女性33例;年龄45~80岁,中位年龄60.5岁;按组织类型分为高分化腺癌16例,中分化腺癌26例,低分化腺癌24例;按国际结肠癌TNM分期标准分为Ⅰ期12例,Ⅱ期22例,Ⅲ期32例。临床资料包括:患者性别、年龄、肿瘤大小、分化程度、肿瘤生长方式等。所有入组患者无远处转移、术前无放疗和化疗史、无其它恶性肿瘤病史。
1.2 实验试剂免疫组化SP试剂盒、辣根过氧化物酶(HRP)标记的山羊抗兔、鼠通用型二抗试剂盒购自DAKO Denmark生物科技公司,兔抗人RAGE多克隆抗体、鼠抗人FOXP3多克隆抗体购自Abcam公司。8周龄的SPF级Balb/C小鼠(雌、雄各半)来源于南通大学实验动物中心。Mag Cellect Rat CD4+CD25+Treg分离试剂盒购自R&D公司。Anti-CD4(APC)、Anti-CD25(PE)和小鼠调节性T细胞流式检测试剂盒均购自eBioscience公司。Anti-CD3和Anti-CD28购自BD公司。胎牛血清(FBS)购自Hyclone公司。RPMI-1640培养基购自Solarbio公司。重组人细胞因子TGF-β购自Peprotech公司。
1.3 方法
1.3.1免疫组化 标本均经10%中性福尔马林固定,脱水、包埋、切片、脱蜡至水后用EDTA抗原修复液进行高压修复,随后用0.3%H2O2作用10 min以阻断内源性过氧化物酶,再用10%胎牛血清封闭20 min,滴加一抗(稀释比1 ∶200)并置于4 ℃冰箱过夜。第2天将切片用PBS清洗3遍后滴加二抗孵育30 min,PBS清洗3遍后滴加SP复合物反应15 min。DAB显色后,用苏木精复染细胞核,最后脱水,透明,封固。镜下观察并采集图像进行分析。
结果判读:免疫组化结果由两位高年资病理医师采用双盲法进行阅片,随机选取5个高倍视野,计算阳性细胞数,判定标准按照许良中等[10]的方法进行。(1)按阳性细胞百分比计分:无阳性细胞为0分;1%~33%为1分;34%~67%为2分;68%~100%为3分。(2)按阳性细胞着色强度计分:浅黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘作为最终评分:<2分为低表达,≥2分为高表达。
1.3.2免疫荧光 使用Pannoramic MIDI组织芯片扫描仪,通过HALO分析软件,应用Indica Labs-HighPlex FL模块自动识别,并设置组织切片上选定区域的绿光、红光和共表达细胞。
1.3.3初始T细胞体外诱导iTreg 用无菌小鼠抗CD3、CD28单克隆抗体包被96孔板(用无菌PBS稀释抗CD3和CD28抗体至终浓度CD3为10 μg/mL、CD28为4 μg/mL),封口膜包裹96孔板4 ℃过夜,取出至37 ℃细胞培养箱待用,分选的初始T细胞加入RPMI-1640完全培养基重悬至每毫升1×106个,加入IL-2(300 IU/mL)和不同浓度的重组人TGF-β1(10、20、30 ng/mL),将包被的96孔板取出后PBS冲洗3遍,每孔加200 μL细胞悬液(约2×105个细胞),置于37 ℃ 5%CO2的细胞培养箱培养60~108 h,用流式细胞术检测细胞的iTreg比率。
1.3.4不同干预方式诱导iTreg效率比较 将分选初始T细胞分为2组,观察组以TGF-β1联合HMGB1共同刺激,对照组仅以TGF-β1刺激。利用流式细胞术分析CD4+CD25+FOXP3+Treg细胞的比例在HMGB1刺激后的改变,明确HMGB1对初始T细胞分化为iTreg细胞的影响。

2 结果
2.1 结肠癌组织中RAGE、FOXP3蛋白表达及其与临床病理特征的关系RAGE表达主要定位于癌细胞胞质,呈棕黄色颗粒,FOXP3在癌细胞胞质、胞膜、胞核均有分布,主要定位于细胞质,呈棕黄色颗粒;在癌旁正常组织中,RAGE和FOXP3均仅表现为细胞质中零星分散的棕黄色颗粒(图1、2)。RAGE和FOXP3在低分化、浸润层次深、有淋巴结转移、TNM分期晚的结肠癌组织中表达均明显增高,差异有统计学意义(表1)。
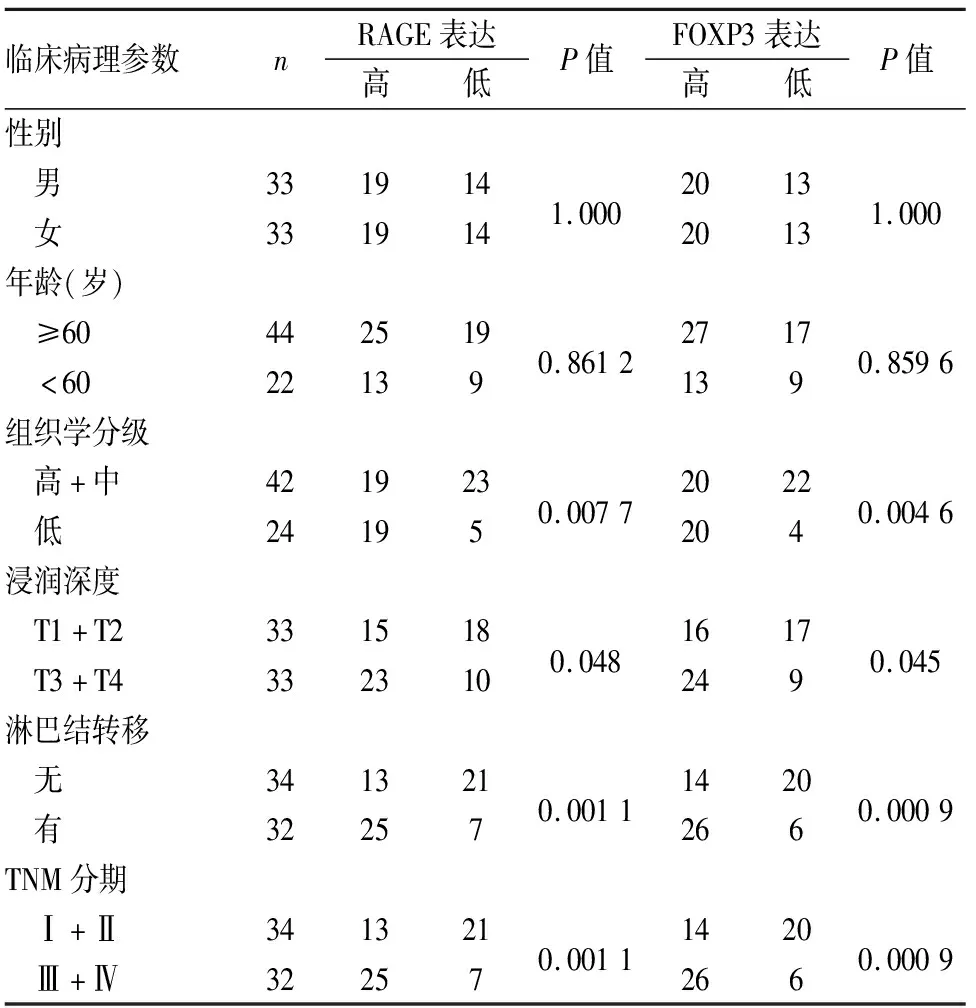
表1 RAGE、FOXP3蛋白表达与结肠癌临床病理特征的关系
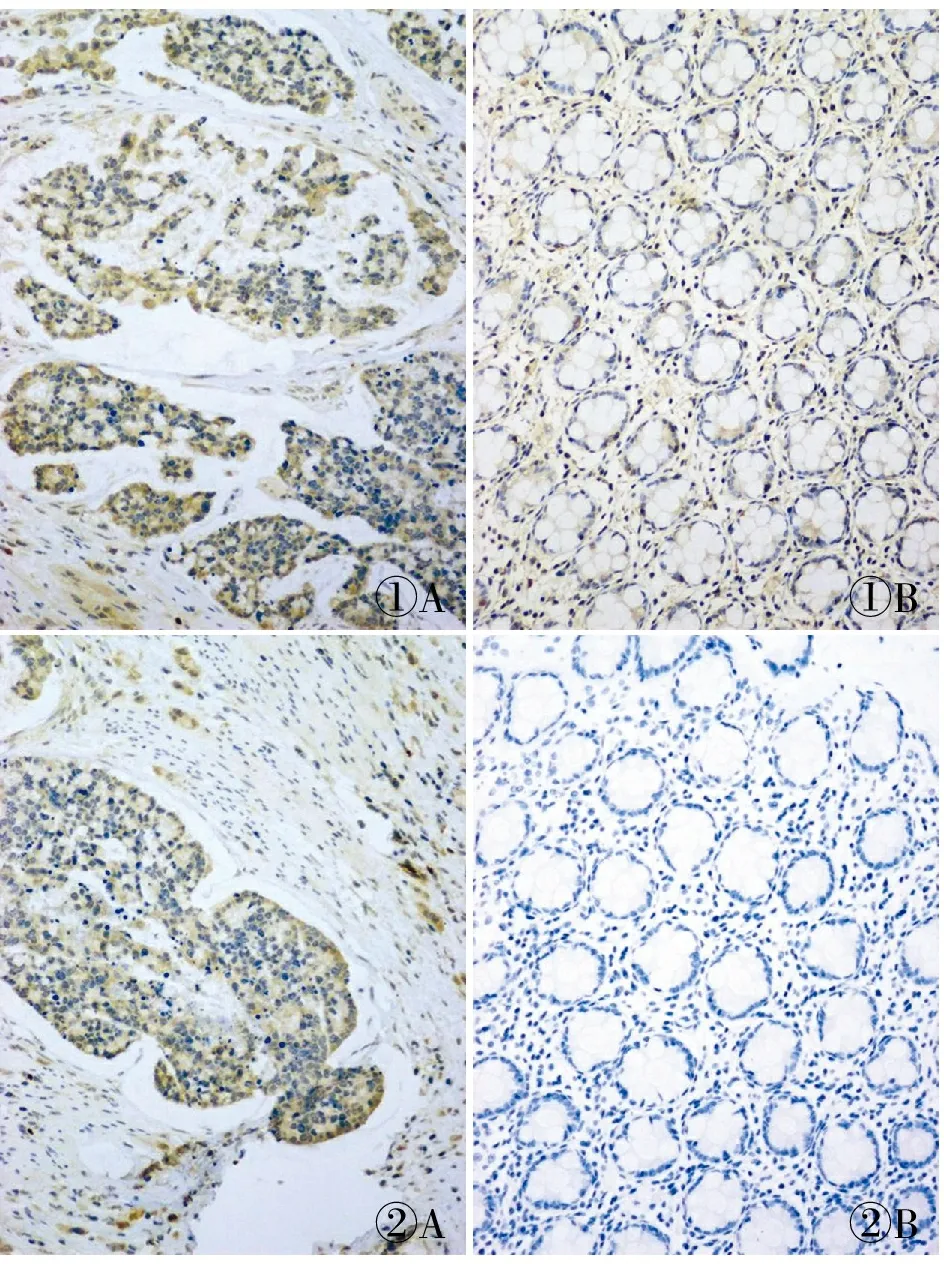
图1 A.结肠癌组织中RAGE阳性;B.癌旁正常组织中RAGE弱阳性,SP法 图2 A.结肠癌组织中FOXP3阳性;B.癌旁正常组织中FOXP3阴性,SP法
2.2 RAGE和FOXP3的免疫荧光检测免疫荧光检测结果显示,RAGE(红色荧光)和FOXP3(绿色荧光)在结肠癌组织中均呈高表达,分别约占75%和60%,并且两者有明显的共定位,提示两者可能存在相互作用(图3)。

图3 免疫荧光法分析结肠癌组织中RAGE和FOXP3的表达和定位
2.3 不同浓度TGF-β1和不同时间刺激下iTreg的转化率利用不同浓度的TGF-β1诱导生成iTreg,结果发现30 ng/mL TGF-β1诱导的iTreg转化率最高,达79.1%;在不同时间下利用TGF-β1刺激诱导iTreg,结果发现刺激96 h的iTreg转化率最高,为81.2%(图4)。
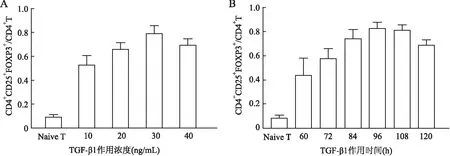
图4 不同浓度TGF-β1和不同时间刺激下iTreg的转化率:A.不同浓度TGF-β1诱导iTreg的转化率;B.TGF-β1刺激不同时间诱导iTreg的转化率
2.4 HMGB1对TGF-β1诱导的iTreg分化的影响利用TGF-β1刺激初始T细胞体外诱导96 h进行实验,结果发现观察组iTreg的转化率明显高于对照组的iTreg转化率(5.22%vs1.00%,P<0.05),两者差异有显著性(图5)。联合HMGB1共同刺激后,TGF-β1体外诱导的iTreg转化率增加(TGF-β1+HMGB1 9.16%vsTGF-β1 5.22%),说明RAGE的配体HMGB1可以通过增强TGF-β1诱导iTreg的分化。
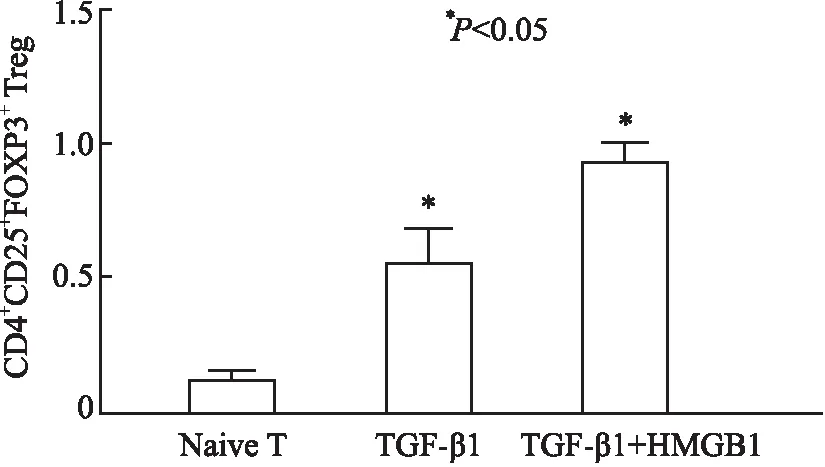
图5 观察组和对照组iTreg的转化率
3 讨论
RAGE蛋白是重要的炎症因子,FOXP3蛋白表达赋予了T细胞免疫抑制活性,是CD4+CD25+Treg细胞重要的分子标志物,也控制着CD4+CD25+Treg的发育和功能[11-13],在肿瘤进程中发挥免疫抑制作用。
本实验免疫组化结果显示,RAGE和FOXP3蛋白在低分化、有淋巴结转移、TNM分期晚的结肠癌组织中的高表达率更高,说明两者均与结肠癌的进展密切相关。实验进一步对组织标本进行免疫荧光双标检测,发现RAGE和FOXP3蛋白在结肠癌组织中存在着明显的共定位,说明两者可能存在一定的相互作用。
本组前期实验已发现:HMGB1-RAGE信号通路可以通过Ras依赖的方式激活下游Yap1转录因子,从而导致结直肠癌的进程[14]。因此,作者推测HMGB1-RAGE信号通路可能通过FOXP3蛋白发挥促免疫耐受作用,进而促进结肠癌的进展。
为了验证实验推测,课题组收集小鼠血液并利用免疫磁珠分离其中初始T细胞,以RAGE的配体重组HMGB1蛋白联合TGF-β1刺激初始T细胞,利用流式细胞术分析CD4+CD25+FOXP3+Treg细胞的比例在HMGB1刺激后的改变,发现HMGB1可以明显增强TGF-β1诱导的Treg分化。FOXP3在肿瘤中的意义已得到初步证实[15]。体外实验证实HMGB1蛋白可以促进CD4+CD25+FOXP3+Treg细胞的增加,而CD4+CD25+FOXP3+Treg细胞的增加会导致促免疫耐受作用。本组体外实验结果初步证实了HMGB1-RAGE通路参与Treg分化的过程,潜在发挥促免疫耐受作用。
TGF-β1通路主要是在诱导初始T细胞(naive T cells)表达Treg关键分子叉头状/翼状螺旋转录因子FOXP3的过程中发挥重要作用[16]。研究发现,RAGE作为炎症相关信号通路,可与TGF-β相互作用促进STAT5转录因子的活化,进而调控细胞的周期和增殖[17]。TGF-β1通路在HMGB1-RAGE通路和Treg分化之间可能发挥介导作用。Treg受TGF-β1和IL-2等免疫调节信号通路控制,通过提高肿瘤细胞的免疫耐受而促进肿瘤进程[18-20]。HMGB1在一些实体肿瘤中表达均升高,包括鼻咽癌、肝癌、胃癌和结直肠癌[21-24],与本组实验结果一致,这些肿瘤的形成需要炎症的触发,Treg通过与肿瘤细胞直接作用,或通过树突状细胞介导的肿瘤抗原递呈和招募,Treg以诱导耐受和击退抗肿瘤免疫反应,在肿瘤诱导耐受中发挥重要作用[25]。另有研究发现,细胞外的HMGB1可以通过与RAGE特异性膜受体结合,激活MAPK、NF-κB等关键信号通路,诱导癌细胞的生长、迁移、侵袭和转移[26-27]。
本实验通过对人体标本和体外细胞两个层面进行研究,初步揭示了HMGB1-RAGE通路参与Treg分化的调控,潜在发挥促免疫耐受作用,进而导致结肠癌的进展。本实验成果可能为新型抗结肠癌药物的研发提供新靶点,然而本实验样本量较少,仍存在一些局限性,后续实验将增加样本量进行深入探究。

