小鼠乳腺癌干细胞免疫相关分子表达和免疫浸润的分析
李昱阳,李钊璇,罗云萍,陈 翀
(中国医学科学院基础医学研究所 北京协和医学院基础学院 免疫学系, 北京 100005)
肿瘤干细胞(cancer stem cells,CSCs)也称为肿瘤起始细胞(tumor-initiating cells,TICs),是一小群具有自我更新能力和分化潜能的肿瘤细胞亚群[1],并且已在多种类型的恶性肿瘤中鉴定并分离出来[2-6]。肿瘤干细胞是肿瘤起始、复发和转移的根本原因[7],也是目前肿瘤基础与临床研究的热点问题。
基因突变产生的抗原可以递呈到肿瘤细胞表面,从而被机体的免疫细胞所识别和清除。然而,肿瘤细胞可以通过下调抗原加工与递呈的分子通路来躲避机体免疫细胞的攻击,并最终形成恶性肿瘤[8-10]。另外,许多研究已经证实,肿瘤细胞可以上调具有免疫抑制作用的检查点分子来抵抗免疫细胞的杀伤[11]。在临床中,靶向免疫检查点的治疗让许多晚期的肿瘤患者从中获益,革命性地改变了肿瘤免疫治疗现状[12]。然而,关于肿瘤干细胞免疫原性和免疫逃逸的研究鲜有报道,肿瘤干细胞在抵抗免疫治疗中的作用也不清楚。
为了探讨肿瘤干细胞与机体免疫防御系统的相互关系,本研究较为全面地分析了小鼠乳腺癌干细胞(breast cancer stem cells, BCSCs)中免疫检查点与抗原递呈相关分子的表达情况,然后利用小鼠移植瘤模型在体内研究乳腺癌干细胞成瘤后的免疫浸润特点,从而初步探讨了小鼠乳腺癌干细胞免疫原性和免疫逃逸相关的表型特征。
1 材料与方法
1.1 材料
1.1.1 细胞:小鼠乳腺癌细胞系 4T1 和 4T07 (ATCC)。
1.1.2 动物:SPF 级 6~8 周龄,Balb/c 雌鼠(中国医学科学院基础医学研究所实验动物中心)。
1.1.3 试剂:RPMI 1640(Biological Industries 公司);低吸附10 cm培养皿(Corning公司);胎牛血清、100×青霉素链霉素(Gibco公司);成球培养基(Stem Cell公司);RT-qPCR试剂盒和 qPCR试剂盒(南京诺唯赞公司);流式抗体:CD45-Percp、CD3-FITC、CD4-APC、CD8-APC、CD11b-APC、CD11c-APC和MHC2-FITC(Biolegend公司)。
1.2 方法
1.2.1 细胞的成球培养:将处于对数增殖期的肿瘤细胞消化成单个细胞,用无血清的成球培养基重悬,对其进行细胞计数,并将细胞浓度调整为 1×103个/mL,在 37 ℃,5% CO2的孵箱中培养 7 d后用 70 μm的细胞筛收集肿瘤细胞球。
1.2.2 RT-qPCR检测免疫相关基因的mRNA:将所得到的贴壁细胞和细胞球分别用Trizol试剂收集,室温裂解后加入三氯甲烷迅速混匀,在 4 ℃、12 000 r/min离心 15 min,收集上清液并加入等体积的异丙醇颠倒混匀,室温静置 10 min,在 4 ℃、12 000 r/min离心10 min后弃上清,用75%乙醇溶液洗涤两次弃掉上清,室温晾干沉淀,加入无RNase的无菌水溶解沉淀。按说明书操作将1 μg的 RNA反转录得到cDNA。以GAPDH为内参,利用SYRB Green法按说明书进行real-time PCR检测,并且分析基因在RNA水平的相对表达量。
1.2.3 蛋白质免疫印迹检测干性相关蛋白:提取总蛋白质测定浓度后进行 SDS-PAGE,每孔蛋白上样量为 35 μg,恒流电泳 2 h。用湿转法转膜至 PVDF 膜,封闭后分别孵育一抗 SOX2、OCT4和β-actin过夜,次日洗膜3次后孵育二抗1 h,再次洗膜后滴加显影液,拍摄条带并用ImagJ软件进行吸光度扫描分析。
1.2.4 4T1 乳腺癌移植瘤模型的建立:将 8周龄的Balb/c雌鼠随机分成两组,每组6只。将成球培养 7 d后且直径大于 70 μm的细胞球以及处于对数增殖期的4T1贴壁细胞消化成单个细胞,分别用PBS重悬成 5×105个/mL,并接种 100 μL于小鼠右侧的第四乳腺脂肪垫中。
1.2.5 流式细胞测量术检测各种免疫细胞的比例:将细胞消化成单个细胞,重悬后计数,将细胞调整为 1×106个/mL,离心后用 FACS 流式染液重悬,加入抗体(抗体∶细胞悬液 = 1∶100),4 ℃避光孵育25 min后,用PBS洗涤1次后,进行流式细胞术检测。所得数据使用 BD 公司的FlowJo X 软件进行分析。
1.3 统计学分析
2 结果
2.1 乳腺肿瘤干细胞的富集和鉴定
小鼠乳腺癌细胞系 4T1 和4TO7 所形成的肿瘤细胞球的直径基本都大于 70 μm,且数量较多(图1A)。进一步,与贴壁的肿瘤细胞相比,肿瘤细胞球中干性基因 SOX2、OCT4和NANOG的 mRNA水平明显上调(图1B),并且干性基因(SOX2 和 OCT4)的蛋白水平也明显上调(图 1C)。
2.2 乳腺肿瘤干细胞免疫检查点与抗原递呈相关分子的表达
PD-L1 和 CD276 在 4T1 的肿瘤干细胞中明显下调,而 Gal-9 的表达明显上调(图2A);在 4T07 的肿瘤干细胞中,PD-L1 和 CD47 的表达明显上调,而 CD276 和 Gal-9 的表达明显下调(图2B)。抗原递呈相关分子 B2m 在 4T1 和 4TO7 的肿瘤干细胞中都显著上调,Nlrc5 的表达都明显降低,而 Mr1、Tap2 和Tapbpl在这两类乳腺癌干细胞中的表达趋势相反(图3)。
2.3 乳腺癌荷瘤小鼠的脾脏和肿瘤组织中各类免疫细胞的比例
图4A 和图5A 示圈门策略。在两组荷瘤小鼠的脾脏中,CD4+T 细胞、CD8+T 细胞和 CD11c+MHCⅡ+DC 细胞所占的比例无明显差异(图4B~C,E),然而 CD11b+细胞的比例在接种肿瘤干细胞的小鼠中明显减少(图4D)。
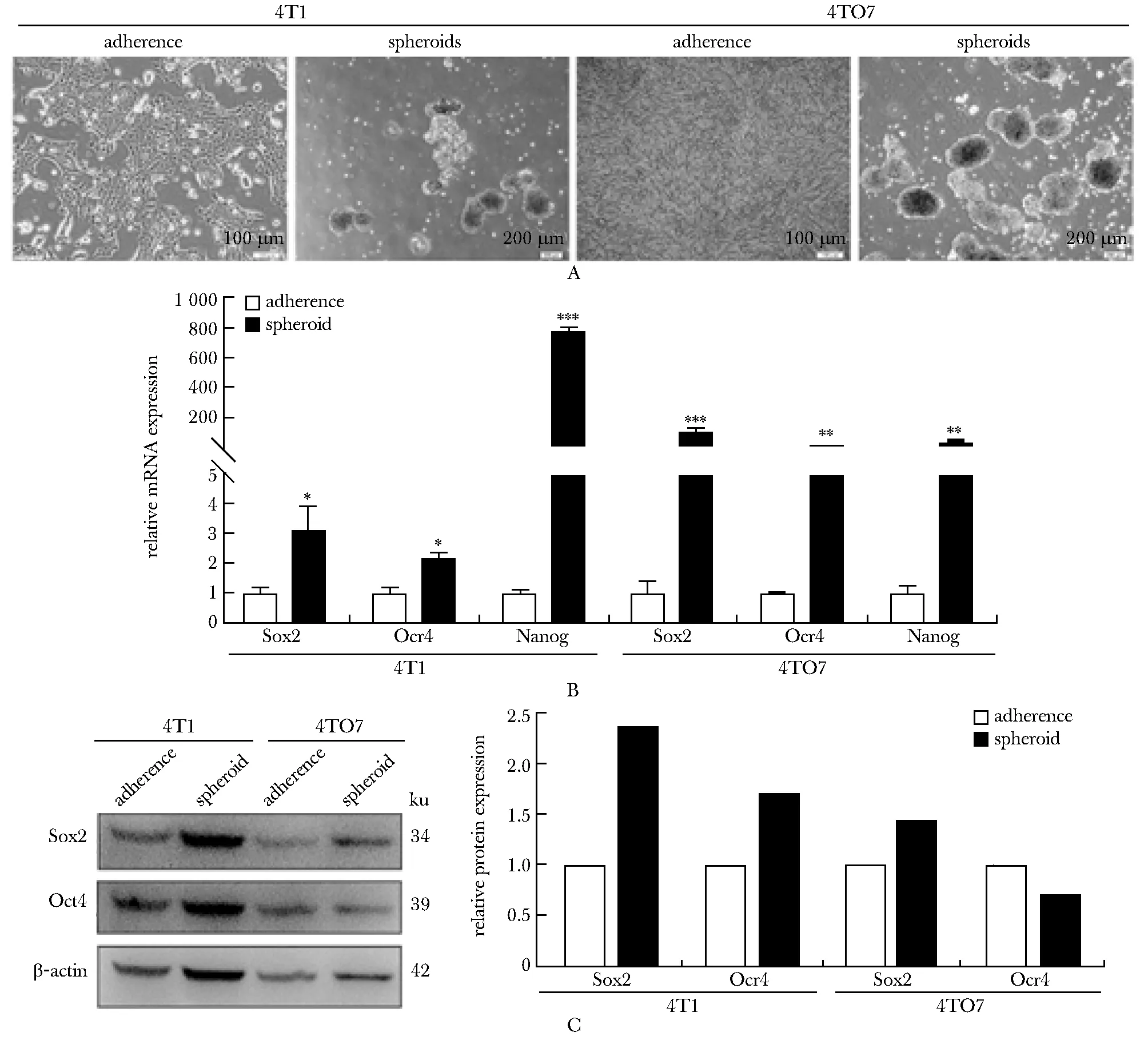
A.cellular morphology; B.mRNA levels; C.protein levels;*P<0.05, **P<0.01, ***P<0.001 compared with adherent cells
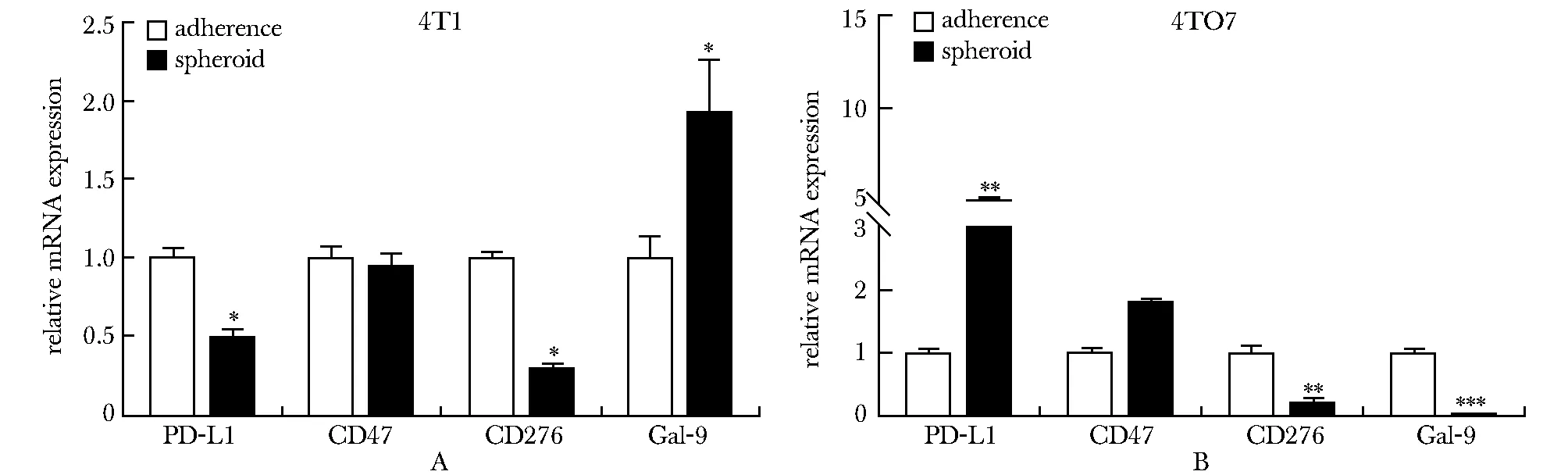
A.4T1 cells; B.4TO7 cells; *P<0.05,**P<0.01, ***P<0.001 compared with adherent cells图2 小鼠乳腺肿瘤干细胞免疫检查点分子的表达Fig 2 Expression of immune checkpoints of mouse breast cancer stem

A.4T1 cells; B.4TO7 cells;*P<0.05,**P<0.01 compared with adherent cells图3 小鼠乳腺肿瘤干细胞抗原递呈相关分子的表达Fig 3 Expression of antigen presentation related molecules of mouse breast cancer stem
肿瘤组织的流式细胞测量术检测显示,两组小鼠肿瘤组织中浸润的免疫细胞(CD45+细胞)比例无明显差异(图5A);但是,在接种了肿瘤干细胞的小鼠肿瘤组织中,CD4+T 细胞和 CD8+T 细胞的浸润比例明显增多(图5B~C),而CD11b+F4/80+巨噬细胞的浸润比例明显降低(图5D),两组中 CD11c+MHCⅡ+DC 细胞的浸润比例无明显差异(图5E)。提示,肿瘤干细胞可以招募更多的T 细胞,并且减少巨噬细胞的浸润。
3 讨论
肿瘤免疫检查点的发现和应用获得了2018年的诺贝尔生理学或医学奖,标志着肿瘤免疫治疗的新时代已经到来。尽管过去对于肿瘤干细胞的干性特征及其调控机制有较多研究[13-14],但是目前关于肿瘤干细胞的免疫学特性却鲜有报道。本研究结果显示,肿瘤干细胞中免疫检查点分子的表达进一步上调,并且不同类型的小鼠乳腺癌干细胞(4T1 和 4TO7),其各种免疫检查点分子的表达不尽相同,提示肿瘤干细胞可能具有独特的免疫逃逸潜能,而且不同类型的肿瘤干细胞其发生免疫逃逸的分子机制并不相同,因此基于免疫检查点理论的治疗策略需要更加精细和准确。
小鼠乳腺癌细胞系 4T1和 4TO7经过成球培养后,其中一些帮助抗原加工与递呈的分子(B2m和TAP1等)有所上调,这与我们预期的肿瘤干细胞抗原递呈通路受损的免疫逃逸机制有些不一致。最近关于正常组织干细胞免疫原性的研究发现,在毛囊和小肠组织中,增殖活跃的干细胞通过 Nlrc5 转录激活MHCⅠ类分子的表达,从而被 T 细胞识别并清除[15]。本研究发现,Nlrc5在乳腺癌干细胞中确实低表达,推测其通过降低MHCⅠ类分子来逃脱机体的免疫监视,这些结果提示乳腺癌干细胞的抗原递呈途径并没有完全失活,靶向其中的关键分子,例如Nlrc5,也许可以增加肿瘤干细胞的抗原暴露,利于机体免疫细胞对其特异性的清除。
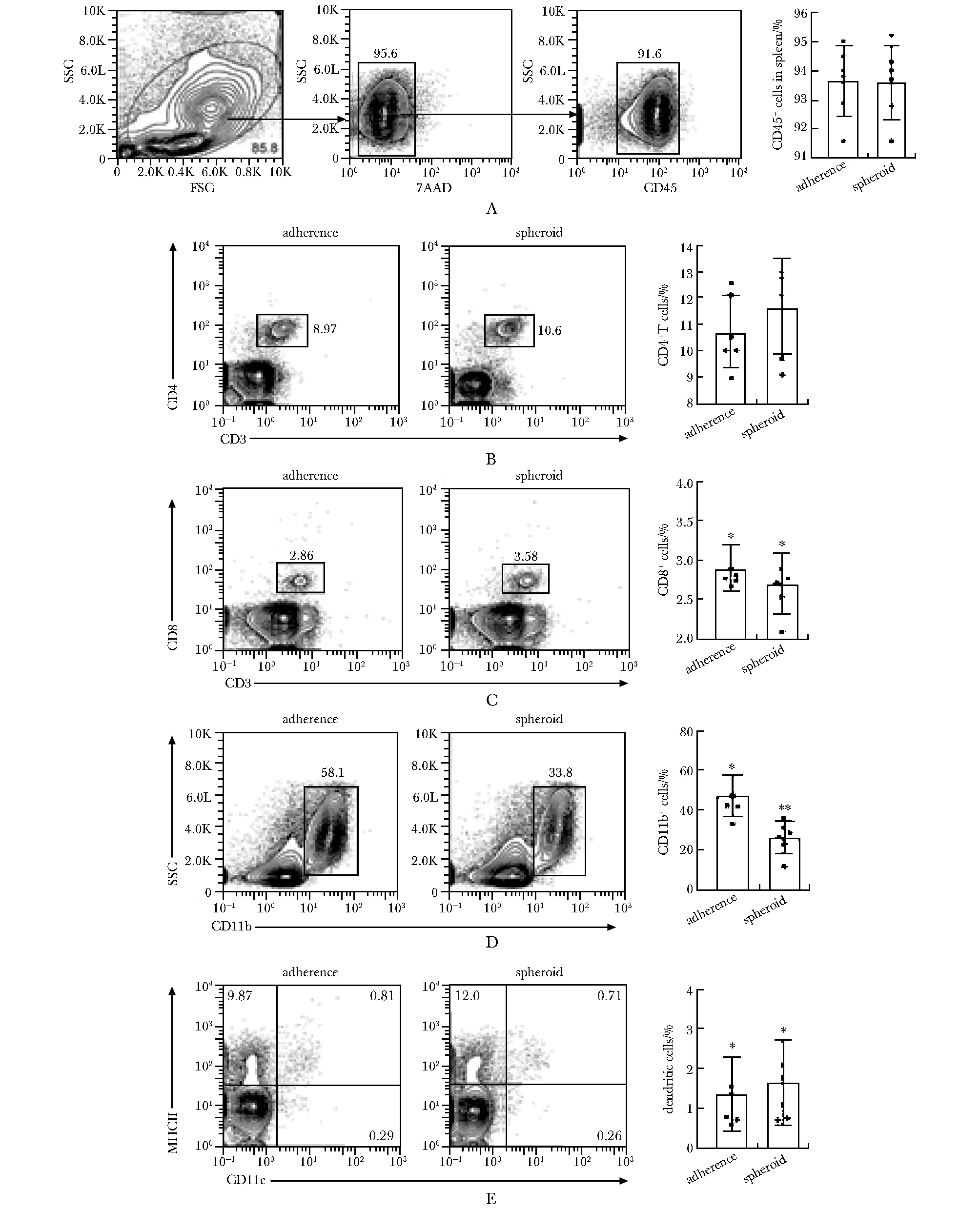
A.gating strategies;B.CD4+ cells;C.CD8+ cells;D.CD11b+ cells;E.dendritic cells; *P<0.05,**P<0.01 comparedwith adherent group

A.gating strategies; B.CD4+ cells; C.CD8+ cells; D.CD11b+ cells; E.dendritic cells; *P<0.05 comparedwith adherent group
肿瘤干细胞形成的肿瘤组织中浸润更多的CD4+T细胞和CD8+T细胞,然而与接种贴壁肿瘤细胞的小鼠相比,其肿瘤大小并没有明显的差异,推测,肿瘤干细胞虽然具有较高的免疫原性,但同时也更容易发生免疫逃逸来抵抗T细胞的清除。另外,也许肿瘤干细胞能够招募更多适应性免疫细胞的原因是肿瘤干细胞中存在更为丰富的肿瘤相关抗原,通过靶向肿瘤干细胞抗原的同时解除免疫抑制状态也许是肿瘤免疫治疗成功的关键。
综上所述,本研究通过分析肿瘤干细胞中免疫相关分子的表达和对免疫细胞的招募,初步探讨了肿瘤干细胞的免疫原性及机体的免疫反应性,为进一步探讨肿瘤干细胞发生免疫逃逸的可能机制,以及针对肿瘤干细胞免疫原性及其特异性抗原的肿瘤治疗策略提供了一定的理论基础。

