肝细胞癌中EZH2基因相关的表观遗传调控机制
赵钰珊,冀梦蝶,董昱诚,郭 鑫,宋博渊,陈 阳
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室, 北京 100005)
肝癌是一种具有高致死率的侵袭性恶性肿瘤,是世界多地区癌相关死亡的主要原因之一[1]。据中国癌症中心数据显示,肝癌占中国2015年新发恶性肿瘤的9.4%,中国肝癌患者的生存期在23个月左右,是严重影响中国国民健康的恶性肿瘤之一[2]。
肝细胞癌是中国原发性肝癌中最常见的一类[3]。随着测序成本的降低和对肝细胞癌研究的逐渐深入,越来越多的肝细胞癌公共数据可供使用,为基于生物信息学方法开展肝细胞癌发病机制与诊治靶点研究建立基础。近期已有研究使用TCGA数据库中的公共数据对肝细胞癌中特定基因的预后进行详细分析[4],也有研究通过多组学数据分析肝细胞癌的分子驱动因素和潜在生物标志物[5]。然而,对于肝细胞癌发生发展过程中表观遗传调控改变的机制仍有待深入研究。
Zeste 同源蛋白2 增强子(enhancer of zeste homolog 2,EZH2)基因编码一种组蛋白赖氨酸N-甲基转移酶,主要参与组蛋白甲基化,与多种肿瘤的发生发展密切相关[6]。因此,本研究首先基于TCGA公共数据分析了EZH2基因表达与肝细胞癌进展及预后之间的关系;随后,在细胞水平检测了EZH2抑制剂对癌细胞活性和增殖的影响;之后,分析了TCGA肝细胞癌公共数据中EZH2高表达组和低表达组之间的差异表达基因;最后,结合表观遗传数据和生物学实验研究了EZH2介导基因组表观遗传改变、影响下游基因表达的机制。
1 材料与方法
1.1 材料
1.1.1 肝细胞癌相关公共数据收集:从TCGA数据库(https://portal.gdc.cancer.gov/)中下载肝细胞癌样本数据374例,包括转录物组信息和临床信息。所需肝细胞癌细胞系HepG2 RNA-seq数据来源:ENCOD(https://portal.gdc.cancer.gov/)数据号ENCFF008CDN和ENCFF816EIE。所需肝细胞癌细胞系HepG2的ChIP-seq数据来源均为ENCODE,EZH2ChIP-seq数据号:ENCFF559YWA;H3K27me3 ChIP-seq 数据号:ENCFF893XHX;H3K4me3 ChIP-seq 数据号:ENCFF500VAH;H3K27ac ChIP-seq 数号:ENCFF764VYK;EZH2ChIP-seq narrowPeak bed数据号:ENCFF521AKL。
1.1.2 细胞系:人肝细胞癌细胞系HepG2(中国医学科学院基础医学研究所细胞资源中心)。
1.1.3 试剂及试剂盒:EZH2抑制剂GSK343(Selleck公司);CellTiter-Glo®发光法细胞活力检测试剂盒(Promega公司,G7570);所需引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 临床特征统计、基因表达与预后分析:将从 TCGA数据库中下载的肝细胞癌样本数据根据其性别、年龄和分期等临床特征进行分类统计,用K-W检验分析EZH2基因表达与肝细胞癌不同肿瘤分期之间的关系。根据EZH2基因的中位表达值,将数据库中的肝细胞癌临床样本分为EZH2高表达组(n=187)和EZH2低表达组(n=187),用Log Rank检验分析EZH2高表达组和EZH2低表达组与预后之间的关系。
1.2.2 差异表达基因筛选和功能分析:用Limma生物信息软件[7],比较EZH2高表达和EZH2低表达组之间的差异表达基因。当差异表达基因同时满足P<0.05且log2(FC)的绝对值>1 时,定义为EZH2高表达组和EZH2低表达组之间的差异表达基因,同时选取差异表达最显著的前20个上调基因和前20个下调基因制成热图。用Clusterprofiler生物信息软件分析得到GO功能富集KEGG通路[8]。
1.2.3 细胞活性和细胞增殖能力检测:常规培养肝细胞癌细胞系HepG2,实验组加入EZH2抑制剂GSK343(10 μmol/L),空白对照组加入0.9% NaCl,每组重复3次。用三磷酸腺苷检测法(ATP法)检测加入GSK343后12、24、36、48 h的细胞活性,每组重复3次。用结晶紫染色法检测加入GSK343后48 h的细胞系增殖情况,每组重复3次。
1.2.4EZH2基因相关的表观遗传特征分析:从ENCODE数据库中下载肝细胞癌细胞系HepG2的EZH2ChIP-seq数据,从narrow Peak bed文件中获得EZH2在基因组上的结合位置,其中有1 431个编码基因的转录起始位点(transcription start site,TSS)上下游5 kb存在EZH2的信号峰。之后进一步分析这1 431个编码基因是否在EZH2高表达组和EZH2低表达组之间存在基因差异表达。用deepTools软件[9]可视化EZH2和组蛋白修饰的TSS共定位情况。用python软件包trackC工具分析与EZH2相关的表达下调基因ADRA1A的表观遗传特征。
1.2.5 实时荧光定量PCR分析基因表达:为验证EZH2是否影响下游靶基因ADRA1A的表达,在肝细胞癌细胞系HepG2中加入EZH2抑制剂后,用Trizol法提取细胞总RNA,反转录获得cDNA,用RT-qPCR检测EZH2及其下游靶基因ADRA1A的表达,每组重复3次,RT-qPCR引物见表1。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences of real-time quantitative PCR
2 结果
2.1 EZH2基因表达与肝细胞癌临床数据联合分析及抑制实验验证
本研究使用生物信息学方法分析发现在TCGA数据库的肝细胞癌临床样本中,EZH2基因表达量在1~3期逐渐升高(P<0.05),在4期中表达量相对降低(图1A)。依据EZH2的基因表达量将TCGA数据库的肝细胞癌临床样本分组为EZH2高表达组和低表达组(表2)。生存分析发现EZH2基因高表达组患者的生存期显著低于EZH2低表达组(P<0.05)(图1B)。
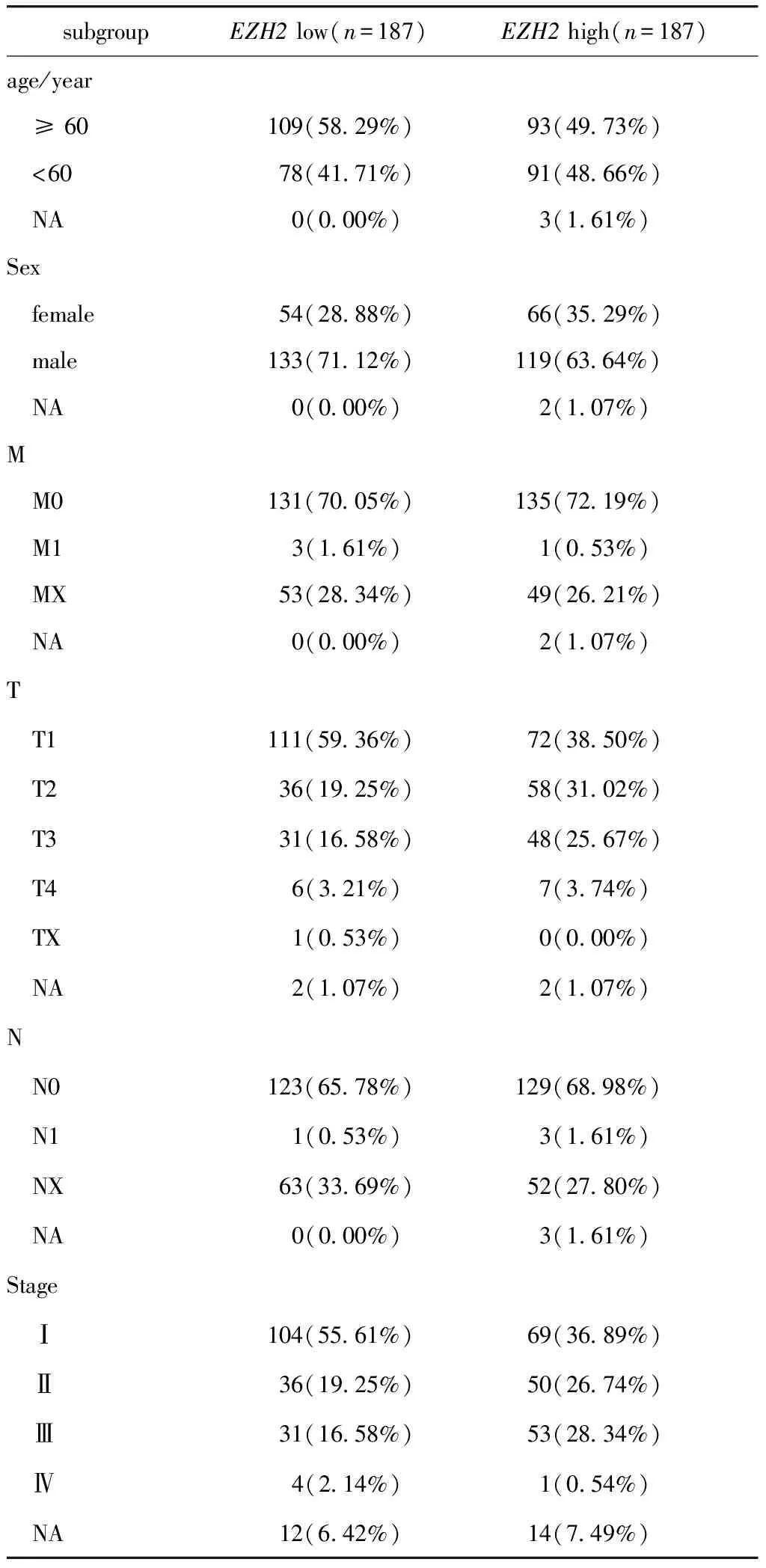
表2 TCGA数据库中374个肝细胞癌患者临床特征
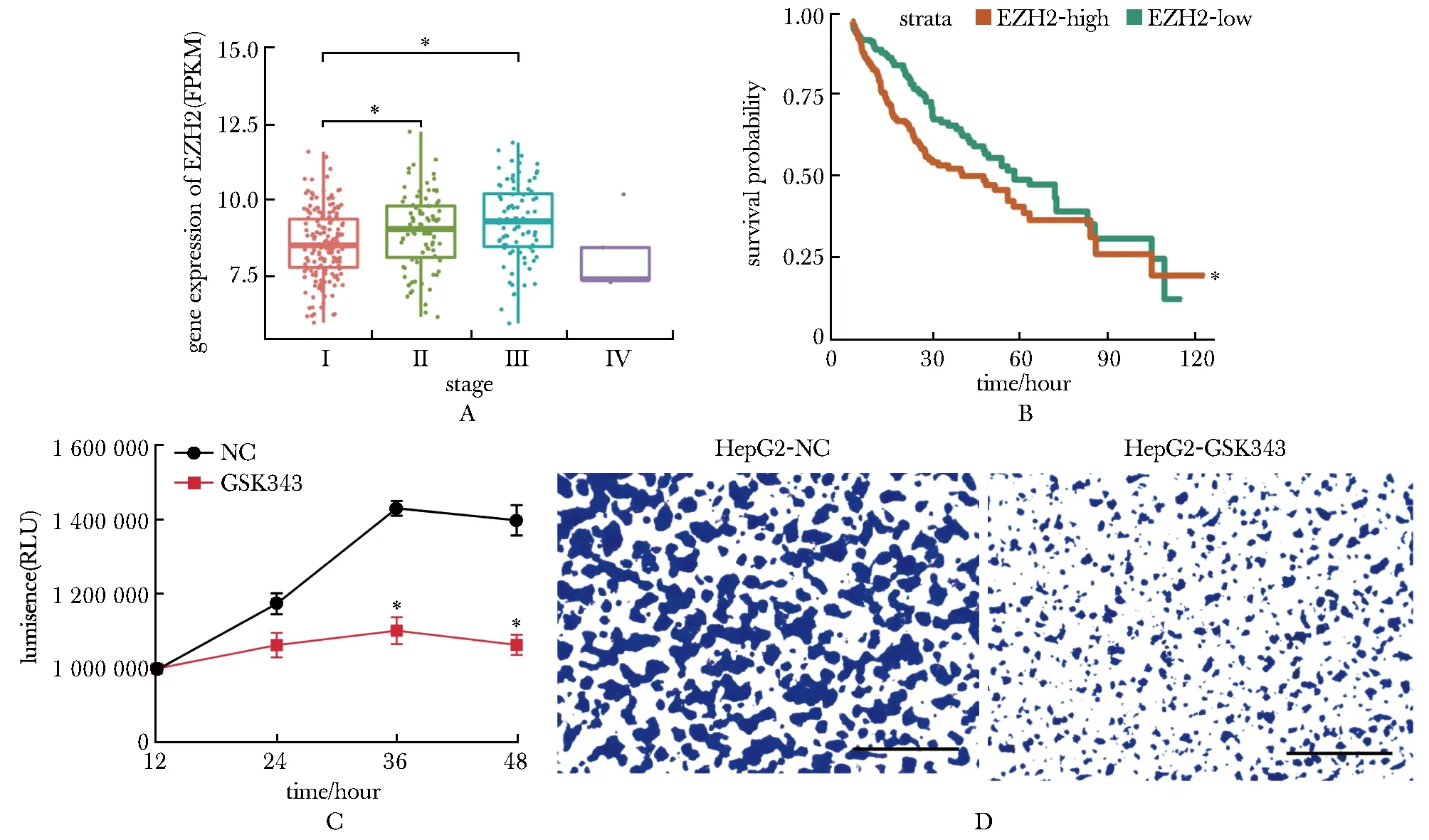
A.EZH2 gene expression levels in different stages of hepatocellular carcinoma(P<0.05); B.prognostic correlation of EZH2 expression in different stages of hepatocellular carcinoma patients,*P<0.05 compared with EZH2-Low; C.detection of cell activity in normal control group and inhibitor group,*P<0.05 compared with violet staining of cells in normal control group and inhibitor group(×60,scale bar=1 mm)
在生物实验验证中,使用EZH2抑制剂GSK343(10 μmol/L)处理肝细胞癌细胞系HepG2。药物处理36 h后抑制剂组的细胞活性显著低于对照组(P<0.05)(图1C)。结晶紫实验表明,药物处理48 h后实验组的HepG2细胞数量降低(图1D)。
2.2 EZH2表达水平相关的肝细胞癌差异表达基因
使用生物信息学分析方法,将TCGA样本中EZH2高表达组与低表达组相比,从中筛选出1 848个显著差异表达基因,其中1 721个基因表达上调,127个基因表达下调(图2A)。热图中显示了差异表达最显著的前20个上调基因和前20个下调基因的表达(图2B)。对这些基因的功能富集分析发现,它们主要富集在应答外源刺激、细胞周期调控等功能和信号通路上(图2C~D)。
2.3 肝细胞癌中EZH2相关的表观遗传修饰特征
使用ENCODE公共数据和生物信息学分析方法,本研究发现在全基因组水平EZH2有2 979个信号位于1 431个TSS的上下游5 kb内。在全基因组水平随机选取1 431个TSS上下游5 kb内没有EZH2结合,但H3K27ac、H3K4me3、H3K27me3三者中至少有一个信号的TSS区域,与EZH2结合的TSS进行表观遗传修饰特征对比分析,发现有EZH2结合的TSS附近富集H3K27me3信号,同时缺少H3K27ac信号(图3A);上下游5 kb没有EZH2结合的TSS附近H3K27me3信号显著降低(图3B)。
2.4 EZH2介导基因组表观遗传改变影响下游基因表达
通过生物信息学分析,本研究进一步发现在上述1 431个有EZH2结合在转录起始位点附近的基因中,有163个基因也同时在TCGA样本的EZH2高表达组和EZH2低表达组之间差异表达。其中在基因ADRA1A的TSS附近存在显著的EZH2结合信号和较高的H3K27me3信号(图4A)。
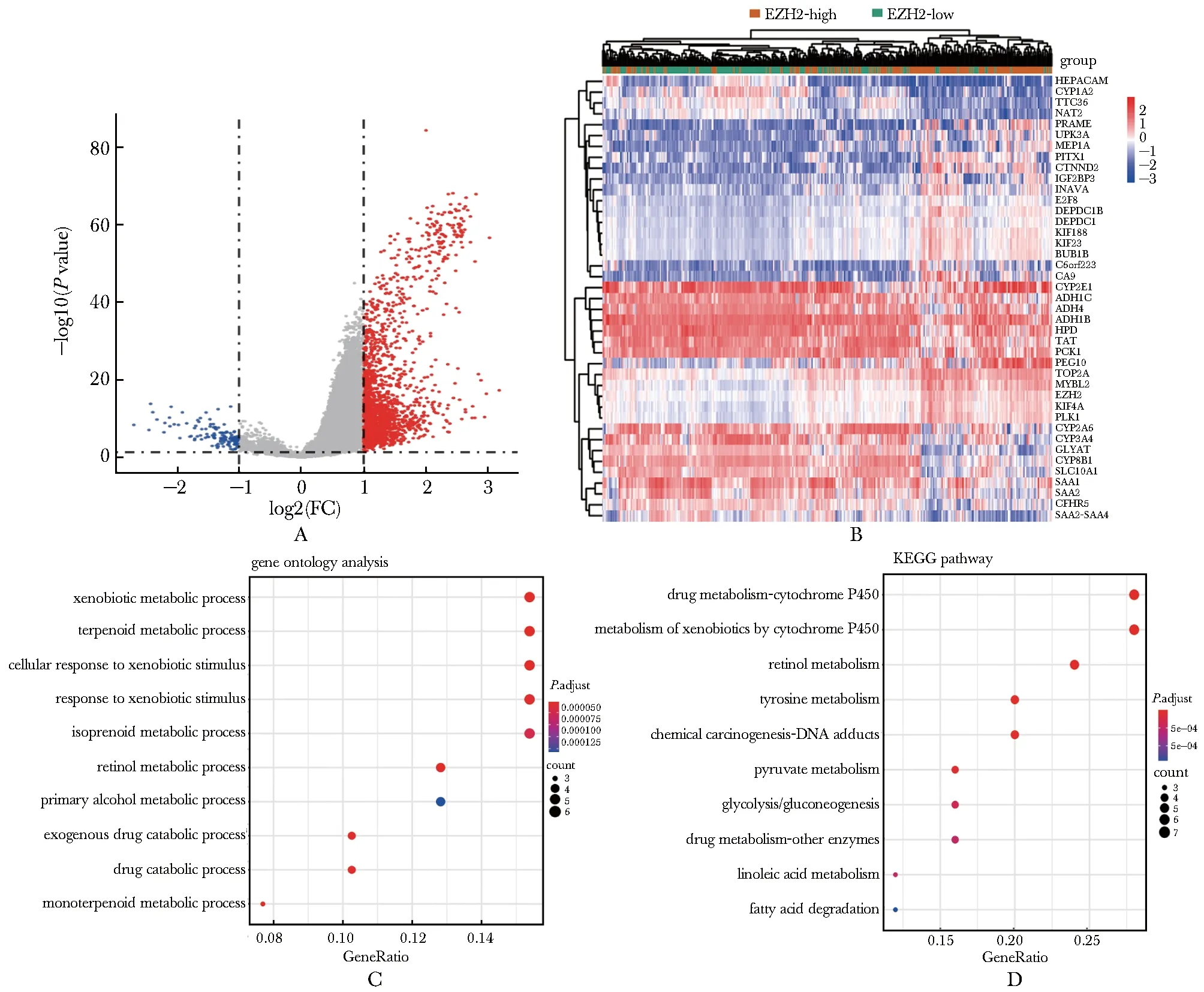
A.differential gene expression volcano plot between EZH2 high expression group and EZH2 low expression group (P< 0.05, log2 (FC)>1); B.the heatmap shows the top 20 EZH2 differentially associated up-regulated genes and the top 20 down-regulated genes, with red indicating high expression group and green indicating low expression group; C.GO functional analysis of differentially expressed genes; D.analysis of differentially expressed genes KEGG signaling pathway
通过生物实验,本研究发现使用EZH2抑制剂GSK343处理HepG2细胞48 h后,EZH2的mRNA水平与对照组相比没有显著变化,但ADRA1A的mRNA水平与对照组相比显著上升(P<0.05)(图4B~C)。
3 讨论
EZH2作为组蛋白甲基转移酶,可以通过组蛋白甲基化的表观遗传修饰影响染色质结构,抑制下游靶基因表达[10],调节肝脏代谢和肝纤维化,调控肝细胞癌发病过程,在肝细胞癌的发生发展过程中发挥重要的作用[11]。本研究通过生物信息学分析发现EZH2在肝细胞癌1~3期中异常高表达,生物学实验结果也表明EZH2抑制剂GSK343可以在体外抑制HepG2的细胞活性和细胞增殖。上述结果有助于为肝细胞癌靶向治疗提供一定实验依据。
本研究通过生物信息学分析发现EZH2可以介导基因转录起始位点附近组蛋白H3K27me3修饰增加,从而发挥表观遗传调控作用,影响下游基因表达。同时,近期也有研究表明ADRA1A基因转录起始位点的高甲基化会促进肝细胞癌的发生,是肝细胞癌诊断过程中的潜在生物标志物[12]。因此, 在后续研究中将进一步探讨EZH如何通过介导组蛋白H3K27me3修饰,影响ADRA1A基因转录起始位点的DNA甲基化。
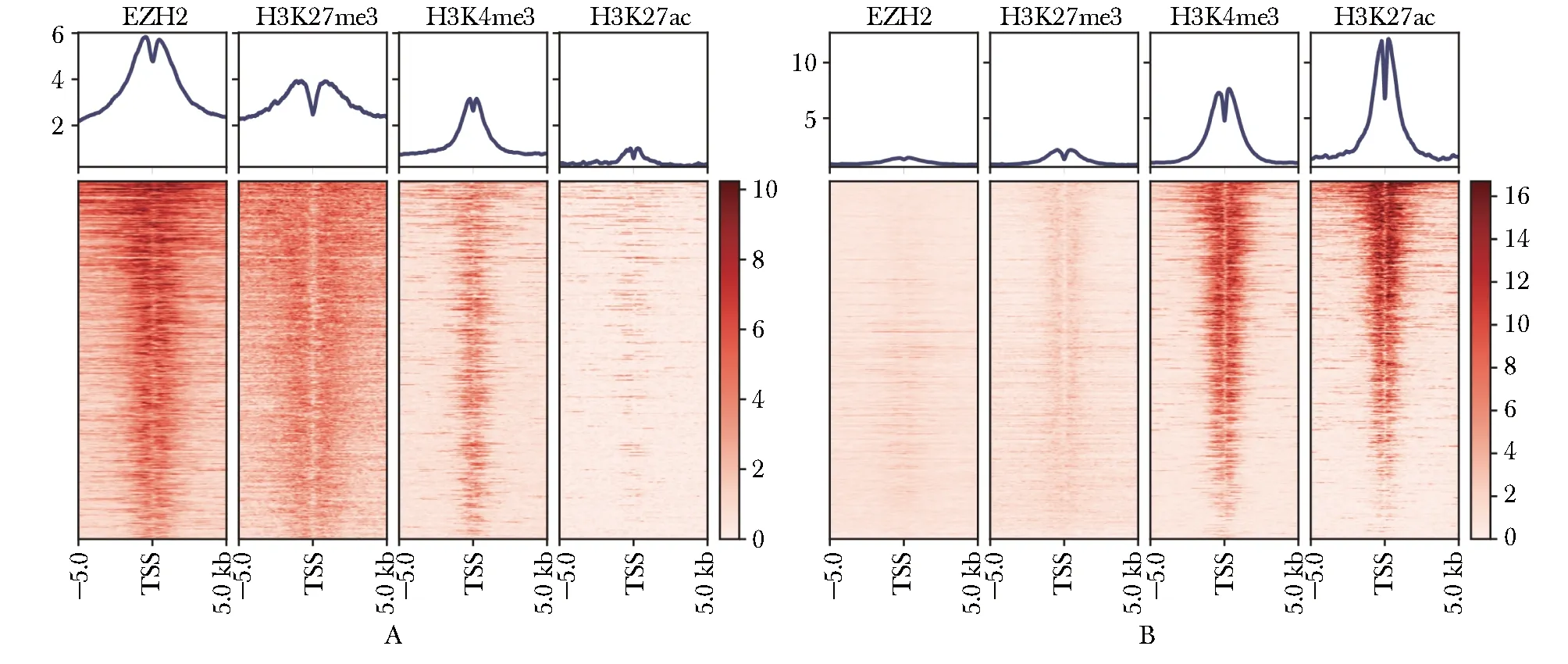
A.histone modification ±5 kb of the TSS of 1 431 genes with EZH2 binding sites; B.histone modification ±5 kb of the TSS of 1431 genes without EZH2 binding sites
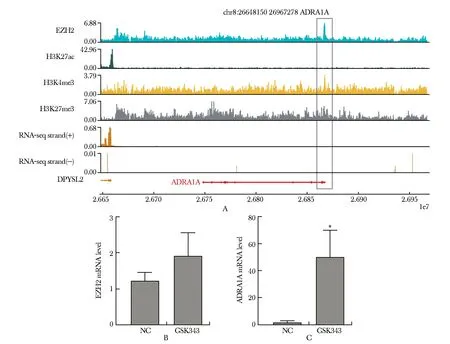
A.ChIP-seq and RNA-seq signal of ADRA1A gene; B.EZH2 mRNA expression levels in normal control(NC) and inhibitor GSK343 groups; C.ADRA1A mRNA expression levels in normal control(NC) and inhibitor GSK343 groups; *P<0.05 compared with NC group
综上所述, 本研究结合肝细胞癌公共多组学数据分析和生物实验,发现了EZH2基因表达水平可以为肝细胞癌病程进展和预后判断提供一定依据;EZH2能够通过特异的表观遗传调控机制影响下游基因表达,研究结果为进一步筛选肝细胞癌生物标志物、开发治疗方法提供了一定实验依据。

