视网膜母细胞瘤组织中赖氨酸羟化酶2表达及其对瘤细胞迁移和侵袭的影响
章晋伟,曹刚琴,汪 建(爱尔眼科医院集团大冶爱尔眼科医院,湖北黄石 435000)
视网膜母细胞瘤作为儿童特别是5岁以内婴幼儿最常见的恶性程度较高的眼内肿瘤,不仅影响患儿视力和生活质量,而且给患儿生命安全带来了严重威胁[1]。近年来,随着临床诊疗手段的不断进展,在保留患儿眼球及提高生存率方面取得了一定效果,但仍有一部分患儿治疗失败[2]。有研究指出[3],肿瘤细胞高侵袭、转移性是导致视网膜母细胞瘤患儿治疗失败及导致死亡的重要原因。前胶原赖氨酸-2-酮戊二酸-5-双加氧酶2(procollagen-lysine 2-oxoglutarate 5-dioxygenase 2,PLOD2)是PLOD家族成员之一,参与了胶原纤维交联及重构[4],而胶原纤维重构与肿瘤细胞侵袭转移密切相关[5],研究表明[6-7],PLOD2在食管癌、喉癌组织中高表达,且与肿瘤转移及患者预后有关。本研究通过检测PLOD2蛋白在视网膜母细胞瘤组织中表达比较不同病理指标的差异性,并观察下调Y79细胞中PLOD2表达对细胞迁移和侵袭力的影响。
1 材料与方法
1.1 研究对象 来源于湖北省黄石市大冶爱尔眼科医院和中国人民解放军广州军区武汉总医院2011年3月~2019年3月间行眼球摘除手术治疗的患儿73例,其中男童45例,女童28例,年龄6个月~12岁,中位年龄4.1岁,发病侧:左侧38例,右侧35例;分化程度:低-未分化33例;中-高分化40例;按照国际视网膜母细胞瘤分期标准(IIRC):D期30例,E期43例;发生脉络膜浸润26例;发生视神经浸润38例。纳入标准:①均为单眼;②术前未接受放化疗治疗;③术后病理确诊为视网膜母细胞瘤;④临床资料完整。同期,收集32例因外伤行手术治疗患儿的正常视网膜组织作为对照组,其中,男童19例,女童13例,年龄8个月~14岁,中位年龄4.7岁。两组患儿在性别、年龄均衡可比。本研究通过医院伦理委员会批准,所有患儿家属均知情同意。
1.2 仪器与试剂 兔抗人PLOD2多克隆抗体(美国CST公司),免疫组织化学试剂盒和配套试剂(武汉博士德生物工程有限公司),Y79细胞(美国ATCC公司),胎牛血清、RPMI-1640培养液、青霉素和链霉素(美国Gibco公司),胰蛋白酶(上海甘源实业有限公司),PLOD2和内参引物由上海生工生物公司设计合成,Trizol总RNA提取试剂(上海酶联生物公司),Lipofectamine 2000试剂(美国Invitrogen公司),PLOD2干扰及阴性对照序列均由上海吉玛公司设计合成,逆转录和PCR试剂盒(大连宝生物公司),Transwell小室(美国Corning公司),基质胶(美国BD公司),兔抗人E-钙黏蛋白(E-cadherin,E-cad)和N-钙黏蛋白(N-cadherin,N-cad)多克隆抗体(美国Santa Cruz公司),CX41生物显微镜(日本Olympus公司),LightCycler 96实时荧光定量PCR仪(瑞士Roche公司),凝胶电泳图像分析系统(美国Bio-Rad公司)。
1.3 方法
1.3.1 免疫组织化学法检测组织中PLOD2蛋白表达:按照试剂盒说明,组织石蜡标本经切片、烤片、脱蜡、脱水、灭活内源性过氧化物酶。10g/dl山羊血清封闭,加入1:400稀释的一抗兔抗人PLOD2多克隆抗体,室温孵育60min,滴加二抗,37℃孵育30min,DAB显色,苏木素复染,脱水、透明、封片、观察,用PBS替代一抗作为阴性对照。结果判定[8]:PLOD2蛋白主要表达于细胞质中,①根据染色:无着色0分,淡黄1分,棕黄2分,黄褐3分;②按阳性细胞比:<5% 0分,5%~25% 1分,26%~50% 2分,51%~75% 3分和>75% 4分;按①×②总分,≤4分(-),>4分(+)。
1.3.2 细胞培养和处理:Y79细胞置于含10g/dl胎牛血清RPMI-1640培养液培养,培养条件:5ml/dl CO2,37℃培养箱,胰酶消化、传代,将对数生长期细胞消化后接种于6孔板,1×106个/孔,常规培养24h,将细胞分为PLOD2干扰组(I组)、阴性对照组(NC组)和空白组(B组),按照Lipofectamine 2000转染试剂操作说明分别转染PLOD2干扰序列、阴性对照序列和不作任何处理。转染后培养48h进行后续实验。
1.3.3 RT-qPCR检测PLOD2 mRNA表达:取细胞,按Trizol法提取总RNA,并检测纯度及浓度。对总RNA反转录为cDNA,RT-qPCR检测细胞中PLOD2 mRNA表达量。引物:PLOD2:上游:5’-GA CAGCGTTCTCTTCGTCCTCA-3’,下游:5’-CTCCA GCCTTTCGTGGTGACT-3’;GAPDH:上 游:5’-TC AGCAATGCCTCCTGCAC-3’,下游:5’-TCTGGGTG GCAGTGATGGC-3’。条件:96℃ 2min,95℃ 30s,58℃ 30s,73℃ 30s,循环38次。用2-△△Ct法计算细胞中PLOD2 mRNA表达量。
1.3.4 细胞迁移实验:取各组细胞,离心取沉淀,用无血清培养液按2×106/ml重悬。小室上室中加入100μl 悬液,同时取含10ml/dl胎牛血清的培养液600μl加入下室,常规培养24h,将小室取出,4g/dl多聚甲醛固定,1g/dl结晶紫作用15min,自然干燥,镜下观察。重复实验3次。
1.3.5 细胞侵袭实验:用培养液稀释基质胶,涂抹在小室上室,风干使用。其余步骤同1.3.4。
1.3.6 Western blot法检测PLOD2,E-cad和N-cad蛋白表达:取各组细胞,加入细胞裂解液,提取总蛋白,并用BCA法检测浓度。取总蛋白30μg,行SDS-聚丙烯酰胺电泳分离,电转至PVDF膜,用5g/dl脱脂奶粉封闭120min,4℃下加入目标抗体[兔抗人PLOD2,E-cad和N-cad多克隆抗体(稀释比例1:500,1:1 000和1:800)],过夜孵育,用TBST冲洗3次,室温下加入二抗,孵育120min。避光加入ECL液,显影后拍照,利用Quantity One软件对条带进行分析,计算目标蛋白相对于内参蛋白的相对表达量。
1.4 统计学分析 将研究结果数据纳入SPSS 13.0统计软件中,计数资料采用百分率(%)表示,使用χ2检验;计量资料采用均数±标准差(±s)表示,使用方差分析进行组间比较,经t检验,P<0.05为差异有统计学意义。
2 结果
2.1 视网膜母细胞瘤和对照组组织中PLOD2蛋白表达 见图1。与对照组比较,PLOD2蛋白在视网膜母细胞瘤组织中阳性表达率明显升高(75.34%vs 25.00%), 差异有统计学意义(χ2=23.493,P<0.001)。
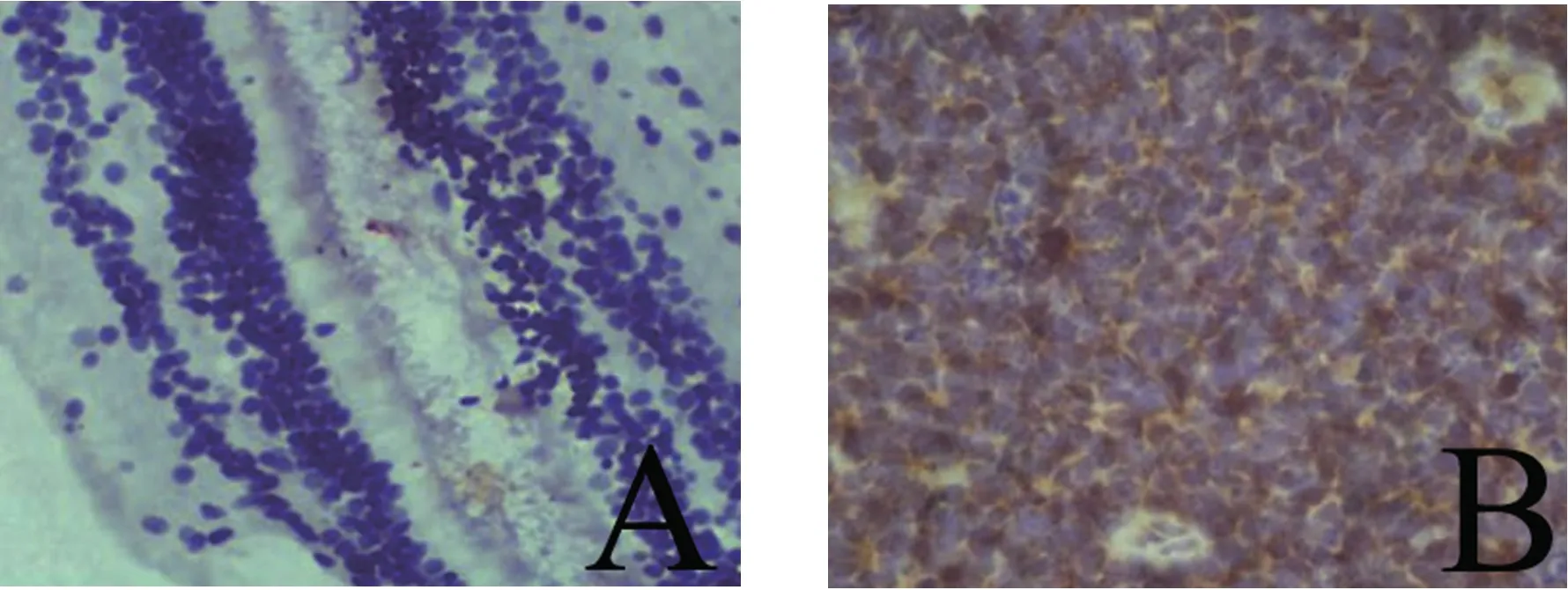
图1 免疫组织化学法检测PLOD2蛋白在视网膜母细胞瘤和对照组组织中的表达(SP×200)
2.2 不同临床病理指标间PLOD2蛋白表达差异 见表1。不同性别、年龄、发病侧和分化程度的视网膜母细胞瘤患者组织中PLOD2蛋白阳性表达率差异无统计学意义(P>0.05);与IIRC分期D期、未发生脉络膜浸润和未发生视神经浸润比较,IIRC分期E期、发生脉络膜浸润和发生视神经浸润的视网膜母细胞瘤患者组织中PLOD2蛋白阳性表达率明显升高,以上差异均有统计学意义(均P<0.05)。

表1 PLOD2蛋白在不同临床病理指标间的表达差异[n,(%)]
2.3 三组细胞中PLOD2 mRNA表达量 与NC组和B组比较,PLOD2 mRNA在I组细胞中相对表达量明显降低(0.27±0.09 vs 1.01±0.08, 1.00±0.05),组间差异有统计学意义(F=183.919,P<0.001)。NC组与B组PLOD2mRNA相对表达量比较,差异无统计学意义(t=0.392,P=0.704)。
2.4 下调PLOD2表达抑制细胞迁移力和侵袭力见表2和图2。与NC组和B组比较,I组下调PLOD2表达后细胞迁移能力和侵袭能力均显著降低(均P<0.05)。I组与B组比较迁移细胞数和侵袭细胞数(t=3.849, 7.415),I组与NC组比较迁移细胞数和侵袭细胞数(t=4.041, 5.225)差异均有统计学意义(均P<0.05)。NC组与B组迁移细胞数和侵袭细胞数比较,差异无统计学意义(t=0.469, 0.939,P=0.649, 0.370)。

图2 各组细胞迁移能力(A:I组,B:NC组,C:B组,结晶紫×100)
表2 三组细胞迁移和侵袭能力比较(±s,个)
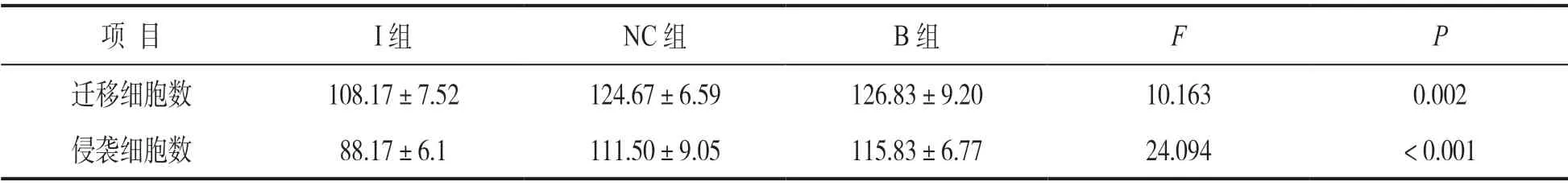
表2 三组细胞迁移和侵袭能力比较(±s,个)
项 目 I组 NC组 B组 F P迁移细胞数 108.17±7.52 124.67±6.59 126.83±9.20 10.163 0.002侵袭细胞数 88.17±6.1 111.50±9.05 115.83±6.77 24.094 < 0.001
2.5 下调PLOD2表达抑制细胞EMT的形成 见表3和图3。与NC组和B组比较,下调PLOD2表达后N-cad蛋白相对表达量明显降低,而E-cad蛋白相对表达量明显升高,差异均有统计学意义(P<0.05)。I组与B组PLOD2,E-cad蛋白,N-cad蛋白相对表达量比较(t=16.028, 9.558, 9.363),I组与NC组PLOD2,E-cad蛋白,N-cad蛋白相对表达量比较(t=19.220, 8.977, 6.756),差异均有统计学意义(均P<0.05)。NC组与B组比较,PLOD2,E-cad蛋白,N-cad蛋白相对表达量差异无统计学意义(t=0.806, 0.900, 0.833,P=0.439, 0.389,0.425)。提示PLOD2促进细胞EMT形成。

图3 各组细胞侵袭能力(A:I组,B:NC组,C:B组,结晶紫×100)
表3 3组细胞中PLOD2,E-cad和N-cad蛋白表达比较(±s,个)
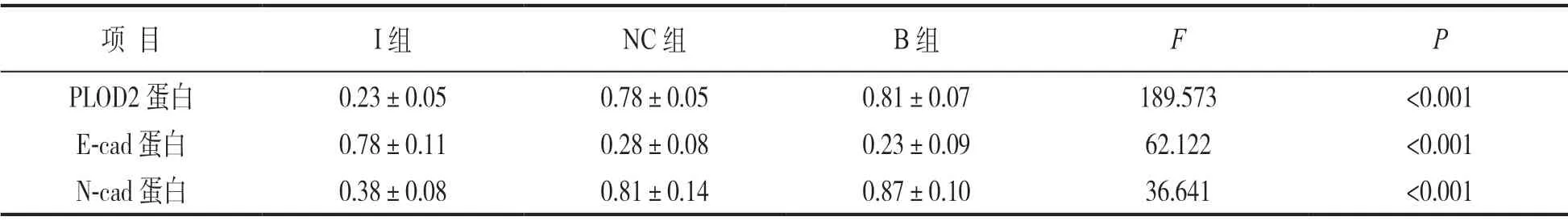
表3 3组细胞中PLOD2,E-cad和N-cad蛋白表达比较(±s,个)
项 目 I组 NC组 B组 F P PLOD2蛋白 0.23±0.05 0.78±0.05 0.81±0.07 189.573 <0.001 E-cad蛋白 0.78±0.11 0.28±0.08 0.23±0.09 62.122 <0.001 N-cad蛋白 0.38±0.08 0.81±0.14 0.87±0.10 36.641 <0.001
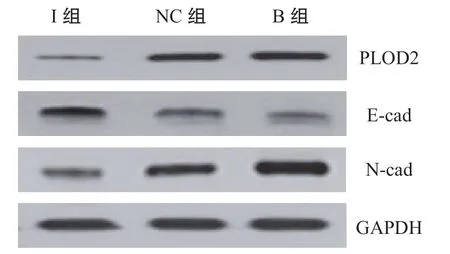
图3 各组细胞中PLOD2,E-cad和N-cad蛋白表达
3 讨论
视网膜母细胞瘤作为婴幼儿最常见且致盲率、致死率较高的眼内原发性恶性肿瘤,近年来发病率呈上升趋势[9],给婴幼儿生命安全构成严重威胁。有研究指出[10],视网膜母细胞瘤细胞易发生侵袭和转移,转移是导致患儿死亡的主要危险因素。研究表明[11],肿瘤微环境特别是细胞外基质在肿瘤细胞侵袭和转移中的作用举足轻重。有研究指出[12],胶原纤维作为细胞外基质主要成分,其发生增多、重构及硬度增加会加速肿瘤细胞快速运动。PLOD家族包括PLOD1,PLOD2和PLOD3,在促进胶原成熟及分泌中发挥重要作用[13],其中,PLOD2受缺氧诱导因子1调节,可特异性调控胶原纤维交联模式,在胶原纤维交联、排列、重构中发挥关键性作用[14]。有研究指出[15],PLOD2是晚期胃癌腹膜扩散的潜在调节剂。亦有研究指出[16],PLOD2在食管癌组织中表达升高,且与肿瘤转移相关。李丹等[17]指出,PLOD mRNA在肺腺癌组织中表达升高,与预后关系密切。本研究显示,PLOD2蛋白在视网膜母细胞瘤组织中阳性表达率高于癌旁组织,说明视网膜母细胞瘤组织中PLOD2蛋白呈高表达。同时,对不同病理特征患儿组织中PLOD2蛋白表达情况比较发现,IIRC分期E期、发生脉络膜浸润和视神经浸润患儿组织中阳性表达率升高,说明PLOD2蛋白可能与肿瘤恶性化进程有关,参与了肿瘤进展及脉络膜和视神经浸润过程。
有研究指出[15],PLOD2可促进胃癌细胞侵袭和迁移,导致胃癌的腹膜扩散。亦有研究指出[18],PLOD2可调节子宫内膜癌细胞的迁移和侵袭。本研究通过转染PLOD2干扰物的方法下调Y79细胞中PLOD2基因表达,RT-qPCR和Western blot实验结果均提示成功下调细胞中PLOD2表达。本研究Transwell实验示,下调PLOD2可显著抑制细胞迁移和侵袭。NAGARAJA等[19]指出,上皮-间质转化与肿瘤细胞迁移和侵袭密切相关。而KIYOZUMI等[15]亦指出,PLOD2是胆管癌上皮-间质转化的关键调节剂。本研究结果显示,抑制PLOD2基因表达后,细胞中与上皮-间质转化过程中上皮性标志物E-cad蛋白表达量升高,而间质标志物N-cad蛋白表达量降低,表明PLOD2表达被抑制后可抑制细胞上皮-间质转化的发生,从而使细胞迁移和侵袭能力被抑制。
综上所述,PLOD2蛋白在视网膜母细胞瘤组织中高表达,可能通过促进EMT形成而促进癌细胞的迁移和侵袭能力,但其可能的机制尚待开展相关研究予以明确。

