非小细胞肺癌组织中miR-30a和CD73的表达水平与预后相关性分析
马彦娥,苏虎艳,王倩如,郝光军(榆林市第一医院肿瘤诊疗中心,陕西榆林 719000)
肺癌是美国人癌症相关死亡的主要原因,每年约有15.4万美国人死于肺癌[1]。近年来,肺癌在中国的发病率和死亡率也逐年增加,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)是一种常见的肺癌类型,约占肺癌总数的80%,10年总生存率仍较低,寻找能早期评估NSCLC患者预后的指标非常关键[2]。微小核糖核酸(microRNA,miRNA)在肿瘤中的研究越来越受到关注,miRNA通过与靶基因mRNA特异性结合来调控mRNA蛋白表达,参与肿瘤发生发展进程[3]。最新研究发现[4],微小RNA-30a(miR-30a)在NSCLC患者血清和肿瘤组织中均表达下调,低表达miR-30a与较差生存率有关,具有作为NSCLC筛查和预后生物标志物的潜力。CD73,也称为胞外5’-核苷酸酶(ecto-5’-nucleotidase),有研究发现,CD73的过表达在NSCLC肿瘤中产生了免疫抑制性微环境,可催化释放细胞外腺苷抑制T细胞的抗肿瘤功能并诱导T细胞凋亡,从而帮助肿瘤细胞逃避免疫监视[5-6]。因此,本研究通过同时检测NSCLC肿瘤组织中miR-30a和CD73表达情况,分析其表达水平与患者预后的关系,讨论其临床意义。
1 材料与方法
1.1 研究对象 选取2015年8月~2019年12月于陕西省榆林市第一医院术后病理检查证实为非小细胞肺癌组织120例为研究组,其中男性67例,女性53例,年龄34~76岁,中位年龄64岁。病理类型:腺癌76例,鳞癌44例;分化程度:低分化癌47例,中高分化癌73例;TNM分期:Ⅰ期34例,Ⅱ期61例,Ⅲ期25例;发生淋巴结转移54例,未发生淋巴结转移66例。50例正常癌旁组织(距离癌组织5cm以上,其中有70例患者癌旁组织资料缺失)为对照组。纳入标准:①均为首次确诊,并于本院治疗;②预计生存时间>3个月;③术前未接受过其他任何抗肿瘤治疗;④TNM分期为Ⅰ~Ⅲ期;⑤临床资料及随访资料完整。排除标准:①并发其他恶性肿瘤;②有肺癌家族史;③并发精神、意识、听觉障碍患者;④并发其他肺部疾病。本研究获得本院伦理委员会批准通过。
1.2 仪器与试剂 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪(济南来宝医疗器械有限公司),TRIzol试剂(美国Sigma公司),反转录试剂盒和qRT-PCR扩增试剂盒(Thermo Scientific公司),兔抗人CD73多克隆抗体(艾美捷科技有限公司),DAB显色试剂盒(上海博湖生物科技有限公司)。
1.3 方法
1.3.1 qRT-PCR技术检测miR-30a相对表达量:首先将组织样本匀浆,利用TRIzol试剂提取组织中的RNA,并检测RNA的浓度和纯度。按照反转录试剂盒说明书将RNA反转录为cDNA,并进行PCR扩增。miR-30a以U6为内参,引物序列由上海生工生物工程公司合成。miR-30a上游引物:5’-ACAC TCCAGCTGGGTGTAAACATCCTCGAC-3’,下 游引物:5’-TGGTGTCGTGGAGTCG-3’;U6上游引物:5’-CTCGCTTCGGCAGCACA-3’,下游引物:5’-AA CGCTTCACGAATTTGCGT-3’。利用2-ΔΔCt计算miR-30a相对表达量。
1.3.2 免疫组织化学法检测CD73的表达情况:将组织样本用甲醛固定后常规石蜡包埋,以4μm连续切片,再常规脱蜡、水化、抗原修复,采用链霉亲合素-生物素复合物(SP)法进行染色,方法步骤严格按试剂盒说明书操作,一抗采用兔抗人CD73多克隆抗体,稀释浓度1∶100,滴加一抗后于4℃冰箱孵育过夜,再滴加生物素标记的二抗,DAB显色,苏木素复染,脱水、透明、中性树胶封片,显微镜下观察。用磷酸盐缓冲液(PBS)作为阴性对照。
以组织细胞显色为棕黄色为表达阳性,选取5个高倍镜视野进行双盲法评定,由病理科两位经验丰富的医师分别给出结果。按染色强度评分:无染色0分,浅黄色1分,黄色或黄棕色2分,棕褐色3分;按阳性细胞百分比评分:无阳性细胞记0分,<25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分。取两种方法得分的乘积,>1分为表达阳性(+),≤1分为表达阴性(-),≥3分为高表达,<3分为低表达。
1.4 统计学分析 采用SPSS25.0软件进行数据的录入与分析。计量资料以均数±标准差(±s)表示,采用独立样本t检验比较NSCLC癌组织和正常癌旁组织中miR-30a的表达水平;计数资料以频数(n)或百分比(%)表示,采用χ2检验分析miR-30a和CD73表达水平与NSCLC患者临床病理参数之间的关系;采用Kaplan-Meier法进行生存分析,组间差异比较利用对数秩检验(LogRank test);多因素COX回归分析影响NSCLC患者预后的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 miR-30a在NSCLC癌组织和正常癌旁组织中的表达水平比较 miR-30a在NSCLC癌组织中的表达水平为1.17±0.21,明显低于正常癌旁组织(1.62±0.48),差异有统计学意义(t=8.521,P=0.000)。
2.2 免疫组织化学检测结果 见图1。CD73在NSCLC癌组织中主要定位于细胞质和细胞膜,高表达标本染色以棕色为主。CD73在NSCLC癌组织及癌旁正常组织中的阳性表达率分别为63.33%(76/120)和32.00%(16/50),差异有统计学意义(χ2=13.955,P=0.000)。

图1 免疫组织化学检测CD73在NSCLC癌组织和正常癌旁组织中的表达(SP,×200)
2.3 NSCLC癌组织中miR-30a,CD73表达情况与患者临床病理参数之间的关系 见表1。以miR-30a在癌组织中表达水平中位数(1.20)为分界点将其分为miR-30a高表达组(61例)和低表达组(59例),根据免疫组织化学评分是否≥3分将其分为CD73高表达组(68例)和低表达组(52例),分析可知,miR-30a,CD73表达与NSCLC患者年龄、性别、病理类型无关(均P>0.05),与肿瘤分化程度、临床分期、淋巴结转移有关(均P<0.05)。
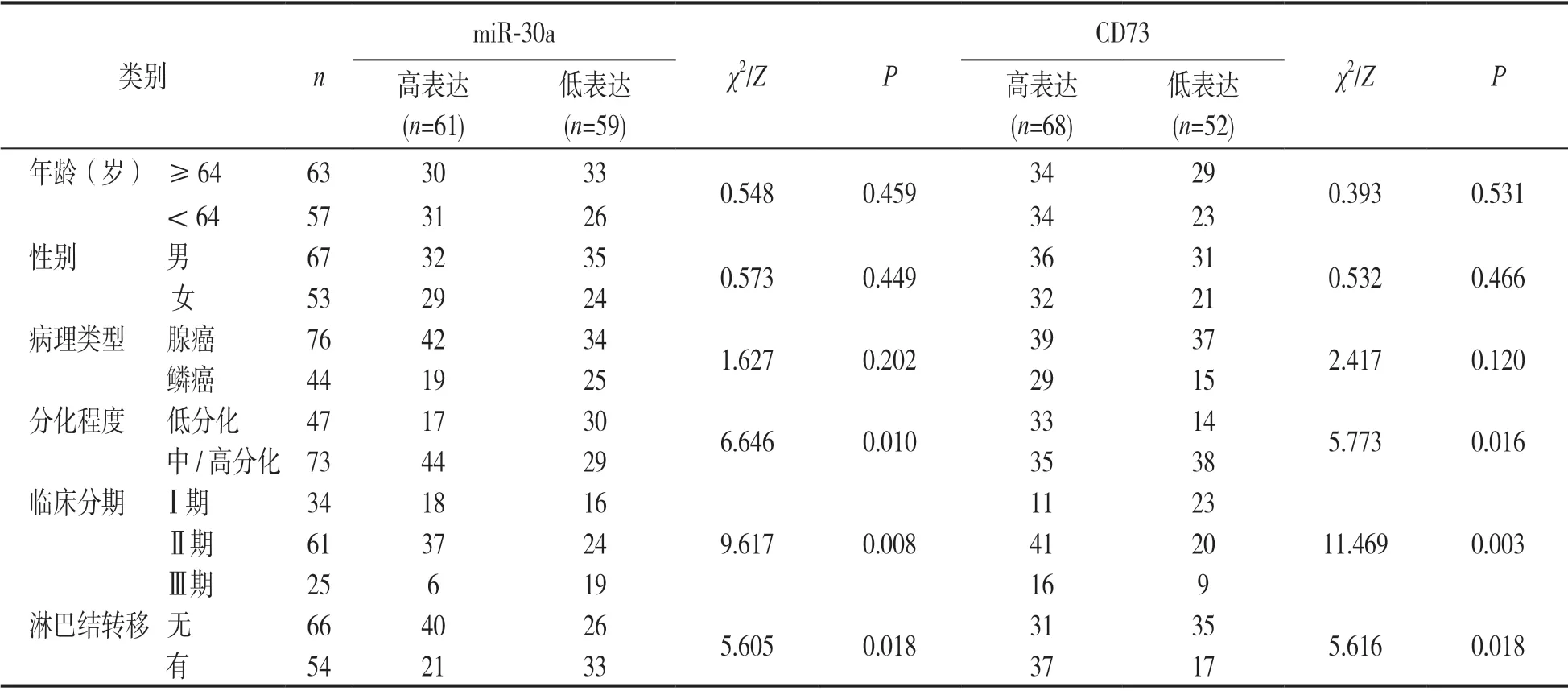
表1 NSCLC癌组织中miR-30a,CD73表达情况与患者临床病理参数之间的关系
2.4 生存分析 见图2。随访一年,统计NSCLC患者miR-30a,CD73表达情况与生存状况的关系,结果显示miR-30a高表达组NSCLC患者一年累积生存率(86.89%, 53/61)明显高于低表达组(59.32%,35/59)(Log Rankχ2=11.652,P=0.000);CD73高表达组NSCLC患者一年累积生存率(58.82%,40/68)明显低于低表达组(92.31%, 48/52)(Log Rankχ2=16.894,P=0.000)。

图2 miR-30a,CD73表达与NSCLC患者生存时间的关系
2.5 影响NSCLC患者预后的危险因素分析 见表2。以NSCLC患者预后不良(随访时患者死亡)为因变量(1=预后不良,0=预后良好),将TNM分期、分化程度、淋巴结是否转移及miR-30a,CD73纳入自变量进行多因素COX回归分析,结果显示分化程度低(HR=1.677,95%CI:1.092~2.576),发生淋巴结转移(HR=1.574,95%CI:1.043~2.376)是影响NSCLC患者预后不良的危险因素,而miR-30a低表达(HR=1.479,95%CI:1.027~2.130),CD73高表达(HR=1.501,95%CI:1.059~2.128)是影响NSCLC患者预后不良的独立危险因素。
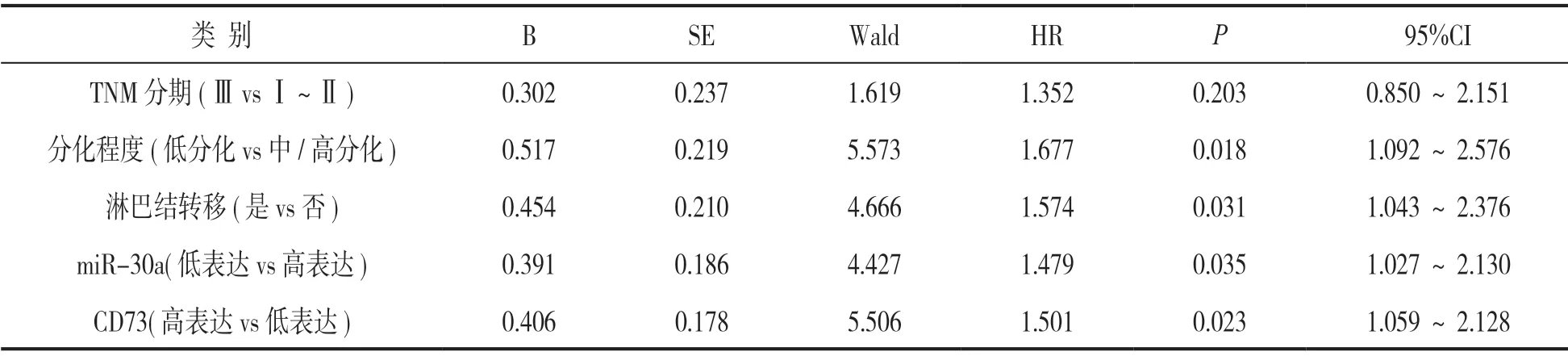
表2 影响NSCLC患者预后的危险因素
3 讨论
肺癌是全球范围内发病率较高的恶性肿瘤之一,严重影响患者的身心健康。NSCLC作为肺癌中的一种,主要源于支气管黏膜上皮或肺泡上皮细胞恶化,根据其病理类型主要有腺癌、鳞癌、大细胞癌、腺鳞癌等[7]。NSCLC的发病机制尚不清楚,但根据流行病学研究显示,主要与环境因素、自身因素及遗传因素等有关。因此,需要找到能早期评估NSCLC患者预后的生物学指标为改善预后提供依据。
miRNAs是一类小的(平均22个氨基酸)内源性非编码RNA分子,在癌症的发生及进展中起重要作用,主要是通过与位于目标靶基因mRNA的3’非翻译区的目标序列结合来调节致癌和/或肿瘤抑制基因,最终导致目标mRNA降解或蛋白翻译受阻[8-9]。研究发现,miR-30a在肿瘤转移中被下调,对维持上皮性状至关重要,因此miR-30a是转移性癌症中高度下调的miRNAs之一,在转化生长因子β促进的肿瘤转移过程中下降,最终导致侵袭、转移相关间充质因子表达增加[10-11]。YU等[12]研究报道,胃癌组织中miR-30a表达水平较癌旁非恶性组织低,其可通过靶向成纤维细胞活化蛋白α抑制胃癌转移。此外有研究表明[13],特发性肺间质性纤维化患者支气管肺泡灌洗液中miR-30a表达下调,其可通过靶向成纤维细胞活化蛋白α减弱转化生长因子β1诱导的肺成纤维细胞活化。本研究结果显示,在NSCLC患者肿瘤组织中miR-30a相对表达量明显低于癌旁正常组织,与上述结论一致。分析其水平与患者临床病理参数的关系,结果表明肿瘤分化程度低、临床分期Ⅲ期、发生淋巴结转移患者的miR-30a水平明显较低,提示miR-30a水平可能与NSCLC肿瘤分化、迁移有关。ZHOU等[14]研究发现,胰腺导管腺癌组织中miR-30a-5p表达降低与患者预后不良有一定关系,且上调miR-30a-5p表达可增加胰腺导管腺癌对吉西他滨的化疗敏感性。此外,有研究证实[15],miR-30a可削弱NSCLC肿瘤细胞对新辅助化疗(即DDP和PEM联合治疗)的抗性,抑制DDP/PEM诱导的自噬并促进DDP/PEM引发的NSCLC肿瘤细胞凋亡,因此低水平的miR-30a与NSCLC患者淋巴结转移、晚期TNM分期及较差生存期有关,为临床治疗NSCLC提供潜在治疗靶标。本研究分析了NSCLC患者术后一年的生存情况,结果显示miR-30a低表达者具有较差生存情况,进一步COX回归分析结果显示低miR-30a是影响NSCLC患者预后不良的独立危险因素,miR-30a的表达可能作为预测NSCLC预后的有效指标。
研究发现,CD73主要在内皮细胞、上皮细胞及一些免疫亚群细胞上内源性表达,可催化细胞外单磷酸腺苷去磷酸化为腺苷和无机磷酸盐[16]。CD73的表达与上皮-间质转化和免疫耐受的肿瘤微环境转录组特征密切相关,临床证实这些与疾病进展和治疗耐药性有关[17]。DIETRICH等[18]研究表明,抑制CD73表达有助于增强T24人膀胱癌细胞系的放射敏感度。沈海涛等[19]研究发现,外周血CD73+表达水平升高与原发性肝癌发生及患者肝损伤密切相关。国内学者高锋等[20]研究发现,CD73在NSCLC肿瘤组织中表达水平较正常肺组织明显升高,且与TNM分期、淋巴结转移有关,与本研究结果一致,提示CD73参与NSCLC肿瘤细胞浸润、转移。该研究还发现过表达的CD73可促进T细胞凋亡并抑制T细胞抗肿瘤作用,证实CD73是一种致癌因子。另有研究发现,在正常支气管和肺泡上皮不表达CD73,而在癌细胞、癌症相关成纤维细胞和肿瘤浸润淋巴细胞中过度表达,且CD73的高表达与乳酸脱氢酶5和癌细胞的缺氧诱导因子1α表达直接相关[6]。本研究结果显示,CD73高表达NSCLC患者一年累积生存率明显低于低表达患者,且高表达CD73是影响NSCLC患者预后不良的独立危险因素,表明CD73在NSCLC预后预测中起重要作用。早期研究发现[21],CD73是miR-30a-5p的直接靶标,而过表达miR-30a-5p抑制了NSCLC体外和体内的细胞增殖,CD73与miR-30a是否存在直接靶向关系有待进一步细胞实验验证。
综上所述,NSCLC的发生发展受多因素共同调控,miR-30a表达下调,CD73表达上调,二者表达水平与肿瘤分期、分化程度及淋巴结转移有关,是影响NSCLC患者预后不良的独立危险因素。CD73,miR-30a在NSCLC中的具体作用机制有待进一步体外实验证实。

