人教版高中化学《氧化还原反应》新旧教材对比分析
于梅 董平
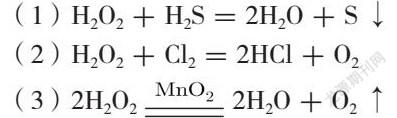
2019新教材人教版高中化学必修一第一章第三节《氧化还原反应》对应旧教材人教版高中化学必修一第二章第三节《氧化还原反应》。以下从课标的变化,教材的变化两方面对这一部分内容进行对比分析,同时对新教材的教学内容提几点建议。
一、课标的变化
旧课标内容标准是“根据实验了解氧化还原反应的本质是电子的转移,举例说明生产生活中常见的氧化还原反应”。新课程标准内容要求增加了以下几点:1.可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。2.知道常见的氧化剂和还原剂。新课标还增加了教学提示和学业要求两个环节。教学提示包括教学策略,学习活动建议,情境素材建议。本节教学策略包括以下几点:发挥核心概念对学习的指导作用、重视开展实验探究活动、紧密联系生产和生活实际,创设丰富多样的真实问题情境、鼓励使用多样化的教学方式和学习途径。学习活动建议相对于旧课标活动与探究建议增加了以下实验及探究活动:1.氧化还原反应本质的探究。2.过氧化氢的氧化性还原性的探究。情境素材建议:建议引用氧化还原理论建立的史料,日常生活中的氧化还原反应。情境教学在课堂上必不可少,可以激发学生的学习兴趣。学业要求是对高考生提出的要求,相对于内容要求,要求学生对知识理解更深入、更透彻。
二、新旧教材的变化以及教学建议
第三节氧化还原反应,开头新教材以问题形式导入,只有得氧或失氧的反应才是氧化反应或还原反应?氧化反应和还原反应是分别发生的吗?本质是什么?对于旧教材,除了多了一个科学史话介绍了氧化还原反应概念的发展,其他的在结构上并没有太大的变化。都是先从得氧失氧的角度,再从化合价升降的角度,然后从电子转移的角度三个层次来认识氧化还原反应。
第一课时,氧化还原反应。备课时可从用以下方式导入新课。给出四个化学反应方程式:镁和氧气生成氧化镁,铁和稀硫酸生成硫酸亚铁和氢气,氯酸钾受热分解生成氯化钾和氧气,三氧化二铁和一氧化碳高温条件下生成铁和二氧化碳。这四个反应属于同一类型的反应,这就说明他们具有相同的特点,即有元素价态发生改变。为什么要这样设计呢?因为同一类型的化学反应会表现出一些规律,掌握这些规律就能更好的理解、把握、推测这类化学反应,从而阐明从化合价角度认识化学反应的意义。在讲授氧化还原反应的本质电子转移时,同时介绍了双线桥和单线桥两种表示电子转移的表示方法以及氧化还原反应的守恒规律。与此同时还明确了元素的价态不能与所带的电荷划等号。例如氯化氢是由分子构成的,不含离子,而氯化钠是由钠离子和氯离子构成,这也从本源上解释了为什么有的电解质可以在融化状态下导电,而有些电解质在融化状态下不能导电。
第二课时,氧化剂和还原剂。这一课时的重点是理解相关概念间的联系,还原剂具有还原性,反应时自身被氧化,生成氧化产物。氧化剂具有氧化性,反应时自身被还原,生成还原产物。那么氧化性、还原性与元素所处的价态有什么关系呢?接下来可以引用了教材课后习题第11题,题目如下:
从氧化剂和还原剂的角度,分析下列三个反应中H2O2的作用。
(1)H2O2+H2S=2H2O+S↓
(2)H2O2+Cl2=2HCl+O2
(3)2H2O22H2O+O2↑
通过该习题,学生可以得出过氧化氢中的氧处于负一价,处于氧的中间价态,在化学反应时,氧元素的化合价既可以上升到零价态,又可以降低到负二价态,所以过氧化氢既有氧化性又有还原性,进而给同学们总结出一般情况下元素处于最高价态具有氧化性,处于最低价态具有还原性,处于中间价态既有氧化性又有还原性。在此基础上,可以从价态的角度总结常见的氧化剂和常见的还原剂。常见的氧化剂有部分非金属单质,如氧气、氯气、溴单质等;部分含最高价元素的物质,如浓硫酸、硝酸、高锰酸钾、氯化铁等;部分中间价态的物质,如次氯酸、过氧化氢、次氯酸钙、次氯酸钠等。常见的还原剂有金属单质,如铝、锌、铁等;部分非金属单质,如碳、氢气、硫等;含最低价元素的物质,如碘化氢、碘化钾、硫化氢、硫化钠、氨气等;部分中间价态的物质,如一氧化碳、一氧化氮、亚硫酸钠、亚硫酸氢钠、氯化亚铁等。化合价只能判断物质氧化性还原性的有无,无法判断其强弱,那么物质的氧化性和还原性强弱是由什么决定的呢?教师可以提供金属锂钠钾铷与水反应的实验视频,并提供四种金属原子结构示意图和原子半径的数据,同学们得出四种金属都有失去电子的倾向,结合实验视频比較四种金属与水反应的激烈程度,得出四种金属还原性的强弱。四种金属还原性的不同可以用元素周期律来解释,最后总结出物质的还原性与失电子的能力有关,推出物质的氧化性与得电子的能力有关。在此基础上归纳总结氧化还原反应的强弱规律和先后规律。
新教材在本节的最后加入思考与讨论环节,介绍了汽车尾气系统中安装的催化转化器。在催化转化器中,汽车尾气中的一氧化碳和一氧化氮在催化剂的作用下反应生成了二氧化碳和氮气。借此,教师要引导学生从科学、技术、社会、环境视角感受氧化还原反应的社会价值,形成 “绿色化学”的理念,体会化学对人类文明和社会发展的促进作用。

