干旱胁迫条件下水杨酸浸种对八蕊单室茱萸种子萌发和早期幼苗生长的影响
张永坤, 张珊珊
(1.勐海县林业和草原局技术推广服务中心, 云南 勐海 666200; 2.云南省林业和草原科学院, 云南省森林植物培育与开发利用重点实验室, 云南 昆明 650201; 3.云南省林业和草原科学院, 国家林业和草原局云南珍稀濒特森林植物保护和繁育重点实验室, 云南 昆明 650201)
种子萌发及幼苗形成是植物生命周期的关键时期,也是更新过程中最容易受到外界环境影响且最为敏感脆弱的时期[1]。种子萌发作为森林天然更新的关键环节,极易受水分因子的影响[2-5],进而影响到植物的生长和发育。随着全球气候变暖,干旱问题越来越突出[6],很多生境因为极度干燥和缺水,从而抑制了种子萌发和幼苗生长[7-9]。聚乙二醇(PEG)常被用来作为诱导剂模拟干旱胁迫,研究干旱导致的水分缺失对植物种子萌发和幼苗生长的影响[10-12]。已有研究表明,PEG可抑制多种植物的种子萌发,且随着浓度的增加,抑制程度随之加剧[13-15]。而水杨酸(Salicylic acid, SA)作为一种可提高环境胁迫下种子萌发率、促进幼苗生长及调节植物体内各种抗逆性生理生化指标的外源性物质[16-17],在水分胁迫条件下可稳定细胞膜的结构与功能,调节细胞内活性氧代谢等生理活动,进而增强抗逆性[18]。
八蕊单室茱萸(Mastixiaeuonymoides)为单室茱萸科(Mastixiaceae)单室茱萸属(Mastixia)落叶大乔木,主要分布在云南热区西双版纳和普洱[19]。该种分布区域狭窄,种群数量稀少,为云南省特有的极小种群野生植物[20],是极具开发前景的珍稀用材树种[21]。野外调查发现,八蕊单室茱萸现存10个天然种群,所有保存植株生长良好,但林下更新的幼苗极少,天然更新困难[22]。要解决八蕊单室茱萸种子萌发和幼苗生长困难问题,找到关键限制生态因子尤为重要。本研究以八蕊单室茱萸种子为试验材料,设置不同浓度的SA溶液浸种处理以及不同浓度的PEG 6000溶液模拟不同程度的干旱胁迫,研究SA溶液浸种对干旱胁迫下八蕊单室茱萸种子萌发及早期幼苗生长的影响,旨在了解其种子萌发和早期幼苗生长对干旱的响应,为给种群恢复与重建提供抗旱性较强的种苗提供科技支撑。
1 试验地概况
八蕊单室茱萸种子采集地位于云南省勐海县西定乡暖和村的天然林,海拔1450~1850m。该天然林位于热带山地中山雨林中,土壤类型主要为红壤和黄红壤。整个试验于云南省林科院国家林草局云南珍稀濒特森林植物保护和繁育重点实验室完成。
2 材料与方法
2.1 试验材料
云南省林科院和勐海县林草局研究团队于2019年11月采集八蕊单室茱萸种子并带到云南省林科院的重点实验室后,去除肉质外果皮,洗净坚硬内果皮,挑选籽粒饱满、大小一致的八蕊单室茱萸种子,先用10%浓度的H2O2对种子表面消毒20 min,然后用蒸馏水冲洗5~6次,晾干备用。试验用基质采用过2 mm筛的石英砂,在次氯酸钠中浸泡细砂24 h,自来水反复冲洗干净后于121 ℃高压灭菌锅固体灭菌60 min,烘干备用。试验处理所用PEG 6000购自上海生工生物工程股份有限公司,粉末状,易溶于水;SA为天津市光复精细化工研究所生产。
2.2 试验设计与方法
2.2.1 试验设计
本试验为双因子试验。其中,SA溶液浓度设置3个水平,即0、0.50和0.75 g·L-1;PEG 6000溶液浓度为4个水平,即0、10%、15%、20%。每处理6个重复,共用72个培养皿。
2.2.2 试验安排
将SA溶液用去离子水配置成浓度分别为0、0.50和0.75 g·L-1的处理液,再将之前表面已消毒的八蕊单室茱萸种子分别浸泡于不同浓度的SA溶液处理液中48 h。浸种后用蒸馏水冲洗干净备用。每个处理各取30粒种子均匀摆放在垫有2层滤纸的直径为9 cm的玻璃培养皿内,每一培养皿内加入不同浓度的PEG 6000溶液10 mL,以模拟不同程度的干旱胁迫。该试验在上海博迅BIC-400人工气候箱中进行。根据预试验结果,设置培养条件为光照12h、黑暗12 h、温度(25±1)℃、湿度(75±0.8)%。每天定时向每个培养皿加无菌水5mL,以保证培养皿内湿润。整个试验期限为30d(2020年3月1日至30日),在试验期间观测记录种子萌发情况,直至数据无变化后停止观测。
种子萌发试验结束后,将每个处理中长势一致的5株幼苗转移到塑料盆钵,规格为10 cm ×7 cm(直径×高度),每个盆钵提前装入500 g之前灭菌备用的石英砂。将所有盆钵转移到光照培养箱中,光周期设置为16 h光照与8 h黑暗,温度设置为光照下25 ℃、黑暗18 ℃,培养箱中相对湿度为90%。每7 d浇1次Hoagland营养液,维持植物正常生长。移苗1个月后,收获全部植株幼苗,分地上部分和地下部分测定其干重。
2.2.3 指标测定和计算方法
(1)发芽指标计算
种子开始萌发后,每天测定种子的萌发数(种子萌发以胚根突破种皮为标准)。
种子萌发率=(试验终期正常萌发的种子数/供试种子总数)×100%
(1)
种子发芽势=(种子发芽数达到高峰时的正常发芽种子数/供试种子数)×100%
(2)
发芽指数=∑(Gt/Dt)
(3)
式中:Gt表示第t天种子的发芽数,Dt表示相应的发芽天数。
(2)生物量测定
将地上部分和地下部分分别采样,放入烘箱115 ℃杀青30 min后,65 ℃烘48 h至恒定质量,称重,单位为mg。
2.3 数据统计分析
所有数据分析均采用SPSS 17.0软件完成。
3 结果与分析
3.1 SA溶液和PEG 6000溶液处理对八蕊单室茱萸种子萌发和早期幼苗生长的影响
SA溶液浸种处理和PEG 6000溶液模拟的干旱胁迫分别对八蕊单室茱萸种子萌发和早期幼苗生长的影响显著,其交互作用对种子萌发率和早期幼苗地上部分干重的影响都是显著的,但对发芽势、发芽指数和地下部分干重均无显著影响。相关方差分析见表1。

表1 八蕊单室茱萸种子萌发率及早期幼苗生长指标的方差分析Tab.1 Significant level of effects of factors and factor interactions on variables based on two-way ANOVA变量自由度萌发率发芽势发芽指数地上部分干重地下部分干重PEG 6000溶液浓度3∗(F=285.467)∗(F=27.580)∗(F=20.538)∗(F=156.149)∗(F=61.936)SA溶液浓度2∗(F=83.899)∗(F=14.928)∗(F=5.152)∗(F=27.395)∗(F=5.243)PEG 6000溶液浓度×SA溶液浓度6∗(F=2.997)ns(F=1.313)ns(F=1.438)∗∗(F=3.756)ns(F=1.075) 注: ∗表示在0.05水平上差异显著;∗∗表示在0.01水平上差异显著;ns表示差异不显著。
从表2可知,PEG 6000溶液浓度为0%时,随着SA溶液处理浓度的增加,八蕊单室茱萸种子的萌发率、发芽势和发芽指数都呈先升后降的变化。其中,SA溶液浓度为0.50 g·L-1时,效果最佳,说明较低浓度SA溶液浸种能有效促进种子萌发,而高浓度SA溶液则对种子萌发有抑制作用。生物量却表现出不一致的情况,其中地上部分干重随着SA浓度的提高而显著降低,但是在SA浓度为0和0.50 g·L-1两者间的差异不显著,而地下部分干重在3个不同的SA处理间无显著差异。
八蕊单室茱萸种子在受到干旱胁迫时,无论种子是否经过SA溶液浸种处理,种子萌发和早期幼苗生长指标的值均随着PEG 6000溶液浓度的增加而显著下降(P<0.05)。当PEG浓度为10%时,随着SA浓度的增加,八蕊单室茱萸种子的萌发率、发芽势和发芽指数,早期幼苗地上部分干重和地下部分干重都在SA浓度为0.50 g·L-1时达到最大值,而在0.50 g·L-1和0.75 g·L-1两种SA浓度处理间差异不显著;当PEG浓度为15%时,随着SA浓度的增加,除了发芽指数外,其余指标的变化趋势与 PEG浓度为10%时的一致;当PEG浓度为20%时,八蕊单室茱萸种子的萌发率、发芽势和发芽指数及早期幼苗地上部分干重和地下部分干重的值都在SA浓度为0.50 g·L-1时最高,其次为0.75 g·L-1的SA处理下的值,而在SA浓度为0 g·L-1时幼苗因干旱胁迫而全部死亡。

表2 SA溶液浸种处理对干旱胁迫下八蕊单室茱萸种子萌发和早期幼苗生长的影响Tab.2 Effects of seed soaking with salicylic acid on seed germination and early seedling growth of Mastixia euonymoidesSA溶液浓度/(g·L-1)PEG 6000溶液浓度/%萌发率/%发芽势/%发芽指数地上部分干重/mg地下部分干重/mg067.78±1.92 Ba67.78±5.09 Ba7.63±2.16 Ba70.33±10.12 Aa34.33±7.02 Aa01048.89±5.09 Bb48.89±3.85 Bb5.83±2.58 Bb43.33±4.16 Bb24.67±4.73 Bb1528.89±1.92 Bc28.89±5.09 Bc5.08±1.09 Ab31.33±6.66 Bc14.67±3.51 Bc200.00±0.00 Cd0.00±0.00 Cd0.00±0.00 Cc0.00±0.00 Cd0.00±0.00 Cd082.22±1.92 Aa82.22±5.09 Aa9.20±1.73 Aa77.33±6.66 Aa38.67±8.33 Aa0.51064.44±8.39 Ab64.44±6.67 Ab7.70±1.17 Ab62.33±3.51 Ab29.00±4.36 Ab1552.22±1.92 Ac52.22±5.09 Ac5.00±2.22 Ac42.67±4.04 Ac18.67±2.52 Ac2031.11±1.92 Ad31.11±6.94 Ad3.96±1.00 Ad26.33±8.39 Ad11.33±4.04 Ad063.33±6.67 Ba63.33±6.94 Ba6.33±1.53 Ba58.00±4.00 Ba35.00±6.24 Aa0.751051.11±5.09 Bb51.11±3.33 Bb4.67±2.08 Bb47.00±6.24 Bb22.33±5.86 Bb1531.11±3.85 Bc31.11±5.09 Bc2.81±1.05 Bc38.67±1.15 Bc11.67±1.53 Bc2011.11±5.09 Bd11.11±1.92 Bd1.79±0.26 Bd13.33±3.51 Bd9.23±2.85 Bc 注: 不同大写字母表示同一个干旱水平不同SA溶液浓度之间差异显著(P<0.05);不同小写字母表示同一种SA溶液处理水平不同PEG 6000溶液浓度之间差异显著(P<0.05)。
3.2 二元线性回归模型
基于表2的数据,分别选取各测量指标作为因变量,SA溶液浓度和PEG 6000溶液浓度作为自变量进行二元线性回归分析。基于SA溶液浓度和PEG 6000溶液浓度建立的二元回归分析见表3。由表3可知,建立的所有回归模型的回归效果极显著,且回归模型的各项回归系数及对回归系数的显著性检验表明各项系数均极显著。
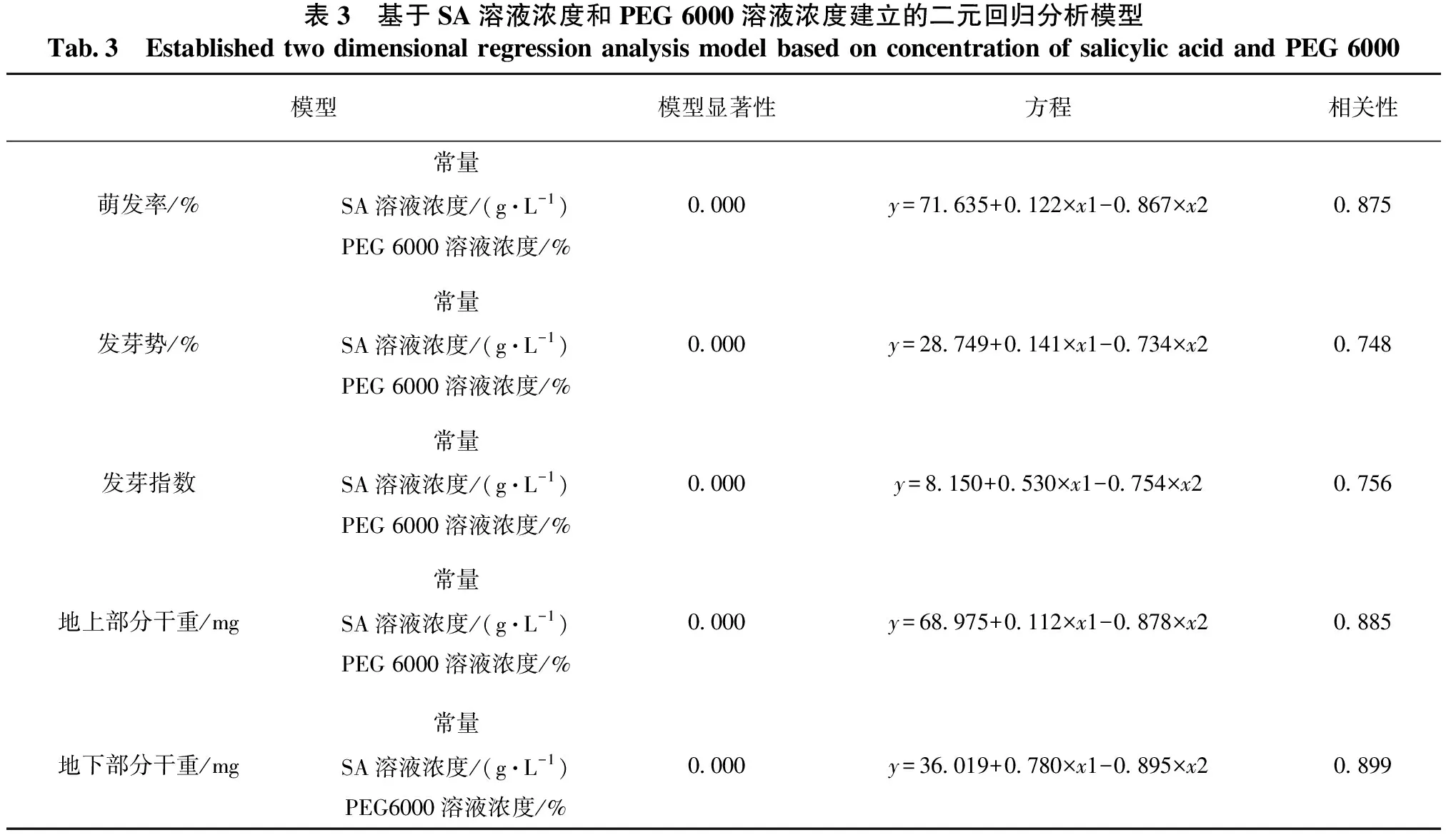
表3 基于SA溶液浓度和PEG 6000溶液浓度建立的二元回归分析模型Tab.3 Established two dimensional regression analysis model based on concentration of salicylic acid and PEG 6000模型模型显著性方程相关性常量萌发率/%SA溶液浓度/(g·L-1)0.000y=71.635+0.122×x1-0.867×x20.875PEG 6000溶液浓度/%常量发芽势/%SA溶液浓度/(g·L-1)0.000y=28.749+0.141×x1-0.734×x20.748PEG 6000溶液浓度/%常量发芽指数SA溶液浓度/(g·L-1)0.000y=8.150+0.530×x1-0.754×x20.756PEG 6000溶液浓度/%常量地上部分干重/mgSA溶液浓度/(g·L-1)0.000y=68.975+0.112×x1-0.878×x20.885PEG 6000溶液浓度/%常量地下部分干重/mgSA溶液浓度/(g·L-1)0.000y=36.019+0.780×x1-0.895×x20.899PEG6000溶液浓度/%
4 结论与讨论
种子萌发阶段是植物生长发育的重要阶段,是植物成长的基础,同时也是极为脆弱的阶段[23]。种子在萌发的过程中,往往会受到外界环境的影响[24],干旱胁迫作为影响植物生长发育的重要因子,是影响森林天然更新过程中种子萌发的重要生态因子之一[25-26]。PEG 6000溶液模拟的干旱胁迫可显著影响植物的种子萌发和幼苗生长[27-28]。本研究表明,PEG 6000溶液模拟的不同程度的干旱胁迫都显著抑制了八蕊单室茱萸的种子萌发和早期幼苗生长,且随着PEG 6000溶液浓度的提高,各项生长指标均显著下降。
适宜浓度的SA溶液处理可促进植物的种子萌发,过高浓度的SA溶液处理反而对种子萌发有抑制作用[29]。已有研究表明,极小种群野生植物云南蓝果树(Nyssayunnanensis)种子经适当浓度的SA溶液处理后,其种子萌发和幼苗生长指标都得到了显著提高[27-28]。本试验结果表明,八蕊单室茱萸种子经不同浓度SA溶液浸种处理后,其种子萌发和幼苗生长情况表现出同样的变化趋势;随着SA溶液浓度的升高,八蕊单室茱萸种子萌发和生物量指标均先升高后下降,并在浓度为0.50 g·L-1时表现最优。因此,适当浓度的SA溶液可促进八蕊单室茱萸的种子萌发。
SA溶液处理还可增强种子的耐逆境能力[30-32]。有研究发现,在干旱条件下,种子发芽率和发芽势均会降低[33],持续高强度的干旱胁迫还会显著地抑制幼苗的生长[34]。本研究表明,八蕊单室茱萸的种子萌发和幼苗生长都在干旱胁迫刚刚发生时便显著受到抑制,一定程度上证实了八蕊单室茱萸对水分胁迫的耐受性比较差。SA溶液浓度为0时,随着PEG 6000溶液胁迫浓度的增加,八蕊单室茱萸种子的萌发率、发芽势、发芽指数和生物量都呈显著下降趋势。SA溶液浸种处理后,在不同程度干旱胁迫条件下,八蕊单室茱萸种子萌发和生物量指标都比未经过SA溶液处理下的要高,且各指标值均随SA溶液浓度的增加而先升后降。可见,八蕊单室茱萸对干旱胁迫环境的耐受性较差,SA溶液的浸种处理可缓解干旱胁迫对其的影响,一定程度上增强其抗旱能力。
总之,八蕊单室茱萸对水分要求较高,抗旱能力较差,但是SA溶液浸种处理可一定程度上缓解干旱胁迫对八蕊单室茱萸种子萌发和早期幼苗生长的影响。建议育苗前先对其进行0.50 g·L-1的SA溶液浸种处理。本研究可为八蕊单室茱萸的育苗提供一定的科学依据,为下一步开展重引入和种群恢复重建培育抗旱能力较强的苗木提供一定的科技支撑。

