PEG—6000模拟干旱胁迫对福建山樱花种子萌发的影响
陈 钏, 唐 丽, 周晓星, 徐力兴, 盛世红, 许 琪,龚 维, 陆日惠
(1.中南林业科技大学林学院, 湖南 长沙 410004; 2.农业农村部规划设计研究院, 北京 100125; 3.岳阳市林业科学研究所, 湖南 岳阳 414000; 4.中南林业科技大学风景园林学院, 湖南 长沙 410004)
福建山樱花(Cerasuscampanulata)为灌木或乔木,树高3~8m。野生的福建山樱花一般生长分布在海拔100~600m的山谷中。福建山樱花早春开花,先花后叶,花色鲜艳,在华南、华东地区均有栽培,具有较强的观赏价值[1-2]。有限的抗旱能力是福建山樱花推广受限的主要原因之一,研究福建山樱花的抗旱机制并提高福建山樱花抗旱能力,对福建山樱花的推广种植至关重要。在植物的生长发育周期过程中,种子时期是起始阶段,影响着植物后期的生长和发育[3-6];而种子萌发通常易受干旱胁迫影响[7-10],因此,对植物种子萌发期进行抗旱性研究具有重要意义[11]。
本试验利用不同浓度PEG—6000作为土壤水分渗透调节剂模拟干旱胁迫[12-16],对福建山樱花种子的发芽进行了干旱抗性探索,初步探究了福建山樱花种子在不同程度干旱胁迫下的萌发情况,为福建山樱花的生产推广提供参考。
1 试验地概况
本试验地位于湖南省岳阳市岳阳楼区兰竹路55号岳阳市林业科学研究所实验室,地理坐标为113°08′17.65″E, 29°21′10.68″N。
2 材料与方法
2.1 试验材料
采自浙江省杭州市余杭区长乐林场,种子千粒重为120.95g,平均粒径5mm,平均粒长8.25mm,种子经低温层积处理后已处于发芽萌动期。
2.2 试验设计
本试验设置6个处理组浓度梯度,即PEG—6000浓度分别为0%(超纯水对照)、5%、10%、15%、20%和25%,即用天平分别称取PEG—6000溶质质量50、100、150、200、250 g溶于1000ml超纯水中配置成的PEG—6000。每个处理设置3 个重复。每个处理选用健康均匀的福建山樱花种子50粒,用70%酒精进行消毒后,立即用超纯水冲洗4~5次,时间8~12min,然后用超纯水浸泡12h左右。滤纸用烘干机进行干燥处理。试验所需的培养皿直径约12cm,用蒸馏水清洗干燥消毒后,铺双层滤纸作为种子发芽皿。将50粒福建山樱花种子均匀置于培养皿中,再分别加入不同浓度的PEG—6000 20ml,保证PEG—6000可以浸润所有福建山樱花种子,处理完成后将培养皿置于25℃恒温光培养箱中进行培养。
2.3 指标测定
2.3.1 福建山樱花种子的发芽势、发芽率、发芽指数、抗旱指数的测定
处理期间及时观察统计萌发的福建山樱花种子数量,种子萌发标准为种子的胚根长度超过种子本身长度,根据数据计算福建山樱花种子的发芽率、发芽指数、发芽势等发芽指标。公式如下:
发芽势(%)=(Gmax/N)×100%
(1)
发芽率(%)=(Gi/N)×100%
(2)
式(1)(2)中:Gmax表示发芽数量最多日每个培育皿内的福建山樱花种子发芽数;N表示每个培育皿内的福建山樱花种子数;Gi表示每个培养皿内的福建山樱花种子发芽数。
发芽指数=∑Gt/Dt
(3)
式中:Gt表示第t天每个培养皿内的福建山樱花种子发芽数;Dt表示对应的发芽天数。
2.3.2 福建山樱花种子可溶性糖、可溶性蛋白含量的测定
在发芽开始的第1天、第3天、第5天、第7天分别随机取样,每次在每个浓度的培养皿中随机选取发芽的福建山樱花种子15颗,测定其可溶性糖、可溶性蛋白含量,分别采用蒽酮比色法[17]和考马斯亮蓝法[18]。
2.4 数据处理
数据的统计和分析软件为Excel 2016和SPSS 20.0,采用Duncan法进行差异显著性检验,用Excel 2016软件作图。
3 结果与分析
3.1 PEG—6000胁迫对福建山樱花种子发芽势和发芽指数的影响
发芽势代表着发芽初期比较集中的发芽率,发芽势决定着出苗的整齐程度,种子的发芽势越高,则出苗越整齐。发芽指数是种子的活力指标,发芽指数越高则表示种子的活力越高。不同浓度PEG—6000胁迫下的福建山樱花种子的发芽势和发芽指数见表1。由表1可知:不同浓度PEG—6000胁迫下的福建山樱花种子,在发芽过程中其发芽势、发芽指数间存在极显著差异;随着PEG—6000浓度的上升,福建山樱花种子的发芽势和发芽指数呈现先上升后下降的趋势,当PEG—6000浓度为5%时,福建山樱花的发芽势和发芽指数最高,分别为48.24%、6.79,但随着PEG—6000浓度的继续上升,福建山樱花种子的发芽势和发芽指数逐渐下降,当PEG—6000浓度达到25%时,福建山樱花的发芽势由48.24%降至12.39%,发芽指数由6.79降至2.15。结果表明:5%浓度的PEG—6000胁迫福建山樱花种子,对其发芽整齐度和种子活力具有促进作用;10%~25%浓度的PEG—6000胁迫下,福建山樱花种子发芽势与发芽指数显著下降,严重抑制福建山樱花种子萌发。
3.2 PEG—6000胁迫对福建山樱花种子发芽率和总发芽率的影响
不同浓度PEG—6000胁迫下的福建山樱花种子发芽率如图1所示。由图1可知:福建山樱花种子发芽开始于处理的第3天,处理的第3、4天发芽率较低,发芽高峰期在第5天,到处理的第9天时,福建山樱花的发芽率达到最大值,第10天开始基本停止发芽;不同浓度PEG—6000胁迫下的福建山樱花种子的发芽率不同,在5%浓度PEG—6000胁迫下,福建山樱花种子的发芽率均高于对照组,在10%~25%浓度PEG—6000胁迫下,福建山樱花种子的发芽率随溶液浓度的上升呈下降趋势。
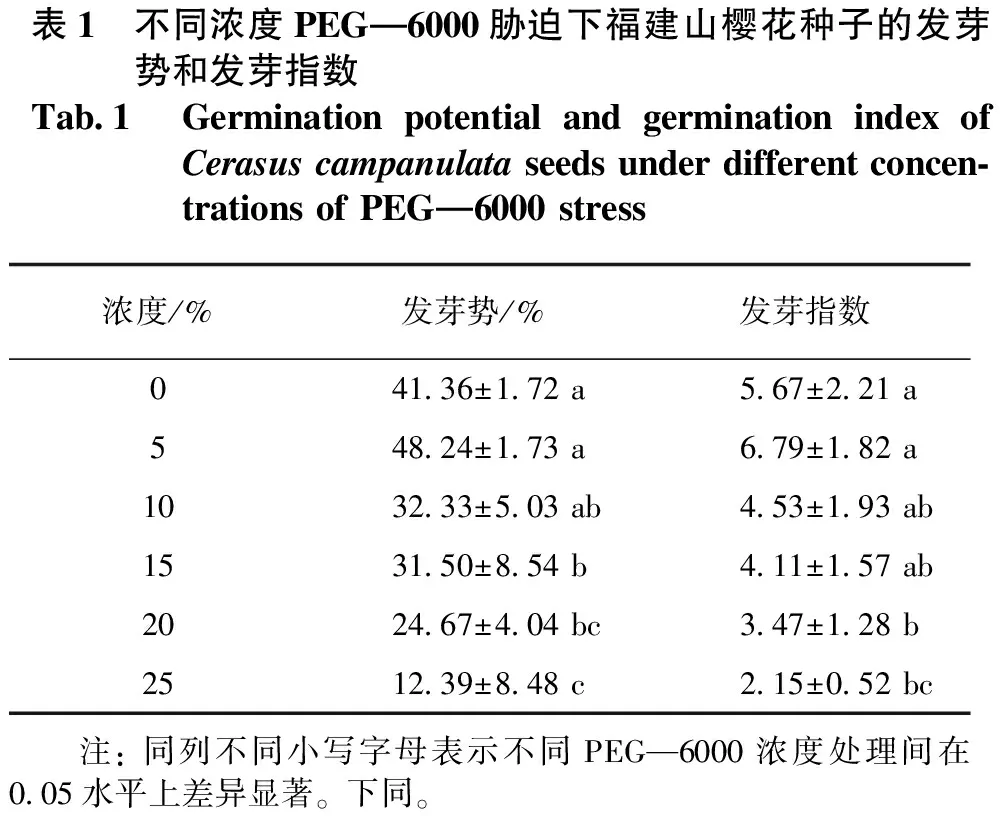
表1 不同浓度PEG—6000胁迫下福建山樱花种子的发芽势和发芽指数Tab.1 Germination potential and germination index of Cerasus campanulata seeds under different concen-trations of PEG—6000 stress浓度/%发芽势/%发芽指数041.36±1.72 a5.67±2.21 a548.24±1.73 a6.79±1.82 a1032.33±5.03 ab4.53±1.93 ab1531.50±8.54 b4.11±1.57 ab2024.67±4.04 bc3.47±1.28 b2512.39±8.48 c2.15±0.52 bc 注: 同列不同小写字母表示不同PEG—6000浓度处理间在0.05水平上差异显著。下同。
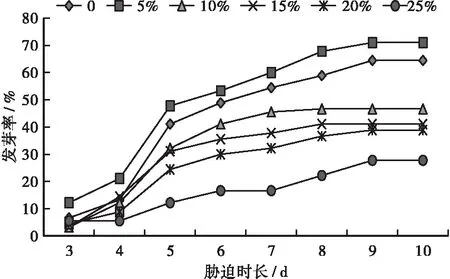
图1 不同浓度PEG—6000胁迫下的福建山樱花种子的发芽率Fig.1 Germination rate of Cerasus campanulata seeds under different concentrations of PEG—6000 stress
如图2所示:在用不同浓度PEG—6000处理福建山樱花种子后,福建山樱花种子的总发芽率呈先上升后下降的趋势。在5%浓度PEG—6000的胁迫下,福建山樱花种子的总发芽率相比于对照组上升了5.56%;当PEG—6000浓度为25%时,福建山樱花种子的总发芽率由71.00%降至27.78%。
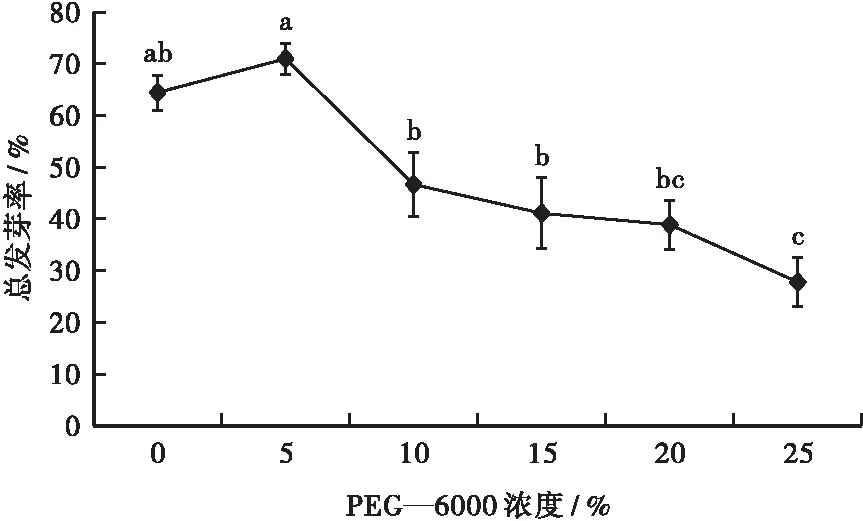
注: 不同小写字母表示处理间差异显著(P<0.05)。图2 不同浓度PEG—6000胁迫下福建山樱花种子总发 芽率Fig.2 Total germination rate of Cerasus campanulata seeds under different concentrations of PEG—6000 stress
3.3 不同时间及不同浓度PEG—6000胁迫对福建山樱花种子可溶性糖含量的影响
如图3所示:胁迫的第1天,福建山樱花种子可溶性糖含量趋势平缓,各处理组间福建山樱花种子可溶性糖含量差异不显著,说明处理开始时,PEG—6000浓度对福建山樱花种子的影响不显著;胁迫的第3天,福建山樱花种子可溶性糖含量随着PEG—6000浓度的增加呈先上升后下降的趋势,当PEG—6000浓度为10%时,可溶性糖含量最高,当PEG—6000浓度为25%时,可溶性糖含量低于对照组水平,说明在低浓度PEG—6000胁迫下,激活了福建山樱花种子的抗逆性机制,加速了种子内可溶性糖的转化,而在高浓度PEG—6000胁迫下,会显著抑制种子可溶性糖的转化;胁迫的第5天,对照组福建山樱花种子可溶性糖含量相较于第3天有所上升,PEG—6000浓度为5%、10%、15%的处理组福建山樱花种子可溶性糖含量相较于第3天大幅下降,且呈递降趋势,PEG—6000浓度为25%的处理组福建山樱花种子可溶性糖含量显著上升;胁迫的第7天,福建山樱花种子可溶性糖含量随着PEG—6000浓度的增加而降低,且PEG—6000浓度为20%、25%的处理组福建山樱花种子可溶性糖含量已经低于胁迫第1天对照组福建山樱花种子的可溶性糖含量水平,说明持续的不同浓度PEG—6000胁迫,会显著抑制福建山樱花种子内部的可溶性糖转化,从而抑制种子萌发。
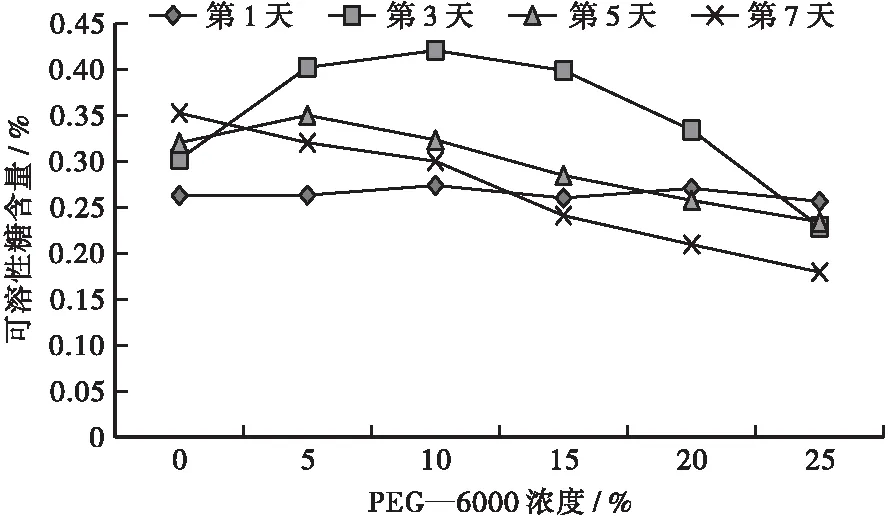
图3 不同浓度PEG—6000胁迫下福建山樱花种子可溶性糖含量变化Fig.3 Changes of soluble sugar content in Cerasus campanulata seeds under different concentrations of PEG—6000 stress
3.4 不同时间及不同浓度PEG—6000对福建山樱花种子可溶性蛋白含量的影响
如图4所示:胁迫的第1天,福建山樱花种子可溶性蛋白含量趋势平缓,各处理组间福建山樱花种子可溶性蛋白含量差异不显著;胁迫的第3天,PEG—6000浓度为15%、20%、25%的处理组福建山樱花种子可溶性蛋白含量显著下降,且呈递减趋势,对照组福建山樱花种子的可溶性蛋白含量略微下降,其他处理组福建山樱花种子的可溶性蛋白含量没有发生显著变化,说明在中高浓度PEG—6000胁迫下,激活了种子的抗逆性生理机制,抑制了种子可溶性蛋白的转化;胁迫的第5天,PEG—6000浓度为5%、10%的处理组福建山樱花种子可溶性蛋白含量显著下降,且呈递减趋势,PEG—6000浓度为15%、20%、25%的处理组福建山樱花种子可溶性蛋白含量上升到了与对照组同等水平,说明随着胁迫时间延长,低浓度PEG—6000开始抑制福建山樱花种子可溶性蛋白的产生;胁迫的第7天,各处理组间福建山樱花种子可溶性蛋白含量差异回归平稳趋势,且较处理第1天均有一定的上升。说明持续干旱胁迫下,随着胁迫时间延长、胁迫程度加剧,使得福建山樱花种子的可溶性蛋白合成在某个时间段受到抑制,但同时也会激活福建山樱花种子的抗逆性机制,调节种子自身内源物质合成来逐渐适应外部胁迫环境。
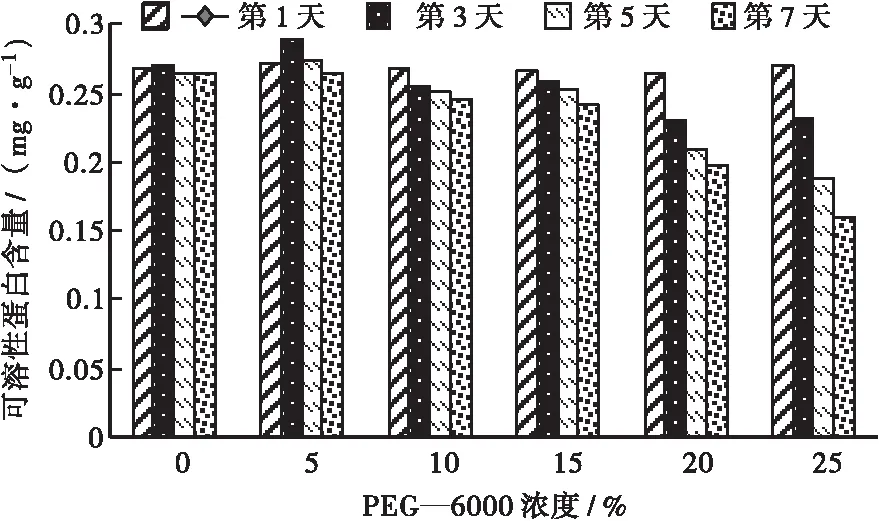
图4 不同浓度PEG—6000胁迫下福建山樱花种子可溶性蛋白含量变化Fig.4 Changes of soluble protein content in Cerasus campanulata seeds under different concentrations of PEG—6000 stress
4 结论与讨论
不同浓度PEG—6000模拟干旱胁迫是通过对渗透压的调节达到阻碍水分进入福建山樱花种子内部,对福建山樱花种子的萌发指标均有显著影响。当PEG—6000浓度为5%时,福建山樱花种子的发芽率、发芽势、发芽指数均高于对照组水平,这与韦秋思等[19]对云南松种子萌发的研究一致。当PEG—6000浓度高于5%时,福建山樱花种子萌发指标随着PEG—6000浓度的升高而降低,说明高浓度的PEG—6000会对种子造成破坏,从而抑制种子的发芽。
渗透调节是植物适应水分胁迫的一种生理机制,是体现植物抵御逆境胁迫能力的主要组成部分。有相关研究发现,植物在受到干旱胁迫时,细胞内一些具有保护作用的渗透调节物质会迅速积累,如可溶性蛋白质、可溶性糖。通过不同浓度PEG—6000对福建山樱花种子可溶性糖含量及可溶性蛋白含量的影响数据可以看出:干旱胁迫会显著影响福建山樱花种子的渗透调节物质的转化;可溶性糖含量上升是因为低浓度PEG—6000刺激萌发的福建山樱花种子中淀粉加速分解的结果;可溶性糖含量降低是因为高浓度的PEG—6000抑制淀粉分解的结果;可溶性蛋白含量降低表明萌发的福建山樱花种子可能启动了本能的抗逆机制,低浓度PEG—6000胁迫表现为可溶性蛋白分解加速,可溶性蛋白含量逐渐降低,这与呼凤兰等[20]的研究结果相同。
以上试验结果表明:福建山樱花种子具备一定的抗旱性,在5%浓度PEG—6000胁迫下,种子的发芽率、活力、发芽整齐度上升,种子的抗逆机制被激活,加速种子内淀粉的分解以及蛋白质的转化,从一定程度上促进种子萌发。

