缓释氧材料对沉积物中磷组分和微生物活性的影响
钱嘉辰,曾楚涵,杨禄姣,王先兵,邓佳炜,彭海山,刘文莉
(台州学院 建筑工程学院,浙江 台州 318000)
0 引言
水体富营养化导致了藻类及其他浮游生物的快速生长和繁殖,使溶解氧水平下降,水体出现变黑发臭[1]。富营养化和黑臭现象主要与水中DO含量低、磷浓度高有关[2]。因此,增强水体溶解氧水平,减少磷含量是使水环境维持在相对健康状态的重要措施。水体复氧通常采用水体表面曝气及沉积物表面曝气两种机械曝气方式[3],但水体表面曝气迅速产生的大量氧气,不能全部被水体利用,同时产生的氧气较难向底泥扩散,不能为底泥提供稳定长期的供氧,不利于底泥中好氧微生物的生长。而沉积物表面曝气会使沉积物受到扰动而释放原本固定在其中的部分污染物,造成二次污染,并会影响到上覆水的透明度,且曝气孔易堵塞,设备维护和运行也需投入相对多的资金[4]。
磷是导致河水富营养化的主要限制因素[5]。随着我国环境污染治理及管理力度的增强,河流外部磷的输入得到有效控制,但沉积物内部磷的释放成为导致水质恶化、影响水体生态环境的主要因素[5]。一些不同的机制可能会诱导水体内部磷的释放,如溶解氧(DO)值、pH值等物理化学因素以及生物因素[6]。因此,控制好沉积物内部磷的释放,对于水体修复的成功至关重要。
过氧化钙(CaO2)与水反应形成过氧化氢,可以氧化沉积物中的有机物(式(1))。同时,Ca(OH)2在沉积物表面形成了一个物理屏障,阻止了沉积物中内源性磷的释放(式(2))。另一方面,CaO2释放的氧气(式(2)(3)),增加了水体和沉积物-水界面的DO水平,可以促进内源磷向稳定态磷如磷酸钙(Ca-P)的转化[7-9]。
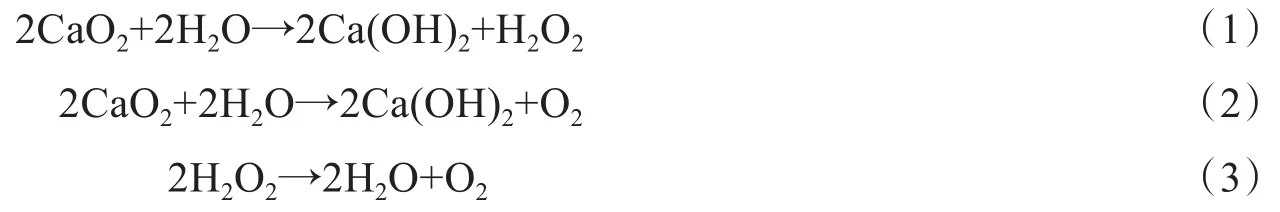
与强力机械曝气相比,CaO2释氧效率高,曝气方式温和,气泡体积小,简便易行,无二次污染和能耗,近年来逐渐引起人们的重视[4]。但CaO2作为释氧剂存在一些问题:CaO2与水接触时,会因为释放氧气过快而失去释氧能力,同时快速释氧形成的高氧条件对某些生物有害,这不利于维持水体自净过程中的微生物对溶氧稳定长期的需求[3]。而且,CaO2作为一种碱性化合物,能够与水反应生成OH-,使溶液中的pH值升高,从而使微生物活性发生改变,影响生物修复进程[10-11]。
为解决上述问题,一些研究者在 CaO2中加入 KH2PO4和(NH4)2SO4[12]、NH4Cl[13]以中和 OH-,维持微生物所需pH值在5~8.5的最佳范围,或加入其他材料改善释氧速度[7,14]。Zhou等[7]将CaO2直接与硬脂酸和不可降解石英混合制作缓释氧材料,用于废水活性污泥的生物修复和控制水中的总磷。Huang等[14]应用含有CaO2和斜发沸石的被动渗透活性屏障(PRB)成功去除了地下水中的NH4+-N。Zhang等[15]用CaO2固体石蜡原位去除地下水的锰。目前CaO2的研究大多用于地下水和土壤的供氧修复,缓释氧化合物对于地表水沉积物中磷的形态和微生物酶活性的影响的相关研究仍较少。本文使用CaO2、钠膨润土、河砂和水泥混合制备缓释氧化合物(OSRC),并研究其对水中DO值和pH值的影响、沉积物中磷组分产生的变化及沉积物中微生物活性的改变。
1 材料和方法
1.1 缓释氧化合物的制备
过氧化钙(CaO2,纯度99%)、钠膨润土购自天津科密欧化学试剂有限公司。河砂(粒径为1~2 mm)、硅酸盐水泥(P.S.A32.5)均由台州开元建材有限公司提供。实验中使用的所有其他试剂均为分析纯,购自阿拉丁试剂(上海)有限公司。
将CaO2粉碾碎,过150 μm筛(100目),然后与钠膨润土、水泥和河砂按75:1:16:8的重量比进行混合,并在混合物中加入15 mL水;将所得混合物制成150个直径约1.5 cm的OSRC小球(每个小球重量约0.7 g)(如图1所示),采用高锰酸钾滴定法测定出每粒OSRC小球中CaO2的含量约为0.5 g[16]。

图1 OSRC制备示意图
1.2 水中的DO值和pH值
在3种不同条件下测定300 mL试剂瓶中水的DO值和pH值。第一组,仅含300 mL蒸馏水,为空白对照组;第二组,含300 mL蒸馏水+0.5 g CaO2粉末;第三组,含300 mL蒸馏水+一个OSRC小球(含约0.5 g CaO2)。在实验前,每个试剂瓶中各加入0.5 g亚硫酸钠,以使DO值低于0.5 mg·L-1。在不同的时间检测水中的DO含量和pH值。
1.3 沉积物和水样
2020 年 7 月,在台州学院校园内的心湖(北纬 28°39′36″,东经 121°23′18″)采集水和沉积物样品。台州学院位于浙江省东南沿海地区,属中亚热带季风区,气候温和湿润。心湖是面积约为8000 m2的小型湖泊,平均深度为1.5 m。首先从0.5 m深度将湖水泵入塑料容器中收集;然后在同一位置用不锈钢抓斗采集0~10 cm处底泥样品;当所有样品被送到实验室后,将约130 mL的湿沉积物和150 mL的湖水加入300 mL试剂瓶中,密封,室温下置于黑暗处保存10 d,以使DO含量低于0.5 mg·L-1。10 d后,将一个OSRC小球直接人工投加到试剂瓶中,相当于75 g OSRC·m−2沉积物表面[4],对照组不添加OSRC。每个处理重复3次。
1.4 化学分析
分别在第0、3、6、10 d采集上覆水和沉积物样本。通过虹吸法将试剂瓶中的上覆水移取到取样瓶中,然后用50 mL的注射器插入沉积物中,收集0~2 cm深度的沉积物样本。测定上覆水总磷(TP)含量以及沉积物中不同形式的磷、菌落形成单位(CFU)、底物诱导呼吸作用(SIR)和酶活性。
溶解氧含量和pH值分别用美国YSI 550A溶氧仪和Hanna 211 pH测量仪测定;上覆水TP采用过硫酸盐氧化法测定[17];沉积物中的总磷(TP)、无机磷(IP)、有机磷(OP)、NaOH-P(Fe/Al-P、P 与 Al、Fe、Mn结合的氧化物和氢氧化物)以及HCl-P(Ca-P、磷与磷灰石的结合物)按照欧洲委员会的标准程序SMT测定[18];底物诱导呼吸、蛋白酶、脲酶和脱氢酶活性采用文献[19]的方法测定。
1.5 数据分析
实验结果以平均值和标准差来表示。采用SPSS16.0统计软件进行单因素方差分析(one-way ANOVA)。用于检验不同处理之间的差异(LSD,P=0.05)。
2 结果与讨论
2.1 OSRC修正剂对水中pH值和DO值的影响
三组处理水中pH值和DO浓度的变化如图2所示。加入CaO2粉末的第二组溶液初始pH值为7.3,48 h达到最大值11.2,实验期间溶液的平均pH值为10.2;加入OSRC的第三组溶液pH值最高升至11,随后逐渐降低至8.5,之后保持不变(如图2a所示)。两种处理后溶液的pH值均显著高于第一组(对照组)(P<0.05)。从实验结果可知,第三组溶液的pH值低于第二组,尽管CaO2与水反应时会生成Ca(OH)2,但OSRC中的河砂可作为pH缓冲剂控制pH值的剧烈变化[20]。

图2 三组溶液中pH值和DO值的变化
经CaO2粉末处理后的溶液DO值在5 h后显著升高至12.2 mg·L-1,但随后迅速降低,150 h后,溶液的DO值与对照组无明显差异(如图2b所示,P>0.05);OSRC处理后溶液DO值逐渐升高至4 mg·L-1左右,并保持恒定至实验结束(如图2b所示)。Vezzulli等[21]发现,一些缓释氧化合物的有效释氧效率可长达6个月甚至1年。本文中的OSRC具备成为稳定供氧源的能力,但其持久能力还需要在更长的时间内进一步观察。
2.2 OSRC处理对上覆水和沉积物中磷浓度的影响
2.2.1 对上覆水总磷浓度的影响
与对照组相比,经OSRC处理后第10 d,上覆水中的总磷(TP)浓度显著下降(如图3所示,P<0.05),其原因可能是:OSRC的加入使得上覆水中的DO值增加,水中的Fe2+被DO氧化为铁的氢氧化物(例如FeOOH)并与磷反应生成沉淀进入到沉积物中[22],导致上覆水中的磷被去除。但随着DO值的降低,这种形式的磷可能会再次从沉积物中被释放转移到上覆水中[1]。

图3 上覆水中总磷浓度的变化
2.2.2 沉积物中磷组分的变化
磷(P)是导致水体富营养化的主要限制性因素,沉积物中磷的形态决定了磷的保留或释放,因为并非所有形式的磷都是可供生物利用的[23]。当实验中加入OSRC后,经处理,沉积物中NaOH-P、HCl-P、无机磷IP和有机磷OP的变化如图4所示。
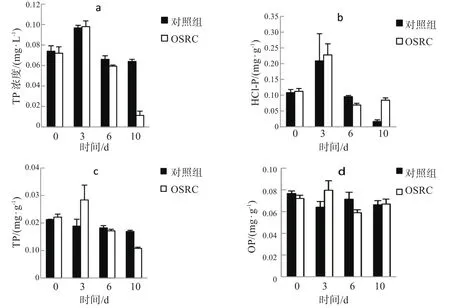
图4 沉积物中NaOH-P、HCl-P、IP和OP的变化
NaOH-P是潜在的可生物利用P形式,包括与Al,Fe和Mn氧化物和氢氧化物结合的P[18],在较低的氧化还原电势或较高的pH值条件下,这种形态的P很容易从沉积物中释放出来[24]。经OSRC处理后,NaOH-P含量在第3d达到峰值,然后逐渐下降(如图4a所示),第10dNaOH-P含量为0.0113 mg·L-1;而没有添加OSRC的NaOH-P约为0.064 mg·L-1。NaOH-P一部分受pH的影响,导致部分NaOH-P的迁移[25]。另一方面,水中的 Fe2+可以被H2O2和DO氧化生成FeOOH,与P一起沉淀到沉积物中,导致NaOH-P的增加[22]。因此,两种作用的净结果是:随着OSRC的加入沉积物中的NaOH-P含量降低。但当DO下降时,FeOOH会转化为Fe2+重新释放出来,引起水体二次污染。
HCl-P是钙结合化合物中的组成部分,通常称为磷灰石,被视为一种非生物利用的稳定形式[26]。在本研究中(如图4b所示),加入OSRC后,前6dHCl-P含量先升后降,从0.2277 mg·L-1下降至0.0687 mg·L-1,第10d又逐渐升高到0.0843 mg·L-1,高于对照组。这是由于添加OSRC后产生了Ca(OH)2,磷会与Ca(OH)2结合从而提高 HCl-P 的含量[1,27]。
无机磷IP的主要形式为:①被交换位点吸附的部分,称为松散结合P,不稳定P或可交换的P,该部分易于释放,有利于藻类生长。②NaOH-P。③HCl-P[18]。加入 OSRC 后,IP 在第 3d最高为 0.284 mg·L-1,第10d降至0.108 mg·L-1(如图4c所示)。从图4可知,无机磷主要由HCl-P组成。相比之下,对照组中HCl-P的含量较少,NaOH-P的含量较多(P<0.05),这表明加入OSRC后沉积物中IP的主要组成从NaOH-P变为HCl-P。Hu等[28]发现滇池富营养化较为严重,相应的沉积物中潜在的可生物利用的有效P(NaOH-P)更多,而生物不可利用形态的P(HCl-P)较少。
有机磷OP的构成组分较复杂,主要以单酯及二酯的形式存在,易受到沉积物内微生物的影响,而微生物对外界条件变化如溶氧变化的响应有一定延迟。OSRC处理对沉积物中OP含量的影响较小(P>0.05)(如图4d所示)。
总之,通过测定沉积物中磷的形态组成可知,经OSRC处理后,总磷的主要组成成分是无机磷,而HCl-P是构成无机磷的主要组成成分,如图5所示,说明OSRC的加入使稳定态HCl-P含量增加,有利于控制沉积物中磷的释放。
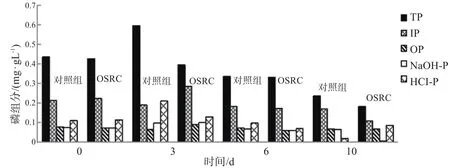
图5 沉积物中磷组分的变化
2.3 OSRC处理法对微生物量和酶活性的影响
微生物量在土壤中起到营养物质的矿化和循环作用。OSRC加入后细菌平均密度比对照组高出一个数量级(如图 6a所示,P<0.05),从 3.3×104CFU mL-1升高至 4.7×105CFU mL-1。基质诱导呼吸 SIR 值略高于对照组(如图6b所示),这表明OSRC处理提高了沉积物中的微生物量和活性。
通常,酶活性是生物氧化还原系统的指标,可以作为衡量土壤中微生物代谢强度的指标[29]。OSRC的添加对沉积物的物理化学环境产生影响,从而改变微生物群落的活性。
脱氢酶一般活跃在所有完整的和活的微生物细胞中,通常与微生物存在量及其氧化能力有关,因此脱氢酶活性被认为是对整体微生物活性的一种度量[17]。与对照组相比,脱氢酶含量在第3d呈升高趋势,第6d略有下降,然后在第10d开始出现较大增长(如图6c所示,P<0.05)。研究发现,通过加入不同剂量的盐酸或氢氧化钠溶液,酸性环境会抑制脱氢酶活性,而碱性则促进脱氢酶的活性[30]。本文也观察到加入OSRC后,脱氢酶活性随水pH值的升高而增加。
脲酶催化尿素水解为二氧化碳和铵盐,并广泛分布于环境中[17]。与对照相比,加入OSRC后,脲酶活性在第6d和第10d明显增加(如图6d所示,P<0.05)。有研究证实,脲酶活性取决于pH值,其最适宜pH条件是碱性环境[31]。本文中OSRC加入后的溶液pH值约为8.3,适合脲酶活化。
蛋白酶主要来源于土壤异养细菌,另外多种放线菌和真菌也能够产生蛋白酶[32]。在实验过程中,经OSRC处理后的蛋白酶活性始终高于对照组(如图6e所示,P<0.05)。此处给出的结果与王涵等[33]报道的结果一致,说明pH值的升高促进了蛋白酶活性的增加。
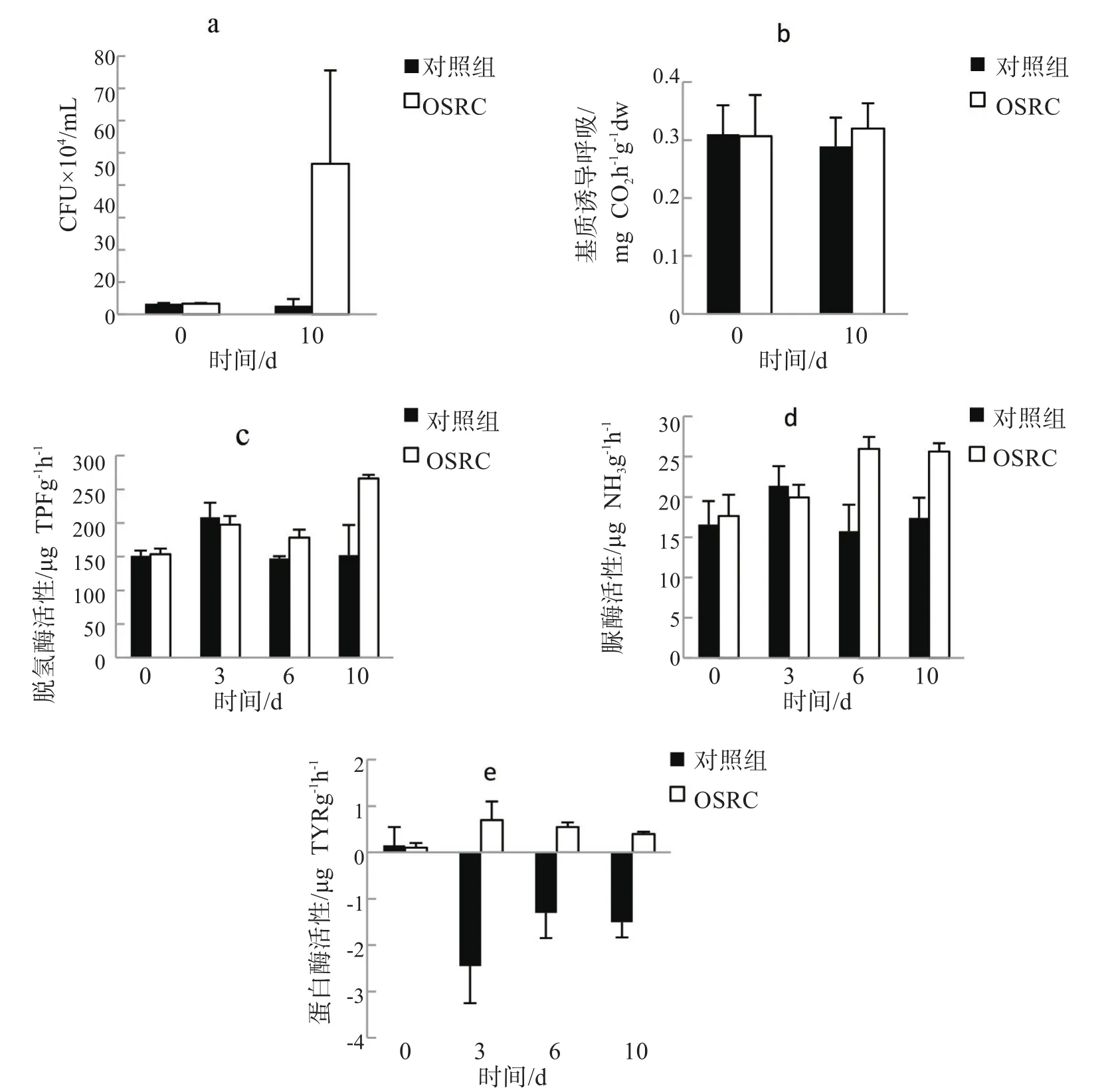
图6 沉积物中CFU、基质诱导呼吸、脱氢酶、脲酶、蛋白酶的变化
3 结语
本文的研究结果证实:①OSRC具有作为稳定的氧气供应源的能力,并可以提高上覆水中总磷(TP)的去除率。②添加OSRC后,底泥中IP的主要组成从有效磷(NaOH-P)变为不可用磷(HCl-P),对水中可生物利用的磷形态的降低有积极影响。③OSRC通过提供氧气和合适的pH值可以改善脱氢酶、脲酶和蛋白酶的微生物活性。此结果将有助于更好地了解OSRC处理法对于水生生态系统修复的效率及其影响。

