高考热点
——溶液中离子浓度的大小比较
黄生芳 周立芳
(1.海南省琼海市嘉积中学 571400;2.海南师范大学 571127)
溶液中离子浓度的大小比较是历年高考的重点内容,也是日常教学中研究的热点问题,涉及化学中的微粒观、变化观、守恒观,是学生学习中的难点内容.大部分学生的思维障碍主要集中在宏微分离且不会表示,发现变化但不善于抓住变化中的守恒关系.如何帮助学生运用一定认知模型分析此部分的内容,并做到思路清晰,结果判断不出错呢?笔者根据教学经验,提出“一原理、二理论、三守恒”的认知模型.
1 模型解析
1.1 “一原理”
原理即化学反应原理.要想理解溶液中微粒间的浓度大小,前提是找出溶液中存在的各种微粒,而想要准确判断溶液中微粒的种类,前提条件是准确分析溶液中溶质的成分.对于已知的单一溶液,学生能迅速判断溶质,如醋酸溶液的溶质为CH3COOH、氨水的溶质为NH3·H2O、氯化铵溶液的溶质为NH4Cl,而混合溶液则需要根据溶质间的化学反应进行溶质成分分析.如:
①将等浓度等体积的NaOH溶液与HCl溶液混合:在此体系中,氢氧化钠与盐酸发生化学反应(化学方程式如下),生成等物质的量的氯化钠,此时溶液的溶质则不再是NaOH、HCl而是NaCl.
②将物质的量之比为1∶1的HCl溶液与Na2CO3溶液混合:在此体系中,HCl与Na2CO3发生化学反应,化学方程式如下,生成碳酸氢钠与氯化钠,此时溶液的溶质是碳酸氢钠与氯化钠而不仅只是氯化钠.

③向20mL 0.1mol/L CH3COOH溶液中滴加0.1mol/L NaOH溶液,滴定曲线如图1所示.
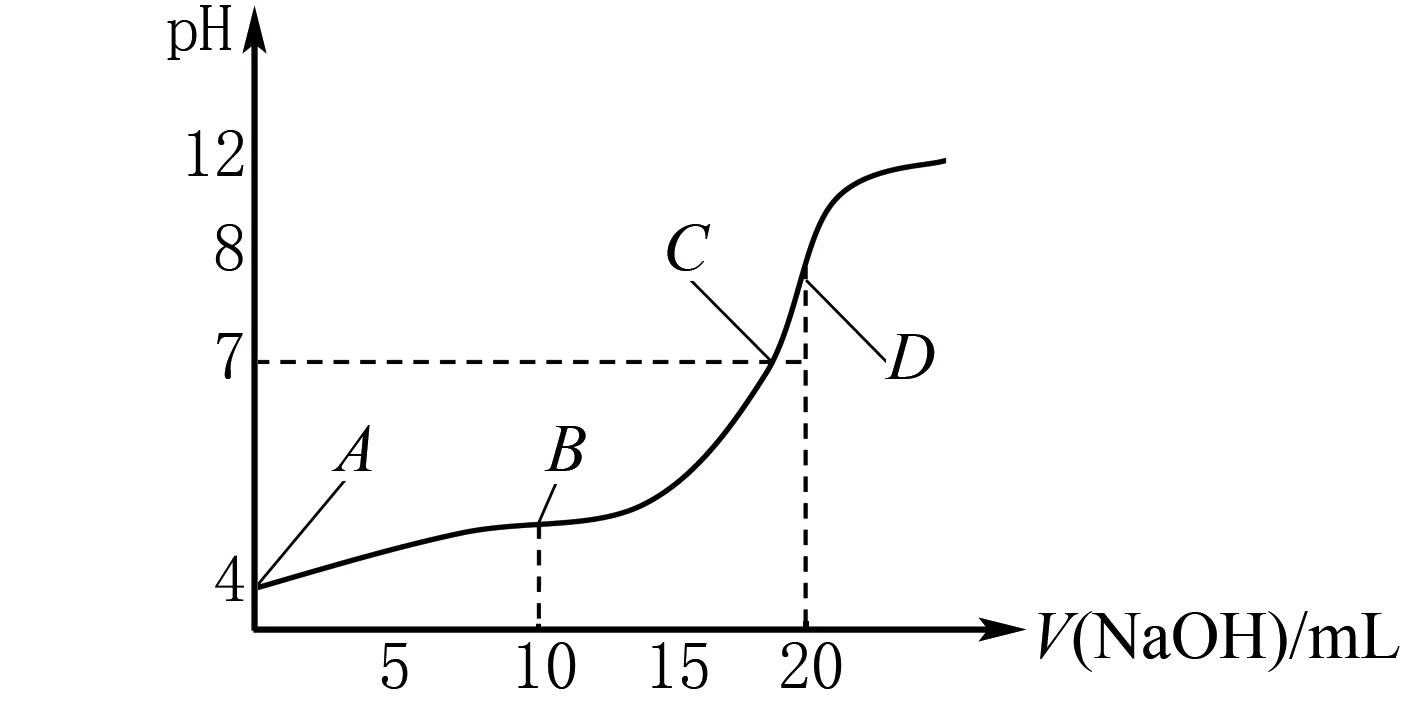
图1
点A时溶液中未加入氢氧化钠,此时溶质为CH3COOH;点B时加入了10mL 0.1mol/L的NaOH溶液,此时氢氧化钠与醋酸按1∶1的比例发生化学反应,生成等浓度的CH3COONa,同时溶液中还剩下一半的CH3COOH未参与反应,因此,此时溶液对应的溶质为CH3COONa、CH3COOH两种物质,且两者物质的量浓度之比为1∶1;点C时,溶液pH=7,呈中性,由于醋酸为弱酸,且由图1可知,此时溶液中还存在醋酸分子,此时溶液中的溶质依旧是CH3COONa、CH3COOH两种物质,但醋酸钠的物质的量浓度大于醋酸的物质的量浓度;点D时,加入20mL 0.1mol/L NaOH溶液,两者恰好完全反应,因此溶液中的溶质为CH3COONa.
1.2 “二理论”
理论即电离理论与水解理论,弱电解质在水溶液中会发生电离(微弱),弱酸的阴离子(弱碱的阳离子)则会结合水中的氢离子(氢氧根)生成弱电解质(微弱),从而影响离子的浓度.如:

(1)NH4Cl溶液


(2)NH4HSO4溶液
a: NH4HSO4电离:

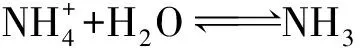
(3)氨水
a:NH3·H2O电离:

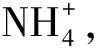
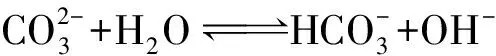
案例2 0.1mol/L Na2CO3溶液中离子浓度大小关系.
a:碳酸钠在水溶液中电离:

c:碳酸根离子的水解:

案例3 0.1mol/L NaHCO3溶液.
a:碳酸氢钠在水溶液中电离:
b:碳酸氢根离子电离:
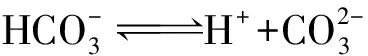
c:水自身电离:

d:碳酸根离子水解:

案例4 0.1mol/L NaHSO3溶液.
a:亚硫酸氢钠在水溶液中电离:
b:亚硫酸氢根离子电离:
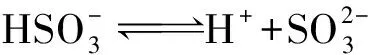

d:亚硫酸根离子水解:

1.3 “三守恒”
“三守恒”即电荷守恒、物料守恒、质子守恒.利用守恒可以判断溶液中的等量关系,在具体应用判断时还需关注不同守恒关系式的结构特点.
1.3.1 电荷守恒
电解质溶液总是呈中性的,因此溶液中阳离子所带正电荷数等于阴离子所带的负电荷数.如:
(1)Na2CO3溶液
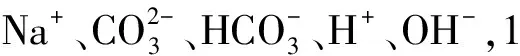

(2)CH3COONa溶液
该混合溶液中存在的离子为Na+、CH3COO-、H+、OH-,因此,该溶液的电荷守恒为:

1.3.2 物料守恒(元素守恒)
在电解质溶液中,某些离子发生水解或电离可能引起某些元素的存在形式发生变化,但变化前后各元素的原子个数保持不变(不考虑氧元素和氢元素).如:
(1)0.1mol/LNa2SO3溶液
亚硫酸钠溶液在水溶液中完全电离:
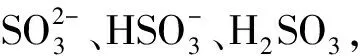
(2)0.1mol/LNaHSO3溶液
亚硫酸氢钠在水溶液中电离:
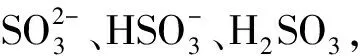
(3)等浓度Na2SO3溶液、NaHSO3溶液混合
同理可得:
c(Na元素)/c(S元素)=3/2
即:2c(Na元素)=3c(S元素)
1.3.3 质子守恒
水电离出来的氢离子和水电离出来的氢氧根的浓度相等.质子守恒等式较为复杂,一般不让学生直接书写,而是通过电荷守恒与物料守恒叠加得到.如:
(1)Na2CO3溶液存在如下等量关系:
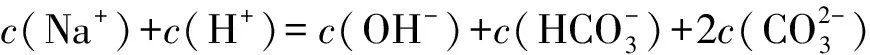
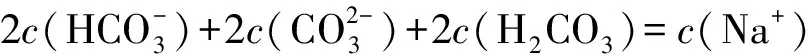
(2)NaHCO3溶液存在如下等量关系:
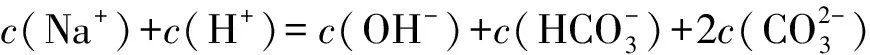

1.4 小结
“一原理”即根据化学反应原理,准确分析溶液中溶质的成分.“二理论”即根据电离理论与水解理论判断各离子在水溶液中的行为.“三守恒”即根据电荷守恒、物料守恒、质子守恒判断溶液中的等量关系.
2 模型应用
例1 常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图2所示,下列说法正确的是( ).
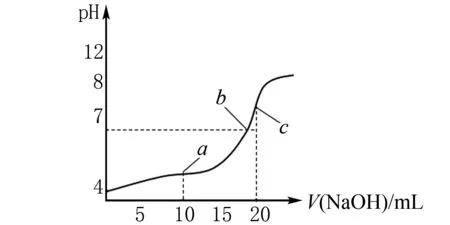
图2
A.点a所示溶液中:
c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点b所示溶液中:
c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点c所示溶液中:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
例2 向2L 0.1mol/L的NaOH溶液中通入448mL(标准状况)CO2,所得溶液离子浓度大小正确( ).
例2 用物质的量都是0.01mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-) A.c(H+)>c(OH-) B.c(OH-)>c(H+) C.c(HCN)=c(CN-) D.c(HCN)+c(CN-)=0.02mol/L 答案:例1 D;例2 D;例3 A

