PVP包覆纳米Fe3O4对U(Ⅵ)的吸附
谢汶级,李 佳,王辛龙,任 萌,周显明
1.中国核动力研究设计院 核燃料及材料国家级重点实验室,四川 成都 610041;2.四川大学 化学工程学院,四川 成都 610065
核能作为一种可再生能源,得到了世界各国大力开发和广泛利用,但在核能开发过程中会产生大量含铀废水。铀元素具有重金属化学毒性和放射性辐射双重危害,含铀废水的不当排放不仅会造成铀资源的浪费,还会沿食物链被生物吸收、蓄积,最终造成在人体积累和慢性中毒,危害生态环境和人类健康[1-3]。国内外已有大量关于含铀废水处理的研究报道,主要方法有化学沉淀法[4]、离子交换法[5-6]、膜分离法、电化学法[7]、微生物法、植物修复法、蒸发浓缩法与吸附法等[8-9]。其中吸附法在核工业应用最为广泛,常用的吸附剂有活性炭与硅胶等,这些吸附剂均具有吸附容量低、用量大、无法处理有机废液与会产生难以处理的二次放射性固体废物等缺点,这些缺点极大地限制了吸附法处理含铀废液的发展。
纳米Fe2O3是一种成本低、高比表面积、强吸附能力、强磁性、易于分离的重金属离子吸附剂和高级氧化催化剂,双重属性使之有应用于处理重金属有机废液的潜力。已有的研究表明,纳米Fe2O3能有效去除Pb2+、Hg2+、Cd2+、Cu2+、Cr(Ⅵ)与U(Ⅵ)等重金属离子[10-11]。近年来,采用溶胶凝胶法制备的α-Fe2O3开始应用于核领域铀元素的吸附,吸附率均在95%以上,表明纳米Fe2O3能够用于含铀废水的吸附处理[12-13]。此外,各类改性纳米氧化铁也不断应用于含铀废水处理领域。2012年,Fan等[14]用二氧化硅包覆纳米Fe3O4粉末对U(Ⅵ)进行吸附研究,其吸附容量达到52.0 mg/g,且该吸附剂能够用HCl再生循环利用。2020年,Zeng等[15]将羟基磷灰石掺杂纳米Fe3O4作为吸附剂用于U(Ⅵ)的吸附研究,该吸附剂对U(Ⅵ)的最大吸附容量高达789.6 mg/g。碳包覆纳米Fe3O4具有提升纳米Fe3O4稳定性与吸附容量的优点,并开始被用于吸附领域。有报道以聚丙烯酰胺(PAM)为碳源包覆纳米Fe3O4对U(Ⅵ)进行吸附研究,结果表明PAM包覆纳米Fe3O4的饱和吸附容量为220.9 mg/g,显著优于纳米Fe2O3[16]。2021年,Xiang等[17]成功将聚乙烯吡咯烷酮(PVP)包覆纳米Fe3O4用于亚甲基蓝的吸附与降解,证明了PVP包覆纳米Fe3O4能够提高纳米Fe3O4的吸附容量与纳米Fe3O4的稳定性。酰胺基团是一种对U(Ⅵ)具有较强配位作用的功能基团,酰胺类萃取剂是铀萃取领域不可或缺的一类高性能萃取剂,PVP是一类具有酰胺基团的高分子化合物,暂未见其用于U(Ⅵ)的吸附研究报道,也未见PVP包覆纳米Fe3O4(Fe3O4@PVP)用于U(Ⅵ)的吸附研究报道。
本工作拟利用Fe3O4@PVP材料的高U(Ⅵ)吸附容量与易于磁性分离的双重优点,开展Fe3O4@PVP为吸附剂吸附U(Ⅵ)的研究,获取不同参数对吸附效果的影响、吸附模型、吸附动力学与热力学数据,旨在为吸附法处理含铀废水提供一种高吸附容量低二次污染的高性能吸附剂,并为含铀有机废液的吸附法处理提供数据支撑。
1 实验部分
1.1 试剂和仪器
铀标准溶液(1 000 mg/L)、乙二胺四乙酸二钠溶液(EDTA-2Na,0.05 mol/L),硝酸(HNO3)、氯化钾(KCl)、氨水(NH3·H2O)、盐酸(HCl)、偶氮胂Ⅲ均为市售分析纯,上述试剂均来自阿拉丁试剂有限公司;硝酸铀酰溶液,自制;实验用水为去离子水。Fe3O4@PVP磁性纳米材料为四川大学王辛龙老师提供,颗粒粒径约为30 nm,碳层厚度约为2 nm,碳层由PVP与无定型碳构成[17],磁性吸附性能优异,具体效果示于图1。
FE28型精密酸度计,精度为0.01,上海梅特勒-托利多仪器有限公司;TU-1900型紫外分光光度计,北京普析通用仪器有限责任公司;XYJ80-2 离心沉淀机,江苏医疗仪器厂。
1.2 铀浓度分析
铀浓度采用偶氮胂Ⅲ分光光度法测定,具体流程如下:取一定量的铀标准溶液于10 mL容量瓶中,加入0.5 mL 0.1 mol/L 盐酸溶液调节pH值至2.0~2.5,然后依次加入2 mL 0.05 mol/L EDTA-2Na溶液作为掩蔽剂和2 mL 500 mg/L偶氮胂Ⅲ显色溶液,用水稀释至刻度,摇匀。用1 cm比色皿,以试剂空白为参比,在分光光度计上于652 nm处测定吸光度。
1.3 吸附实验
向50 mL容量瓶中加入一定浓度的硝酸铀酰溶液,用硝酸、氨水溶液调节溶液pH至适当值,定容,加入10 mg不同种类碳包覆纳米Fe3O4粉末,放入恒温水浴中静态吸附,吸附完成后离心取上层清液,过滤后取样用紫外分光光度计测量吸光度,并计算溶液中U(Ⅵ)的平衡浓度。每组吸附实验均设置不添加吸附剂的空白实验,以避免器壁、铀水解带来的干扰。根据溶液铀浓度按照式(1)可计算纳米Fe3O4@PVP对U(Ⅵ)的吸附容量。
qe=(ρ0-ρe)V/m
(1)
式中:qe,平衡吸附容量,mg/g;ρ0,铀初始质量浓度,mg/L;ρe,铀平衡质量浓度,mg/L;V,溶液体积,L;m,吸附剂质量,g。
1.4 吸附动力学与扩散模型
采用准一级吸附模型、准二级吸附动力学模型与扩散动力学模型评价Fe3O4@PVP吸附U(Ⅵ)过程中吸附时间与吸附容量的关系以及扩散过程,具体模型分别如式(2)—(4)。
准一级吸附动力学模型:
1/qt=k1/(qet)+1/qe
(2)
准二级吸附动力学模型:
(3)
扩散模型:
qt=Kdift1/2+ε
(4)
式中:qt,t时刻Fe3O4@PVP吸附U(Ⅵ)的吸附容量,mg/g;k1,准一级吸附动力学速率常数,min-1;k2,准二级吸附动力学速率常数,g/(mg·min);Kdif,吸附过程内扩散速率常数, mg/(mg·min1/2);ε,无量纲常数,与边界层厚度成正比,mg/g。
1.5 吸附等温线与吸附热力学研究
吸附等温线将用于描述Fe3O4@PVP吸附U(Ⅵ)过程中U(Ⅵ) 平衡浓度与Fe3O4@PVP饱和吸附容量的关系,实验采用Langmuir等温线、Freundlich等温线、Redlich-Peterson等温线与Temkin等温线拟合,四种等温线计算公式分别为式(5)—(8)。
Langmuir模型:
qe=qmaxKLρe/(1+KLρe)
(5)
Freundlich模型:
(6)
Redlich-Peterson模型:
(7)
Temkin模型:
qe=Aln(Bρe)
(8)
式中:qe,平衡吸附容量,mg/g;qmax,预估吸附剂最大吸附容量,mg/g;ρe,平衡铀质量浓度,mg/L;KL,Langmuir等温线吸附平衡常数,L/mg;KF,Freundlich常数,(mg·g-1)(mg·L)1/n;β,无量纲常数;n,吸附剂的异构性参数,表示吸附系统的结合能;KR与aR表示Redlich-Peterson等温线特征常数,L/mg;A,Temkin常数;B,平衡结合常数,L/mg。
热力学数据是评价温度对吸附影响的直接依据,采用Arrhenius方程计算Fe3O4@PVP吸附U(Ⅵ)过程中的焓变ΔH,以lnK与1/T作图获得一直线,然后根据直线的斜率和截距可分别计算出Fe3O4@PVP吸附U(Ⅵ)过程的焓变ΔH和熵变ΔS,计算如式(9)—(11)。
吸附平衡常数:
K=qe/ρe
(9)
Arrhenius方程:
lnK=-ΔH/(RT)+ΔS/R
(10)
吉布斯自由能:
ΔG=-RTlnK
(11)
式中:K,吸附平衡常数,L/g;ΔH,焓变,J/mol;ΔS,熵变,J/(mol·K);ΔG,吉布斯自由能,J/mol;R,热力学常数,J/(mol·K)。
2 结果与讨论
2.1 溶液pH值对吸附的影响
对Fe3O4@PVP进行Zeta电位测定,Zeta电位曲线示于图2(a),再以Fe3O4@PVP作为吸附剂,采用HNO3与氨水(NH3·H2O)溶液调节溶液初始pH值,分别设置pH=2.00、3.00、4.00、5.00、6.00、7.00、8.00等7组溶液开展实验,吸附达平衡后进行pH值检测,结果表明吸附平衡后溶液pH值变化微小,平衡后pH值分别为2.02、3.11、4.08、5.12、6.09、6.97、7.88,平衡pH值与Fe3O4@PVP对铀酰离子的吸附容量关系示于图2(b)。
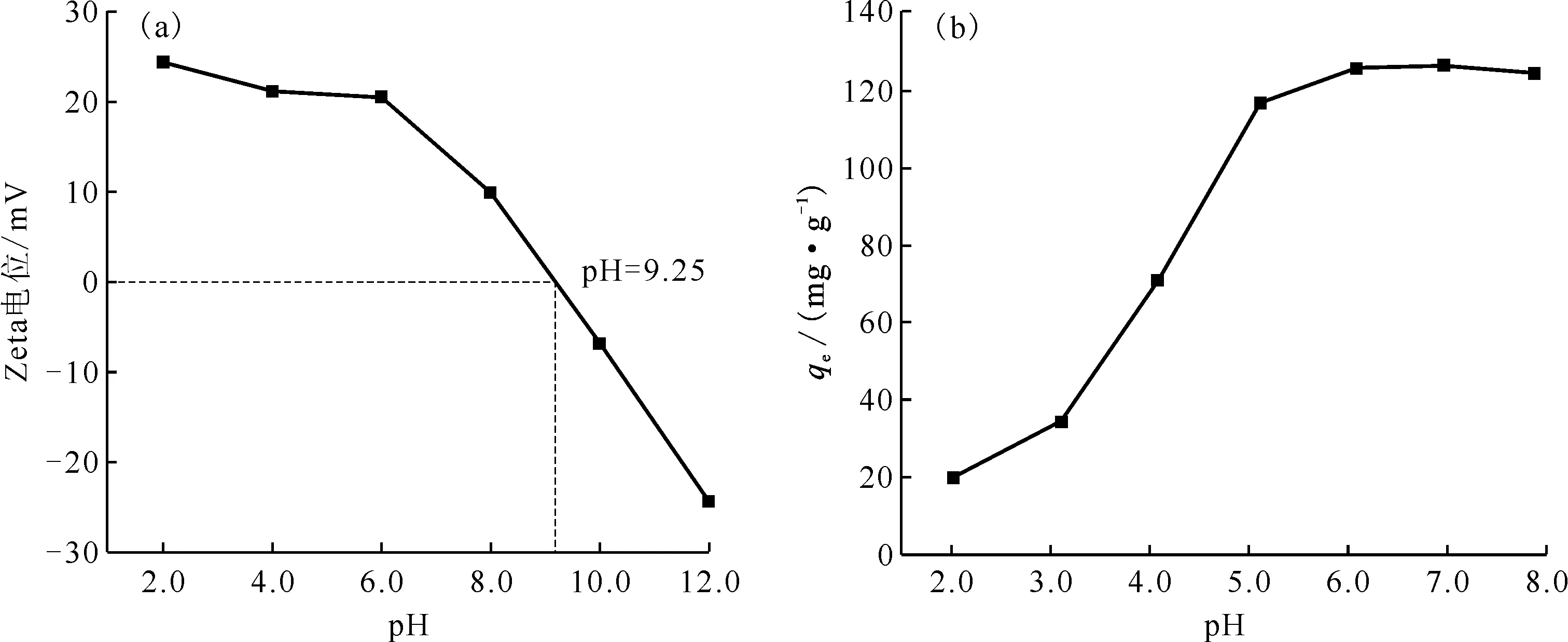
ρ0=50 mg/L,20 ℃,固液比为0.2 g/L,t=120 min图2 Fe3O4@PVP的Zeta电位曲线(a)和不同pH值对Fe3O4@PVP吸附U(Ⅵ)的影响(b)Fig.2 Zeta potential curve(a) of Fe3O4@PVP and effect of pH value on adsorption of U(Ⅵ) onto Fe3O4@PVP(b)

2.2 初始铀浓度与吸附剂加入量对吸附的影响
溶液初始铀浓度和吸附剂加入量与Fe3O4@PVP吸附铀酰离子息息相关,在20~40 ℃,研究初始铀浓度和吸附剂加入量(5~90 mg)对铀吸附的影响,其他条件为优选条件,结果示于图3。由图3可知:吸附剂加入量一定时,随着初始铀浓度的增加,Fe3O4@PVP吸附容量逐渐增加,且增加速率不断放缓,最后达到饱和;初始铀浓度一定时,随着吸附剂加入量增加,铀吸附率不断增加并达到平衡。这是因为初始铀浓度增加,不断在Fe3O4@PVP表面活性吸附位点发生吸附与脱附,但总吸附位点数目一定,最后达到吸附、脱附平衡,故吸附容量先增加最后达到饱和,吸附剂加入量增加,活性吸附位点增加,吸附率增加。根据曲线预估20~40 ℃时,Fe3O4@PVP吸附U(Ⅵ)的饱和吸附容量约为160~300 mg/g,最终单次铀吸附率均大于75%。
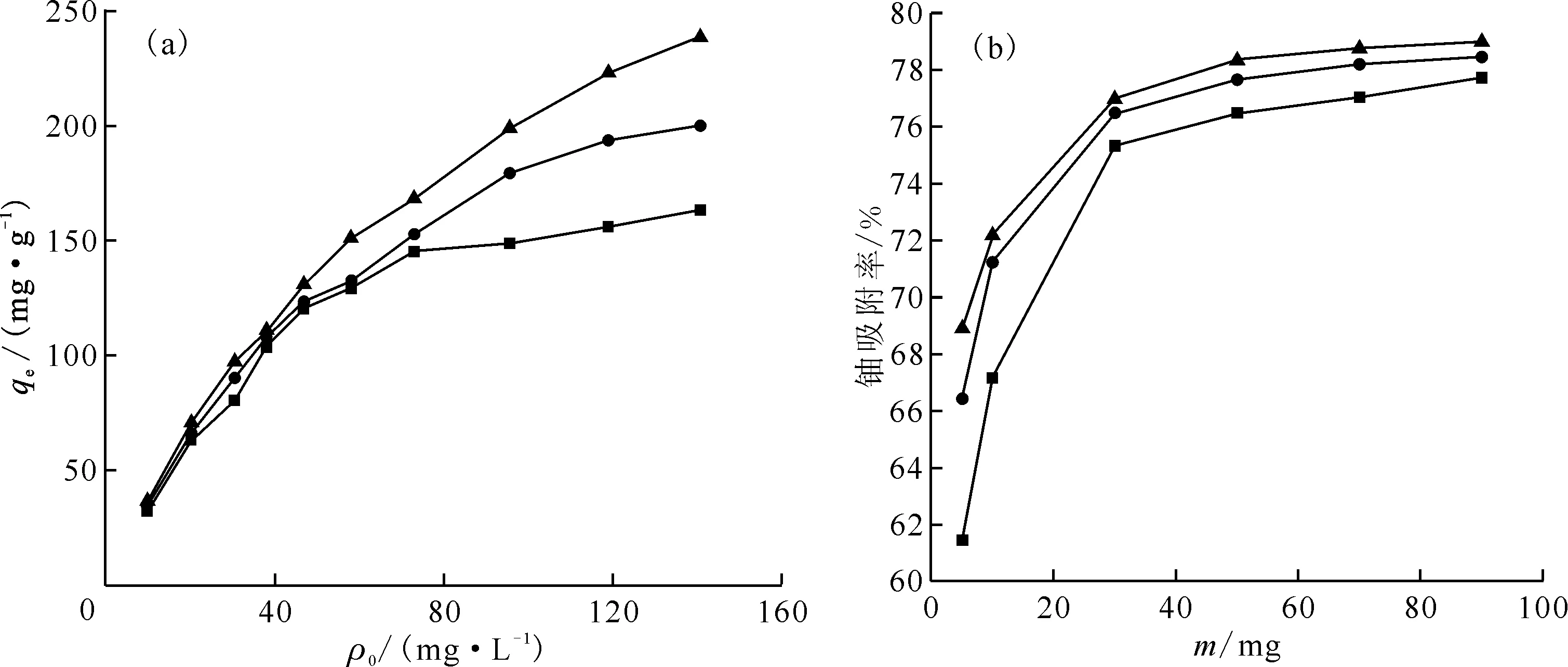
pH=6.00,t=120 min ■——20 ℃,●——30 ℃,▲——40 ℃(a)——m=10 mg,(b)——ρ0=50 mg/L图3 初始铀浓度(a)与吸附剂加入量(b)对Fe3O4@PVP吸附U(Ⅵ)的影响Fig.3 Effect of initial U(Ⅵ) concentration(a) and adsorbent dosage(b) on adsorption of U(Ⅵ) onto Fe3O4@PVP
2.3 温度对吸附的影响
吸附温度是影响吸附速率与吸附容量的重要参数。初始铀质量浓度为9.7~96 mg/L、pH=6.00时,研究初始铀浓度与吸附温度对Fe3O4@PVP吸附U(Ⅵ)的影响,结果示于图4(a)。由图4(a)可知,升温能够极大促进铀酰离子在Fe3O4@PVP表面的吸附,增加吸附速率,减少到达吸附平衡的时间。因为温度的升高加快铀酰离子在溶液中的移动速率,增大了其与Fe3O4@PVP吸附位点的有效碰撞几率,这表明升温能够显著提高吸附效率。不同初始铀浓度下绘制Arrhenius曲线示于图4(b)。由图4(b)可知,Arrhenius曲线斜率小于0,即ΔH⊖>0,证明此吸附过程为吸热过程,这与图4(a)结论一致。

(a)——pH=6.00,m=10 mg,t=120 min,ρ0,mg/L:●——96,△——79,▽——58,◆——47,▼——38,▲——30,○——20,■——9.7;(b)——pH=6.00,固液比为0.2 g/L,t=120 min,ρ0,mg/L:■——10,□——20,◇——30,○——40,◆——50图4 吸附温度对Fe3O4@PVP吸附U(Ⅵ)的影响(a)与Fe3O4@PVP吸附U(Ⅵ)的Arrhenius曲线(b)Fig.4 Effect of adsorption temperature on adsorption of U(Ⅵ) onto Fe3O4@PVP(a) and Arrhenius curves of U(Ⅵ) adsorption onto Fe3O4@PVP(b)
2.4 离子强度对吸附的影响
离子强度会影响吸附剂表面的双电层结构,这对明晰Fe3O4@PVP吸附U(Ⅵ)的机理至关重要,且实际含铀废液中也存在不同形式的盐,也会具有不同的离子强度。本研究采用KCl作为离子强度调节剂,设置5组离子强度(50、70、90、120、150 mg/L),研究离子强度对Fe3O4@PVP吸附U(Ⅵ)的影响,结果示于图5。由图5可知:随着离子强度的增加,Fe3O4@PVP对U(Ⅵ)的吸附率在逐渐减少,这表明离子强度的增加诱使Fe3O4@PVP表面双电层结构发生变化,导致Fe3O4@PVP与U(Ⅵ)的吸附作用削弱或Fe3O4@PVP表面的活性位点数目减少,从而抑制了Fe3O4@PVP对U(Ⅵ)的吸附作用,这也验证了Fe3O4@PVP对U(Ⅵ)的吸附由酰胺配位和静电吸附的双重作用[18]。

pH=6.00,40 ℃,ρ0=50 mg/L,t=120 min图5 离子强度对Fe3O4@PVP吸附U(Ⅵ)的影响Fig.5 Effect of ion strength on adsorption of U(Ⅵ) onto Fe3O4@PVP
2.5 吸附热力学研究
将U(Ⅵ)溶液在20~40 ℃下的吸附数据按照公式(9)—(11)进行热力学拟合与计算,具体拟合结果示于图4(b)并列入表1。由图4(b)和表1可知,铀初始质量浓度为10~50 mg/L的标准吸附焓变ΔH⊖为5.82~17.63 kJ/mol,对应的标准吸附吉布斯自由能ΔG⊖为-4.04~-2.79 kJ/mol,表明Fe3O4@PVP吸附U(Ⅵ)是一个吸热过程,升温促进吸附,且该吸附过程是自发过程。

表1 Fe3O4@PVP吸附U(Ⅵ)的热力学参数Table 1 Thermodynamic parameters of U(Ⅵ) adsorption on Fe3O4@PVP
2.6 吸附动力学研究
吸附时间是评价吸附效果的重要指标,在20~40 ℃下开展吸附实验,按照式(2)—(4)绘制吸附曲线、动力学拟合曲线和动力学数据分别列入表2并示于图6。

■——20 ℃,●——30 ℃,▲——40 ℃ρ0=50 mg/L,pH=6.00,固液比0.2 g/L图6 不同温度下Fe3O4@PVP吸附U(Ⅵ)的动力学曲线(a)、扩散模型曲线(b)、准一级动力学曲线(c)和准二级动力学曲线(d)Fig.6 Kinetic curves(a), diffusion model curves(b), pseudo-first adsorption kinetics curves(c), pseudo-secondary adsorption kinetics curves(d) of U(Ⅵ) adsorption on Fe3O4@PVP at different temperatures

表2 不同温度下Fe3O4@PVP吸附U(Ⅵ)的动力学数据Table 2 Kinetic parameters of U(Ⅵ) adsorption on Fe3O4@PVP at different temperatures
吸附曲线显示,在20、30、40 ℃时,吸附达到平衡的时间分别为60、30、5 min;动力学数据表明,Fe3O4@PVP吸附U(Ⅵ)过程更接近准二级吸附动力学模型,线性相关系数r2为0.997 2~0.999 7;当温度分别为20、30、40 ℃时,准二级吸附速率常数分别为0.000 646、0.001 839、0.012 500 g/(mg·min),说明温度越高吸附反应速率越快,升温能促进吸附反应。通过扩散曲线可知吸附容量qt和t1/2之间的函数关系由多条线段组成,则说明该吸附过程可能是由边界层扩散和内扩散来共同控制[17]。
2.7 吸附等温线
吸附等温线能够预估不同温度下Fe3O4@PVP吸附U(Ⅵ)的饱和吸附容量,分别在20、30、40 ℃下进行不同浓度U(Ⅵ)溶液的吸附实验,并根据式(5)—(8)四种等温线模型拟合,拟合曲线示于图7,拟合结果列入表3。由图7与表3中数据可知,Fe3O4@PVP吸附U(Ⅵ)过程符合Redlich-Peterson等温线模型(r2≥0.977 9)与Langmuir等温线模型(r2≥0.977 9),即认为Fe3O4@PVP吸附U(Ⅵ)过程属于单分子层均匀吸附,且吸附过程是动态过程,在一定条件下被吸附的原子可以重新返回到溶液中。且Langmuir等温线预估20、30、40 ℃下Fe3O4@PVP吸附U(Ⅵ)的饱和吸附容量分别为185.8、237.0、291.0 mg/g,是处理含铀废水的常用吸附剂硅胶吸附容量(约20 mg/g)的10余倍,是普通纳米Fe3O4的5~6倍,30、40 ℃时的饱和吸附容量优于PAM包覆纳米Fe3O4,这表明该吸附为吸热过程,升温有利于提高吸附。Freundlich等温线模型中n为2.24~2.98,均大于1,进一步证明吸附符合Redlich-Peterson等温线模型与Langmuir等温线模型。

■——20 ℃,●——30 ℃,◆——40 ℃pH=6.00,t=120 min(a):— ——Langmiur, ——Freundlich; (b):— ——Temkin, —— Redlich-Peterson图7 Fe3O4@PVP吸附U(Ⅵ)的吸附等温线Fig.7 Different isotherm models for U(Ⅵ) adsorption onto Fe3O4@PVP at different temperatures

表3 Fe3O4@PVP吸附U(Ⅵ)的吸附等温线数据Table 3 Isotherms parameters for Langmuir and Freundlich models
2.8 脱附与再生
吸附剂的脱附与再生性能直接关系到吸附剂是否能够实际应用,为了评价Fe3O4@PVP在U(Ⅵ)吸附过程中的脱附与重复利用性能,开展了脱附再生和循环吸附实验,脱附剂采用0.1 mol/L HCl溶液,结果示于图8。由图8可知:Fe3O4@PVP在脱附再生后随着循环次数增加,铀吸附率不断下降,经过5次再生循环利用后Fe3O4@PVP的铀吸附率下降了4.09%,其重复利用性能优异,这表明在实际应用过程中Fe3O4@PVP能够多次吸附U(Ⅵ),有较好的应用潜力。

pH=6.00,40 ℃,ρ0=50 mg/L,t=120 min图8 Fe3O4@PVP吸附U(Ⅵ)的循环次数Fig.8 Adsorption cycles of U(Ⅵ) onto Fe3O4@PVP
3 结 论
(1) PVP包覆纳米Fe3O4能够显著提高纳米Fe3O4对U(Ⅵ)的吸附容量,20~40 ℃下Fe3O4@PVP吸附U(Ⅵ)的饱和吸附容量为185.8~291.0 mg/g,约为硅胶的10倍,是普通纳米Fe3O4的5~6倍,30、40 ℃下饱和吸附容量优于PAM包覆纳米Fe3O4,且有较好的循环利用性能。
(2) Fe3O4@PVP吸附U(Ⅵ)的适宜pH值为6.0~7.0,60 min内即可达到吸附平衡,溶液中初始U(Ⅵ)浓度增加,Fe3O4@PVP吸附容量逐渐增加,但增加速率不断放缓,最后达到吸附饱和;吸附剂加入量增加会使吸附率增加,并不断趋缓,单次铀吸附率均大于75%。
(3) Fe3O4@PVP吸附U(Ⅵ)的过程符合准二级吸附动力学模型,符合Redlich-Peterson与Langmuir等温线模型,此过程是一个吸热过程,温度越高吸附速率越快,且此吸附过程是一个自发过程(ΔH⊖>0,ΔG⊖<0)。Fe3O4@PVP是一种易于分离的磁性材料,有望应用于0~200 mg/L含铀废水(特别是含铀有机废水)的处理与铀元素回收。

