脑积水性脑室-腹腔分流术诱发颅内感染的病原菌构成及危险因素分析
谢勇,向迅捷,徐才邦,黄华,农邦写
脑积水是由于脑外伤、蛛网膜下出血或颅内肿瘤等导致脑脊液循环障碍,引起脑脊液在脑室或蛛网膜下异常积聚,从而表现出的复杂性病理改变[1-2]。脑 室-腹 腔 分 流 术(ventriculo-peritoneal shunt,VPS)是目前治疗脑积水的常用方式,具有适应证广、操作简单等优势,可有效改善颅内压增高情况,治疗效果获得了广大医生和患者的认可,但VPS 术后容易出现感染、颅内出血、过度分流等多种并发症[3-4]。颅内感染(intracranial infection,ICI)是VPS 术后最为严重且常见的并发症之一,不仅延长了患者的住院时间,增加了治疗费用,同时也增加了临床治疗难度,极大地影响患者预后[5]。掌握VPS 术后发生ICI 的危险因素,筛查易感人群,对于预防感染和改善预后尤为重要。本研究回顾性分析2019 年7 月至2021 年1 月在广西江滨医院行VPS 治疗的100 例脑积水患者临床资料,探讨VPS术后诱发ICI 的病原菌及危险因素,以期为预防感染提供依据。
1 对象与方法
1.1 研究对象 选取2019 年7 月至2021 年1 月在广西江滨医院行VPS 术后发生ICI 的35 例患者为感染组,随机选取VPS 术后未发生ICI 的65 例患者为未感染组。纳入标准:(1)经头颅CT 或MRI诊断为脑积水,接受VPS 治疗;(2)年龄6~80 岁;(3)手术进展顺利,分流无异常;(4)临床资料完整;(5)研究方案经医院伦理委员会批准,患者或家属知情同意并签署知情同意书。排除标准:(1)术前已发生ICI;(2)脑疝导致瞳孔散大;(3)既往存在VPS 治疗史或颅脑手术史;(4)机械障碍等原因导致断流或引流管脱落;(5)合并心肺等重要器官损伤或功能障碍;(6)依从性差、放弃治疗者;(7)不按医嘱接受治疗、检查或中途退出者。
1.2 感染诊断方法 参照《医院感染诊断标准(试行)》[6]中拟定的相关标准:(1)存在体温升高、脑膜刺激征等ICI 症状和体征;(2)脑脊液浑浊,脑脊液中白细胞>10×106/L,葡萄糖<2.25 mmol/L,蛋白>450 mg/L,血白细胞>10×109/L;(3)脑脊液病原菌培养呈阳性。符合上述第(3)项者即可确诊,对于脑脊液病原菌培养呈阴性者可结合前2 个项目联合诊断。
1.3 病原菌检测 采集患者脑脊液标本2 ml,接种于培养皿(上海银科生物科技公司)培养24~48 h,应用VITEK-32 型病原菌鉴定系统(法国梅里埃)鉴定病原菌类型,质控菌株购于中国微生物菌种中心。
1.4 观察指标 收集患者基础资料、病史、影像学检查结果、手术情况以及围手术期资料等临床资料,对可能导致VPS 术后发生ICI 的因素进行分析,包括性别、年龄、脑积水病因、脑积水严重程度、术前感染史、糖尿病病史、高血压病史、手术时间、脑脊液切口漏以及围手术期激素使用等。
1.5 统计学处理 采用SPSS 21.0 软件分析所得数据,计量资料以±s表示,采用独立样本t检验;计数资料以百分比表示,采用χ2检验;对单因素分析存在统计学意义的指标进行多因素Logistic 回归分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 病原菌分布情况 经病原菌培养显示,35 例ICI 患者中6 例(17.14%)存在多重病原菌感染,1 例为革兰氏阴性菌和阳性菌混合感染。共分离出病原菌41 株,其中革兰氏阳性菌23 株(56.10%),革兰氏阴性菌15 株(36.58%),真菌3 株(7.32%)。见表1。
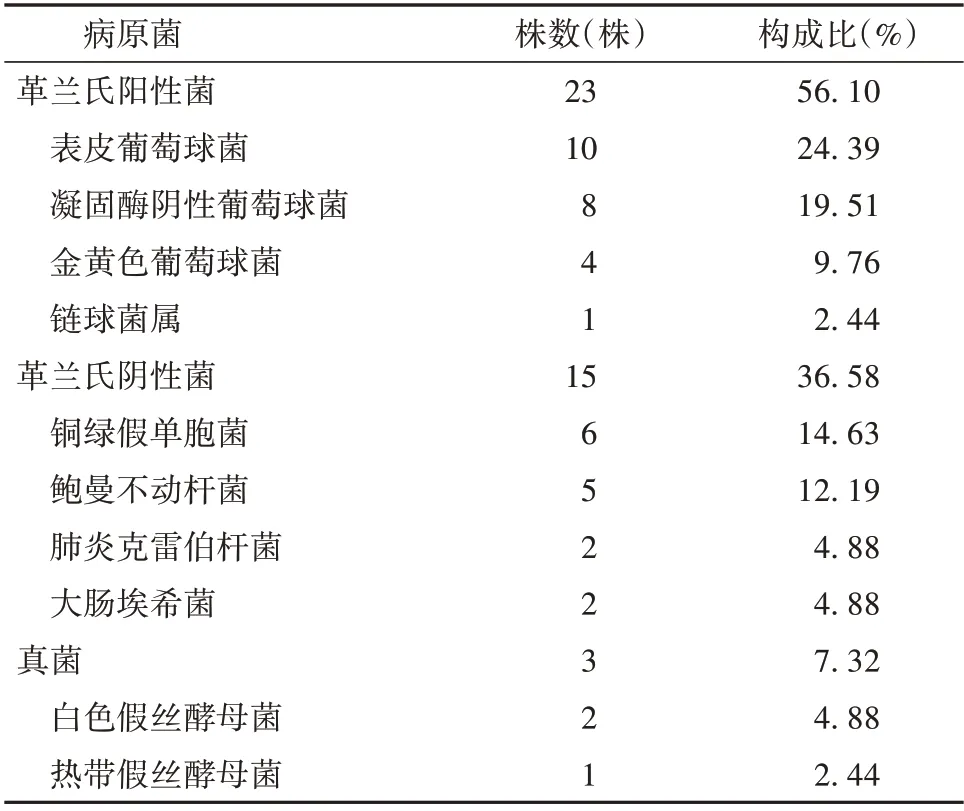
表1 41 株病原菌构成情况
2.2 诱发ICI 的单因素分析 感染组患者年龄≤10 岁、重度脑积水、术前感染史、糖尿病、手术时间>1.5 h 以及脑脊液切口漏所占比例高于未感染组(P<0.05);而2 组患者的性别、脑积水原因、高血压病史和围手术期激素应用比较差异无统计学意义(P>0.05)。见表2。
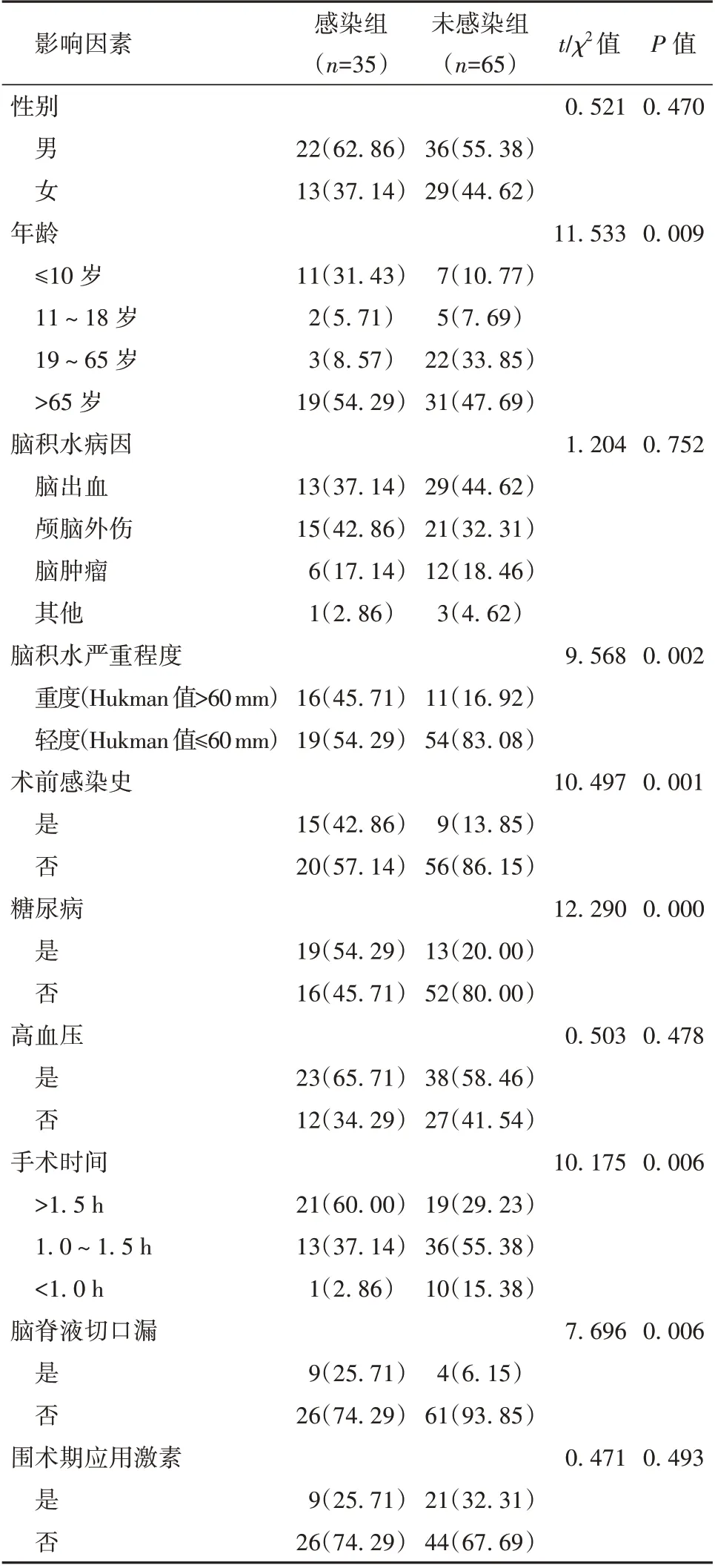
表2 诱发颅内感染的单因素分析[例(%)]
2.3 多因素Logistic 回归分析 多因素Logistic 回归分析显示,年龄≤10 岁、重度脑积水、术前感染史、糖尿病、手术时间>1.5 h 以及脑脊液切口漏是VPS术后患者出现ICI 的独立危险因素(P<0.05)。见表3。
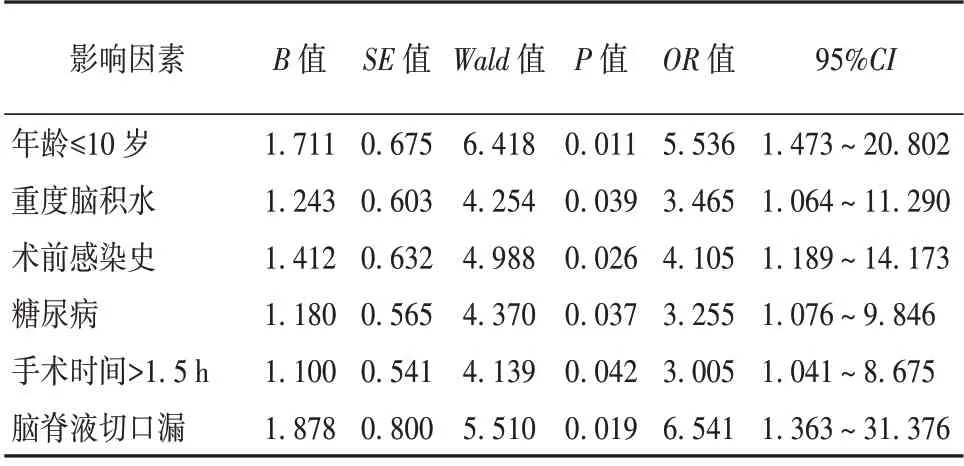
表3 多因素Logistic 回归分析
2.4 治疗及预后 所有ICI 患者首先给予美罗培南和万古霉素抗炎治疗,再根据病原菌培养和药敏实验选取抗生素治疗,移除感染的分流装置,行脑室穿刺外引流,待复查脑脊液无菌后,重新置管进行后续治疗。35 例感染患者均得到有效控制,实施二期分流术过程中未再发生感染,住院时间为(21.68±3.65)d。
3 讨论
VPS 是临床上脑积水简单而有效的治疗方法,通过内置分流器将脑脊液经侧脑室引流至腹腔进行吸收,改善由脑积水导致的一系列症状[7-8]。由于引流导管的置入,VPS 术后感染风险增加,尤其是ICI,给患者术后恢复造成巨大影响,同时也是导致手术失败的主要原因[9]。有报道称,VPS 术后感染率为1.5%~21%,且感染患者病死率高达20%[10]。因此,积极预防感染对提高VPS 治疗效果和改善患者预后意义重大。
本研究中35 例ICI 患者有6 例存在多重病原菌感染,1 例为革兰氏阳性菌和阴性菌混合感染。共分离出病原菌41 株,以革兰氏阳性菌最为多见,达23 株(占56.10%),主要是低毒力的共生菌,包括表皮葡萄球菌、凝固酶阴性葡萄球菌等;其次是革兰氏阴性菌15 株(占36.58%),主要包括铜绿假单胞菌和鲍曼不动杆菌等。虽然VPS 术后ICI 多由体表低毒性的革兰氏阳性菌引起,但VPS 分流管置于腹腔内,不可避免地会发生腹腔革兰氏阴性菌逆行而诱发感染。因此,临床首先推荐以万古霉素和β 内酰胺类药物作为经验性抗感染方案,待脑脊液病原菌培养和药敏实验后,再选取针对性的抗菌药物治疗。另外,本研究还分离出真菌3 株(占7.32%),虽然真菌感染率相对较低,但随着抗生素的滥用,真菌耐药性升高,真菌感染率也呈逐年升高趋势。同时,真菌感染的症状较为隐匿,容易发生误诊或漏诊,导致错失最佳治疗时机,临床上同样需要高度重视。
分析100 例VPS 患者临床资料发现,感染组患者的年龄构成、脑积水程度、术前感染史、糖尿病、手术时间和脑脊液切口漏与未感染组存在显著差别;经多因素Logistic 回归分析发现,年龄≤10 岁、重度脑积水、术前感染史、糖尿病、手术时间>1.5 h 以及脑脊液切口漏是VPS 患者出现ICI 的独立危险因素。低龄儿童机体免疫系统尚不完善,手术耐受力差,免疫力低下,受到病原菌侵袭后,机体不能通过自身免疫自主清除,从而容易出现病原菌感染[11-12]。而重度脑积水患者由于病情危重,侵入性操作和手术器械使用机会增多,机体生理功能受到抑制,增加了术后感染概率;另外,重度脑积水患者术后卧床时间更长,身体机能紊乱,行VPS 术后恢复缓慢,更易发生感染[13]。术前有感染史的患者ICI 发生率较高,可能是之前感染并未彻底治愈,残留的病原菌潜伏在体表或体内,VPS 术后患者机体免疫力降低,病原菌重新大量繁殖,并经手术切口、分流管等进入颅腔,从而引发ICI[14]。
糖尿病是VPS 患者术后ICI 的重要危险因素,若糖尿病患者血糖控制不理想,其机体微循环和神经系统容易发生病变,抗体和补体生成不足,对病原菌的吞噬和杀伤能力下降,则容易发生病原菌感染;另外,糖尿病患者体内糖代谢紊乱,蛋白质合成减少,造成切口延迟愈合,增加病原菌感染和繁殖风险[15-16]。高血糖患者病原菌感染率显著升高,而感染又会引起机体过度反应,加重高血糖状态,从而形成恶性循环。
另外,本研究显示,手术时间和脑脊液切口漏是VPS 患者出现ICI 的高危因素。手术时间延长导致手术区域和分流装置在空气中暴露的时间较长,受到环境中微生物感染的风险也越大。病原菌逆行进入颅内,导致术后ICI 概率也越大;同时,长时间手术会造成无菌手套磨损,发生隐匿性穿孔,导致手术器械污染,从而诱发感染[17]。脑脊液切口漏是由于原发疾病治疗中,脑膜缺损或缝合不严导致的脑脊液外渗。脑脊液切口漏患者由于颅腔完整结构被破坏,削弱了脑屏障保护作用。颅内的密闭环境被破坏,导致颅内与外界相通,病原菌容易经缺损部位进入颅腔,从而发生感染[18]。
针对以上风险因素,笔者提出几点建议:(1)VPS 术前取脑脊液送检,若脑脊液中蛋白含量升高,提示已存在颅内感染或颅内损伤,应先行脑室外引流,待颅内感染或脑损伤控制后,再行VPS 术;(2)糖尿病患者在围手术期应严格控制血糖水平,并在术前预防性给予抗生素治疗,增加机体抵抗力,降低感染风险。(3)VPS 术前应做好充分准备,提高手术操作技巧,缩短手术时间。手术人员应严格遵守无菌操作,术中可更换手套或戴双层手套,避免手套磨损导致手术器械污染。(4)硬脑膜未愈合或颅骨缺损患者,若颅内压急剧升高,可能引起脑脊液漏出,增加感染风险。VPS 术后应采取半卧位,头偏向脑脊液漏出一侧,保证引流顺利,避免引流管堵塞,同时尽量避免咳嗽等可引起颅内压升高的行为。对已出现脑脊液漏出患者,必要时采取切口漏修补术。
综上所述,脑积水患者行VPS 术后ICI 病原菌以革兰氏阳性菌为主,低龄、感染史、糖尿病史、手术时间长以及脑脊液切口漏是诱发ICI 的危险因素,临床上应采取积极防控措施,尽量减少ICI 的发生。

