优质豆类蛋白筛选及其与乳清蛋白最佳复配比例的研究
周荣荣, 庄柯瑾, 2, 许庆鹏, 潘 静, 张东杰, 3, 4
(黑龙江八一农垦大学食品学院1,大庆 163319) (农业农村部农产品及加工品质量监督检验测试中心2,大庆 163319) (黑龙江省农产品加工与质量安全重点实验室3,大庆 163319) (国家杂粮工程技术研究中心4,大庆 163319)
我国豆类资源丰富,种植面积广,种类繁多,在国际市场中占有较大份额,研究表明豆类还具有降血压[1]、降血脂[2]、预防糖尿病[3]、心血管疾病[4]等慢性疾病的保健功能;有些豆类的药用价值也较高,如绿豆具有清热解毒、抑菌的功效;豌豆具有缓解腹痛、腹胀等功效[5,6]。随着人们的健康意识越来越强,豆类的摄入逐渐受到大家关注,黑龙江省具有豆类种植优势,且豆类的综合利用有利于可持续膳食的发展[7]。另外,豆类具有高蛋白、高纤维等特点,是营养健康的食物资源[8,9]。
蛋白质是人体维持生命体征所必需的一种营养物质,蛋白质消化率越高,被机体吸收利用的可能性越大,证明其营养价值越高[10]。“双蛋白”指植物蛋白与动物蛋白相结合,实现2种蛋白精准互作,对调控膳食结构具有重要的支撑作用。2017年国务院办公厅发布的《国民营养计划(2017—2030)年》中指出“着力发展双蛋白食物等新型营养健康食品”。“双蛋白”的发展不仅能够优化蛋白质利用率,还能满足不同人群的营养需求。
豆类蛋白质质量分数为20%~40%,含有多种必需氨基酸,尤其是谷物中缺乏的赖氨酸,因此具有比一般谷物更高的营养价值。且豆类蛋白的氨基酸组成与WHO提出的优质蛋白质氨基酸组成接近,可用于部分替代人类膳食中的动物蛋白。乳清蛋白具有高消化率、高生物价、高蛋白功效比和高利用率等特点,巯基氨基酸(半胱氨酸和蛋氨酸)含量较高[11,12],但牛乳中 α-S1酪蛋白和 β-乳球蛋白是目前公认的过敏源[13,14]。用豆类蛋白部分替代乳清蛋白可在一定程度上降低乳清蛋白引起的过敏反应,同时,豆类蛋白相对缺乏甲硫氨酸,而乳清蛋白中含有高水平的甲硫氨酸,两者搭配,将显著提高豆类蛋白的营养价值。蛋白质在胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶的作用下水解为氨基酸[15],用于人体的胃肠消化吸收[16]。与体内消化相比,体外消化可以在实验室内进行,并可以进行批量测定,缩短了试验时间[17];另外,体外消化可以有效的筛选外源酶制剂种类和添加量,以提高样品消化率[18]。这是体外消化率测定方法的优点,也是得以发展的主要依据。
本研究通过测定豆类蛋白含量、等电点、蛋白提取率、蛋白纯度、蛋白体外消化率及氨基酸含量,选择出优质豆类蛋白。将该优质豆类蛋白与乳清蛋白进行复配,不仅可以节约成本,还能够改善消费者膳食结构,同时也拓宽了豆类在食品中的应用范围,为豆类-乳清“双蛋白”膳食的合理性研究提供参考。
1 材料与方法
1.1 材料与试剂
黑龙江省主栽豆类种子:红豆(大红袍、珍珠红),绿豆(绿丰2号、绿丰5号),芸豆(奶花、叙利亚白),豌豆(草原3号、草原31号),黑豆(黑青2号、乌青10号);WPI 90乳清蛋白粉。
血红蛋白、Tris、Tris-HCl、NaOH、石油醚(30~60 ℃)、H3BO3、CuSO4、MgCl2·6H2O、Na-对甲苯磺酰基-L-精氨酸甲酯盐酸盐(TAME)、N-苯甲酰-L-酪氨酸乙酯、KCl、KH2PO4、NaHCO3、NaCl、 (NH4)2CO3、CaCl2·2H2O、胃蛋白酶(1∶30 000)、胰蛋白酶(1∶2 500)、胰凝乳蛋白酶(1∶1 500),试剂均为分析纯。
1.2 仪器与设备
AR323CN电子天平,TDZ5-WS医用离心机,Alpha 1-4 LSC basic冷冻干燥机,K9860凯氏定氮仪,TU-1810PC紫外分光光度计,CPX3800H-C超声波清洗机,SE-750高速粉碎机,FCH 202磁力搅拌器,DGG-9023A电热恒温鼓风干燥箱,FE20实验室pH计,HZQ-Q全温振荡器。
1.3 试验方法
1.3.1 豆类预处理
豆类脱脂处理参照聂丽洁[19]的方法,略有改动。称取适量豆类进行清洗,放入鼓风干燥箱中烘干至恒重。取出放置至室温,用高速粉碎机将干燥后的豆类粉碎,过60目筛,收集筛下物,用石油醚脱脂。将豆类粉与石油醚1∶5比例混合,在室温下用磁力搅拌器连续搅拌6 h,待豆类粉沉降与上层有机溶剂分离后,倾出有机溶剂进行回收。最后将豆类粉置通风橱中干燥,干燥完成后将脱脂豆类粉装袋于4 ℃下保存备用。
1.3.2 豆类蛋白含量的测定
豆类蛋白含量测定参照颜常盛[20]的方法,略作改动。分别称取10种脱脂豆类粉试样1 g,精确至0.001 g,加入0.4 g CuSO4、6 g K2SO4及10 mL H2SO4,放入消化炉中于400 ℃条件下消化至澄清透明,冷却至室温,用凯氏定氮仪测定样品蛋白含量。
1.3.3 豆类蛋白等电点测定
豆类蛋白等电点测定参照叶健明等[21]的测定方法,略有改动。分别称取10种脱脂豆类粉3 g,加入2 mol/L的NaOH溶液调pH为10,50 ℃下用磁力搅拌器搅拌1 h,离心(3 000 r/min、20 min)得上清液,随后用1 mol/L HCl调节红豆、芸豆、豌豆和黑豆体系pH值分别为3.6、3.8、4.0、4.2、4.4、4.6,绿豆体系pH值分别为4.6、4.8、5.0、5.2、5.4、5.6,4 000 r/min离心20 min,吸取1 mL上清液在595 nm处测定吸光度值。上清液中残留蛋白最少时(吸光值最小)的pH值即为该豆类蛋白的等电点。
1.3.4 豆类蛋白提取
豆类蛋白的提取参照户月秀[22]的方法,略有改动。将10种脱脂豆类粉按1∶10的比例溶于蒸馏水中,用2 mol/L NaOH 溶液调豆类粉溶液至pH 9.0,在50 ℃下用磁力搅拌器搅拌1 h,然后离心(3 500 r/min,离心30 min),取上清液备用。再按1∶8比例,在沉淀中加蒸馏水进行二次提取。合并2次离心后的上清液,室温下用1.0 mol/L HCl将pH调节至等电点,在4 ℃下搅匀2 h,在4 000 r/min 下,离心20 min,弃其上清液,所得沉淀经2次蒸馏水洗后,冷冻干燥得到豆类蛋白质,蛋白提取率见式(1)。将冻干后的豆类蛋白进行凯氏定氮试验,测出其蛋白含量即为豆类蛋白纯度。
P1=m1/m2×100%
(1)
式中:P1为豆类蛋白提取率/%;m1为提取蛋白含量/g;m2为豆类蛋白含量/g。
1.3.5 体外消化实验
模拟消化液储备液的制备见表1。在酶活性为30 000 U/mg的胃蛋白酶中加入模拟胃液(simulated gastric fluid, SGF),制备酶活性为25 000 U/mL的胃蛋白酶;在酶活性为2 500 U/mg的胰蛋白酶中加入模拟肠液(simulated intestinal fluid, SIF),制备酶活性为800 U/mL的胰蛋白酶;在酶活性为1 500 U/mg的胰凝乳蛋白酶中加入SIF,制备酶活性为400 U/mL的胰凝乳蛋白酶。

表1 模拟消化液储备液的制备
豆类蛋白的体外消化实验参照Aadre等[23]的实验方法,略有改动。
口腔消化阶段:分别称取10种豆类蛋白各0.5 g以1∶10比例溶于去离子水中得到5 mL样品溶液,等体积加入4.0 mL SSF、25 μL CaCl2·2H2O、975 μL去离子水,模拟口腔消化。用HCl/NaOH溶液调pH为7,将样品放入全温振荡器中,在37 ℃下消化2 min。
胃部消化阶段:在口腔消化后的样品溶液(10 mL)中等体积加入7.5 mL SGF、1.6 mL胃蛋白酶、5 μL CaCl2·2H2O、0.2 mL HCl、695 μL去离子水,模拟胃部消化。用HCl溶液调pH为3.0,将样品放入全温振荡器中,在37 ℃下消化2 h。
肠道消化阶段:在胃部消化后的样品溶液(20 mL)中等体积加入11 mL SIF、5 mL胰蛋白酶、2.5 mL胰凝乳蛋白酶、40 μL CaCl2·2H2O、0.15 mL NaOH、1.31 mL去离子水,模拟肠道消化。用HCl/NaOH溶液调pH为7,将样品放入全温振荡器中,在37 ℃下消化2 h。
消化终点处,将消化液于0 ℃下灭酶30 min,以结束小肠消化。消化液进行离心(10 000×g,20 min),将上清液冷冻干燥,得到粉末状消化产物。豆类蛋白体外消化率见式(2)。
P2=(m3-m4)/m3×100%
(2)
式中:P2为豆类蛋白体外消化率;m3为摄入蛋白质量/g;m4为剩余蛋白质量/g。
1.3.6 氨基酸组成和氨基酸评价
GB 5009.124—2016方法进行测定,由氨基酸自动分析仪测定豆类蛋白氨基酸组成及含量。
根据世界卫生组织(WHO)和联合国粮农组织(FAO)提出的氨基酸评分标准模式(FAO/WHO模式)和文献[24]提出的鸡蛋蛋白质评分标准模式(全鸡蛋白模式),计算豆类的氨基酸评分(AAS)、氨基酸比值系数(RC)、氨基酸比值系数分(SRC)、化学评分(CS)与必需氨基酸指数(EAAI),计算如式(3)所示。
AAS=EAAa/EAAb
RC=c/d
SRC=100-CV×100
CS=EAAa/EAAe
EAAI=[(EAA1/EAA1′)×100×(EAA2/EAA2′)×100×…(EAAn/EAAn′)×100]1/n
(3)
式中:EAAa为待评蛋白质中某必需氨基酸含量/%;EAAb为FAO/WHO评分模式中同种氨基酸含量/%;c为待评蛋白质中某必需氨基酸AAS;d为所有必需氨基酸AAS的平均值;CV为RC的相对标准差[25,26];EAAa为待评蛋白质中某必需氨基酸含量/%;EAAe为鸡蛋蛋白评分模式中同种氨基酸含量/%;EAA1为赖氨酸;EAA1′为鸡蛋蛋白中赖氨酸;EAA2为亮氨酸;EAA2′为鸡蛋蛋白模式中亮氨酸;……;EAAn为缬氨酸;EAAn′为鸡蛋蛋白中缬氨酸;n为必需氨基酸的个数[27]。
1.3.7 黑青2号-乳清“双蛋白”的复配比例的确定
将黑青2号蛋白与乳清蛋白分别以2∶1;1.5∶1;1∶1;1∶1.5;1∶2比例混合,将混合后的黑青2号-乳清“双蛋白”进行体外消化实验,实验步骤同1.3.5,消化完成后通过体外消化率的测定判断黑青2号-乳清“双蛋白”复配的最佳比例。
1.4 数据处理
采用SPSS Statistics 17.0软件对数据进行统计分析,每组实验数据重复测定3次,实验结果均以“平均值±标准差”的形式表示。
2 结果与分析
2.1 豆类中蛋白含量
由凯氏定氮仪测得不同豆类粗蛋白含量见表2。由表2可知,绿豆属内和豌豆属内的豆类蛋白含量差异不显著(P≥0.05);红豆属内、芸豆属内和黑豆属内的豆类蛋白含量差异显著(P<0.05)。其中,不同豆类属内含量较高的品种为绿丰5号、大红袍、奶花、草原3号、黑青2号。除黑豆外,其余豆类中的蛋白质量分数在 21.95%~26.12%之间,小于大豆中蛋白质量分数(36%~51%)[28],但远高于禾谷物中蛋白质量分数(7%~15%)[29]。此外,黑豆属(黑青2号、乌青10号)的蛋白质量分数显著高于其他豆类(P<0.05),分别为(39.03±0.14)% 和(36.28±0.27)%,与大豆蛋白的含量最为接近,与刘柏林等[30]的研究结果相符。

表2 不同豆类中粗蛋白含量
2.2 豆类蛋白等电点的确定
吸光度值越小,样品上清液中残留蛋白量越少,蛋白溶解性越低,故吸光度值最小时所对应的pH值即为蛋白等电点[19]。图1是不同豆类上清液中吸光度随pH的变化曲线。

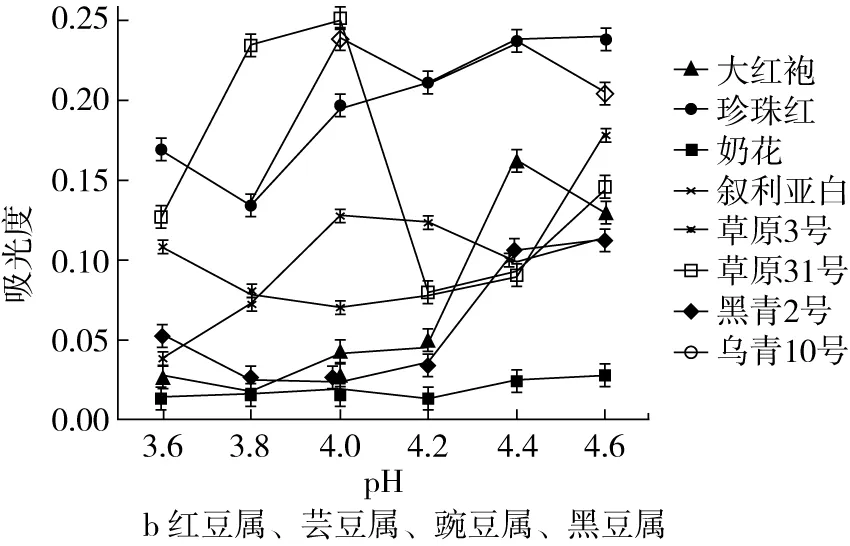
图1 不同pH条件下豆类上清液的吸光度
由图1可以看出,绿丰2号、珍珠红、叙利亚白、黑青2号和乌青10号蛋白吸光度值随pH的增加呈先下降后上升的趋势;绿丰5号、草原3号和草原31号蛋白吸光度值随pH的增加呈先上升后下降再上升的趋势;大红袍蛋白吸光度值随pH的增加呈先下降后上升再下降的趋势;奶花蛋白吸光度值随pH的增加呈先上升后下降再上升的趋势。
由此可知,10种豆类蛋白等电点为:绿丰2号4.8,绿丰5号5.2,大红袍、珍珠红3.8,奶花4.2,叙利亚白4.0,草原3号3.6,草原31号4.2,黑青2号4.0,乌青10号3.8。
2.3 豆类蛋白提取率及纯度分析
碱溶酸沉法提取豆类蛋白的结果见表3。红豆属内、芸豆属内和黑豆属内蛋白提取率差异不显著(P≥0.05);绿豆属内和豌豆属内蛋白提取率差异显著(P<0.05)。其中不同豆类属内提取率较高的品种为绿丰5号、大红袍、叙利亚白、草原31号、黑青2号。豆类蛋白的提取率均在65% 以上,其中绿丰5号、大红袍、珍珠红和奶花蛋白提取率在73.48%以上,叙利亚白、草原3号、草原31号、黑青2号和乌青10号蛋白提取率达80.82% 以上。
绿豆属内、红豆属内和黑豆属内蛋白纯度差异不显著(P≥0.05);芸豆属内和豌豆属内蛋白纯度差异显著(P<0.05)。其中不同豆类属内纯度较高的品种为绿丰2号、珍珠红、奶花、草原3号、乌青10号。所提取的豆类蛋白纯度均在 89% 以上,其中绿丰2号和绿丰5号蛋白纯度可以达到95%以上,红豆、芸豆、黑豆和豌豆属下的草原3号蛋白纯度均在 90% 以上,豌豆属下的草原31号品种略低。
Rui等[31]研究结果表明不同豆类蛋白提取率不同,主要是蛋白质组成和结构所决定的。梁珊[32]和Alex等[33]研究表明,在相同提取条件下,脱皮处理能显著提高豆类蛋白提取率,因此,除提取条件外,豆类的前处理方式对蛋白提取率有一定影响。

表3 豆类蛋白的提取率及纯度
2.4 豆类蛋白体外消化性能分析
蛋白质消化能力是评价蛋白质营养价值的重要指标之一,其测定方法通常采用消化蛋白酶模拟动物胃肠内环境进行体外消化,能够近似反映机体真实消化率水平[34]。不同豆类蛋白的体外消化率见表4。
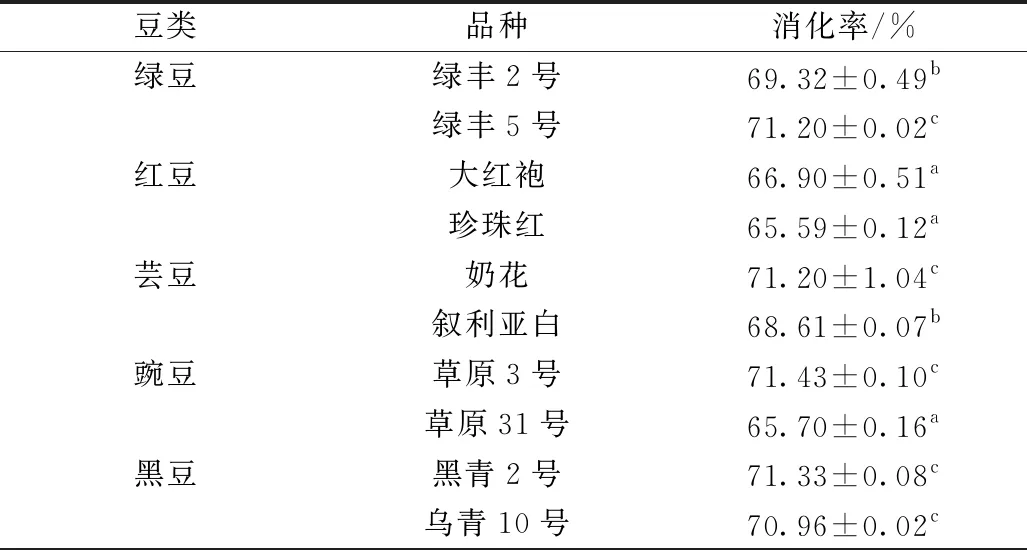
表4 不同豆类蛋白的体外消化率
由表4可以看出,红豆属内和黑豆属内蛋白消化率差异不显著(P≥0.05);绿豆属内、芸豆属内和豌豆属内蛋白消化率差异显著(P<0.05)。其中不同豆类属内蛋白消化率较高的品种为绿丰5号、大红袍、奶花、草原3号、黑青2号。豆类蛋白质体外消化率由高到低的顺序为:草原3号>黑青2号>奶花>绿丰5号>乌青10号>绿丰2号>叙利亚白>大红袍>草原31号>珍珠红。从蛋白质的体外消化率来看,草原3号、黑青2号、奶花、绿丰5号和乌青10号蛋白消化率差异不显著(P≥0.05),均在70% 以上。
豆类蛋白体外消化率不同,可能是因为豆类种类及豆类蛋白结构有所差异,不同蛋白源氨基酸组成不同,消化酶对蛋白质的水解位点和水解位点数量就会有很大的差异,从而导致相同的消化酶系统对不同的豆类蛋白质产生不同的消化率。
2.5 氨基酸分析
综合考虑不同豆类的蛋白含量、蛋白提取率、蛋白纯度和蛋白体外消化率指标,每种豆类属内选择一个较优的豆类品种进行氨基酸评价。本研究选择了绿丰5号、大红袍、奶花、草原3号和黑青2号豆类进行氨基酸含量的测定。
2.5.1 氨基酸含量
5种豆类氨基酸组成及含量见表5。每种豆类中均含有17种氨基酸,氨基酸总含量为838.32~961.53 mg/g,黑青2号含量最高,草原3号最低。其中,必需氨基酸总含量为320.32~383.88 mg/g,除草原3号略低于FAO/WHO模式之外,其余豆类必需氨基酸含量均优于FAO/WHO模式。必需氨基酸含量与氨基酸总含量比值(EAA/TAA)为38.21%~42.34%,必需氨基酸含量与非必需氨基酸含量比值(EAA/NEAA)为61.84%~73.42%。
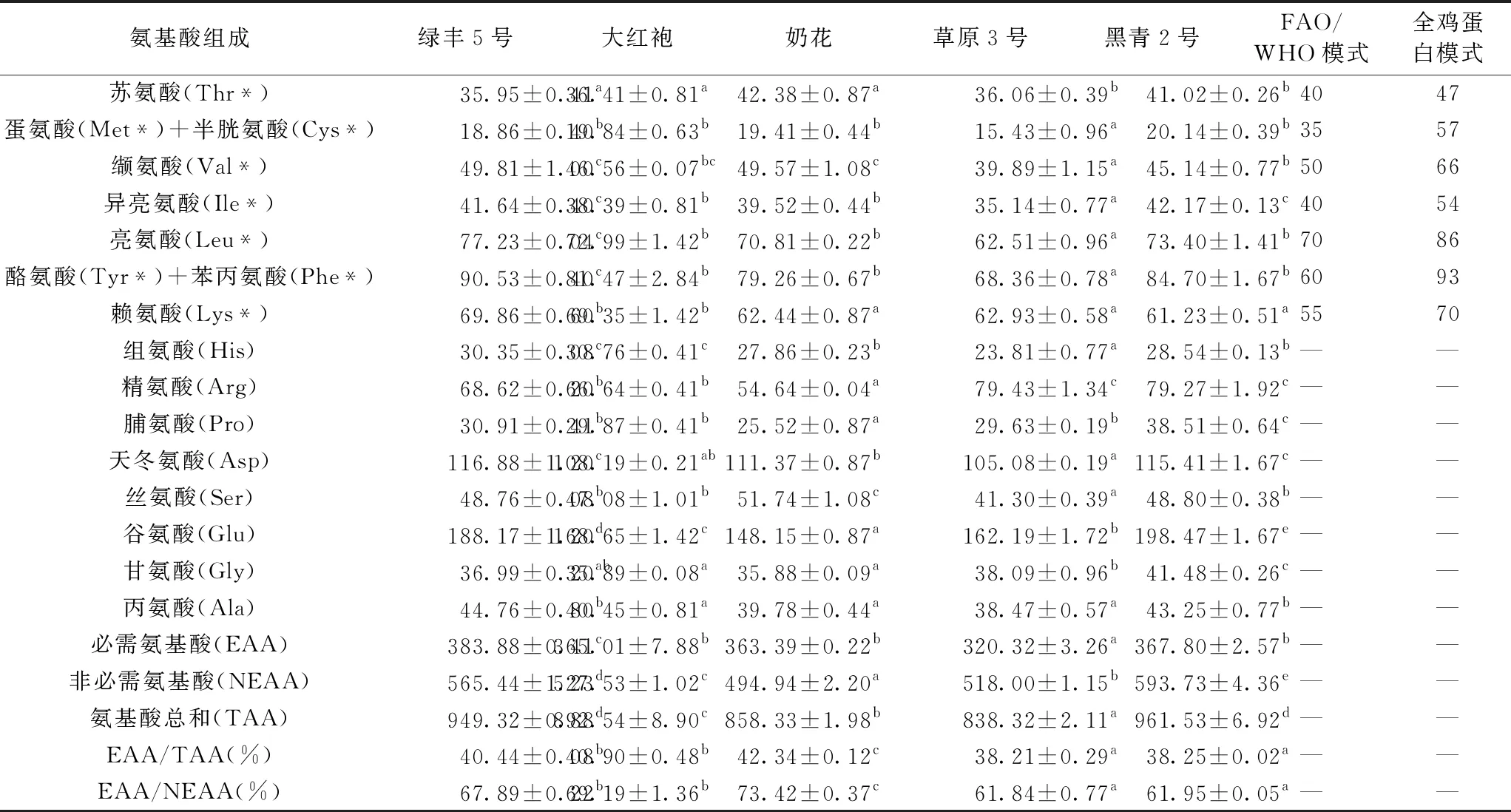
表5 5种豆类17种氨基酸含量与2种模式下必需氨基酸含量/mg/g

表6 5种豆类中蛋白的AAS与CS分析
EAA含量及组成比例对蛋白质的营养价值有一定程度的影响,一种蛋白质营养价值的高低,不仅在于它的蛋白含量和消化率,还要考虑蛋白质中所含氨基酸的均衡性是否能满足人体需要。5种豆类均显示谷氨酸含量最高(148.15~198.47 mg/g),蛋氨酸+半胱氨酸含量最低(15.43~20.14 mg/g),其中,黑青2号上述氨基酸含量均显著高于其他豆类(P<0.05)。
2.5.2 氨基酸评价
AAS主要考虑某一种EAA是否符合WHO/FAO标准,当AAS大于1时,说明该氨基酸含量符合WHO/FAO标准,反之,若AAS小于1,则表明低于标准。RC最小时,说明该氨基酸是第一限制性氨基酸,而SRC越接近100,其蛋白质的营养价值越高。5种豆类的AAS、CS、RC、SRC与EAAI见表6和表7。
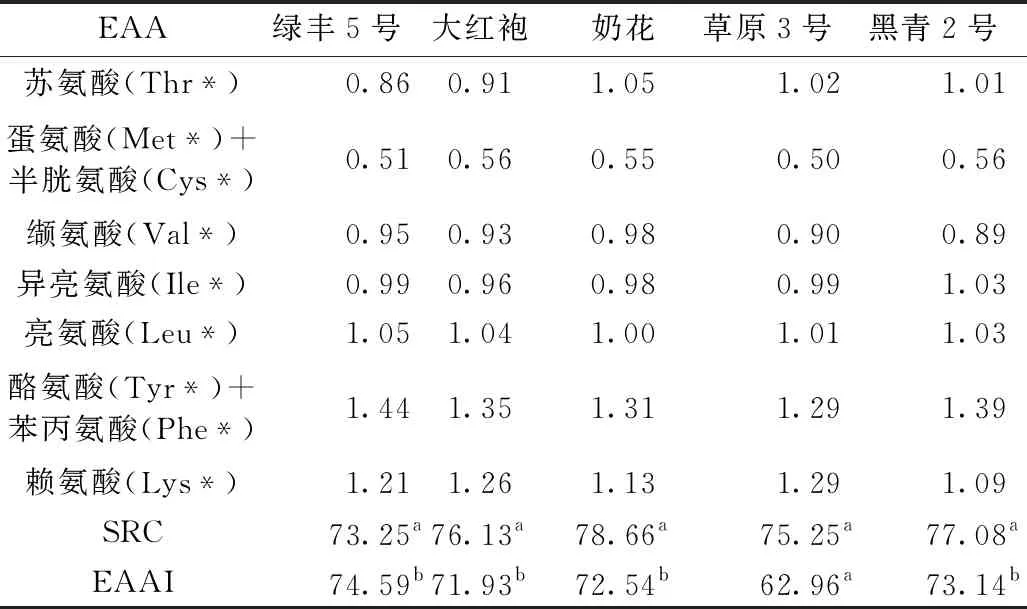
表7 5种豆类中蛋白的RC、SRC与EAAI分析
由表6可知,豆类蛋白中AAS值范围为0.44~1.51,CS范围为0.27~1.00,其中蛋氨酸+半胱氨酸最低(AAS: 0.44~0.58, CS: 0.27~0.35)。草原3号蛋白中除了蛋氨酸+半胱氨酸、缬氨酸、异亮氨酸、亮氨酸AAS值小于1外,其他氨基酸AAS值均大于1;大红袍、绿丰5号、奶花和黑青2号蛋白中除蛋氨酸+半胱氨酸AAS值小于1外,其他氨基酸AAS值均大于或接近于1,说明豆类蛋白中赖氨酸、亮氨酸、苏氨酸等必需氨基酸含量相对丰富,氨基酸组成合理,接近人体所需蛋白氨基酸组成。
由表7可知,比较不同豆类蛋白中必需氨基酸的RC值(0.50~1.44)发现,大红袍和绿丰5号蛋白中蛋氨酸+半胱氨酸的RC值(0.56和0.51)最小,为第一限制性氨基酸,其次是苏氨酸,与郑少杰等[35]的研究结果相符;奶花蛋白中蛋氨酸+半胱氨酸的RC值(0.55)最小,为第一限制性氨基酸,其次为缬氨酸和异亮氨酸;草原3号和黑青2号蛋白中蛋氨酸+半胱氨酸的RC值(0.50和0.56)最小,为第一限制性氨基酸,其次是缬氨酸,与周根来等[36]的研究结果相符。5种豆类蛋白的EAAI范围为62.96~74.59,从高到低分别为绿丰5号>黑青2号>奶花>大红袍>草原3号,除草原3号外,其他豆类蛋白之间差异不显著(P≥0.05);5种豆类蛋白的SRC值范围为73.25~8.66,从高到低分别为奶花>黑青2号>大红袍>草原3号>绿丰5号,且差异不显著(P≥0.05)。

图2 黑青2号-乳清蛋白不同复配比例对复合蛋白体外消化率的影响
5种豆类的第一限制性氨基酸均为蛋氨酸+半胱氨酸。一种氨基酸的缺乏会影响其他氨基酸的吸收,使摄取的蛋白质不能充分利用而造成营养不良,根据食物蛋白质氨基酸组成,只有进行合理的食物搭配,才能达到营养互补的效果。
2.6 黑青2号-乳清“双蛋白”复配比例的确定
结合豆类蛋白含量、提取率和纯度、体外消化率、氨基酸评价,发现黑青2号具有较好的营养价值,故选其与乳清蛋白进行复配,制备黑青2号-乳清“双蛋白”。根据消化液中蛋白含量计算豆类蛋白的消化率,可以分析豆类蛋白质的体外消化程度。黑青2号蛋白与乳清蛋白复配比例对复合蛋白体外消化率的影响如图2所示。
从图2中可以看出,不同复配比例的复合蛋白其体外消化率不同,其随乳清蛋白含量的增加而增大。当黑青2号蛋白∶乳清蛋白为1∶2时,黑青2号-乳清“双蛋白”体外消化率最高,达到(74.03±0.26)%,与乳清蛋白体外消化率(73.81±0.11)%相近,且差异不显著(P≥0.05)。结果表明,通过黑青2号蛋白与乳清蛋白的复配,不仅达到了单一乳清蛋白体外消化的消化程度,也节约了成本,另一方面通过不同来源蛋白质的营养复配,可以提高蛋白质的营养价值。
3 结论
综合指标筛选出的黑青2号豆类蛋白质含量最高,且其具有较高的蛋白质提取率、蛋白质纯度及蛋白质体外消化率;此外,其氨基酸总含量最高,为(961.53±6.92) mg/g,EAAI值较高,为73.14。黑青2号蛋白与乳清蛋白复配结果表明,黑青2号蛋白与乳清蛋白复配比例为1∶2时体外消化率最高,达到(74.03±0.26)%。本研究对豆类-乳清“双蛋白”的开发及生产具有指导意义,可进一步深入研究豆类蛋白性能,提高豆类蛋白利用率和应用价值。

