脑卒中后抑郁患者血清瘦素、炎症因子和脑源性神经营养因子的变化及意义
李月娥,王欣,靳新荣,张莉,杨超,王玲丽,迪丽努尔·艾尔肯
(乌鲁木齐市第四人民医院精神科,乌鲁木齐 830002)
脑卒中是多种脑血管疾病的严重表现形式,已成为我国首位致死病因[1]。抑郁症是脑卒中后最常见的情感障碍[2],约33%的脑卒中患者患有抑郁症[3]。因此,鉴别和诊断脑卒中后抑郁至关重要。有研究证实,首次脑梗死3个月后约41.1%的患者会发生脑卒中后抑郁[4]。脑卒中后抑郁不仅与不良预后有关[5],还可能造成死亡率增加[6]。有学者认为,慢性炎症是抑郁症发生的可能机制[7-8]。血清中一些炎症因子水平升高与抑郁症症状有关[9-10],但也有研究未发现这种相关性[11],有研究仅在男性中发现了这种相关性[12]。另有学者在重度抑郁症患者中检测到较高水平的血清细胞间黏附分子1和C反应蛋白[13]。脑卒中引发情绪相关脑区的促炎性细胞因子增加导致炎症,故炎症被认为是脑卒中后抑郁的一个关键因素[14]。此外,脑源性神经营养因子[14]和瘦素[15]也被证实与抑郁症存在相关性。近年来,学者们一直将瘦素作为心肌梗死和脑卒中的危险因素来进行研究。有研究者发现,与健康人群相比,抑郁症患者的瘦素水平更高[16]。然而,瘦素在抑郁症患者中的作用尚不明确。本研究旨在分析脑卒中后抑郁患者血清瘦素、炎症因子和脑源性神经营养因子的变化及意义。
1 资料与方法
1.1一般资料 选取2019年1月至2020年6月在乌鲁木齐市第四人民医院就诊的发病24 h以内的134例脑卒中患者作为研究对象,患者均符合《中国脑血管疾病分类2015》[17]中的脑卒中诊断标准,接受缺血性脑血管病常规治疗。排除标准:①既往曾诊断及接受治疗的抑郁症患者;②肾或代谢性疾病、甲状腺疾病、心功能不全、严重活动性肝病、全身免疫性疾病者;③语言障碍,不能配合完成量表评估者。
患者出院后7 d和出院后1个月时,由两位接受过培训的精神科医师对患者进行评估,老年抑郁量表一致性的Kappa值为0.92。根据《CCMD-3中国精神障碍分类与诊断标准》[18]中有关抑郁障碍的诊断标准,将老年抑郁量表评分≥10分定义为有抑郁症状。患者均未接受抗抑郁药物治疗。本研究经乌鲁木齐第四人民医院伦理委员会批准,患者及其家属签署了知情同意书。
1.2研究方法
1.2.1临床资料收集 记录所有患者入院时脑卒中诱因、婚姻状况、文化程度及同居者信息。入院进行血液凝血四项、心电图、胸部X线片检查和颈动脉超声检查。脑卒中分型按照脑梗死的病因分型标准进行分类[19]。
1.2.2血清分子标志物检测 所有患者在出院后7 d及出院后1个月抽取清晨空腹静脉血5 ml,于2 h内离心,以离心半径10 cm、2 000 r/min离心10 min,取上清液,保存于-80 ℃冰箱待测。采用酶联免疫吸附法测定血清瘦素、炎症因子(白细胞介素-1β、白细胞介素-6、肿瘤坏死因子-α、细胞间黏附分子-1和高敏C反应蛋白)和脑源性神经营养因子,所有试剂盒均购自瑞典Can Ag AB公司。
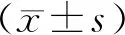
2 结 果
在134例脑卒中患者中,出现抑郁症状患者48例,患病率为35.8%(48/134)。其中,出院后7 d出现抑郁症状患者25例,患病率为18.7%(25/134)。出院后1个月对109例脑卒中患者进行随访,104例患者完成随访,完成随访患者中出现抑郁症状患者23例,患病率为22.1%(23/104)。
2.1两组的基线资料比较 脑卒中后抑郁组女性比例、年龄、寡居/鳏居和与子女同住患者比例高于单纯脑卒中组(P<0.05或P<0.01);两组的脑左侧损伤、脑卒中诱因和脑损伤部位比例比较差异无统计学意义(P>0.05)。见表1。

表1 两组脑卒中患者的基线资料比较
2.2两组患者出院后7 d的血清分子标志物水平比较 脑卒中后抑郁组的血清瘦素水平明显高于单纯脑卒中组(P<0.01),两组的白细胞介素-1β、白细胞介素-6、肿瘤坏死因子-α、细胞间黏附分子-1、高敏C反应蛋白、脑源性神经营养因子水平比较差异无统计学意义(P>0.05)。见表2。

表2 两组脑卒中患者出院后7 d的血清分子标志物水平比较 [M(P25,P75)]
2.3两组患者出院后1个月的血清分子标志物水平比较 脑卒中后抑郁组的血清瘦素水平明显高于单纯脑卒中组(P<0.01),两组的白细胞介素-1β、白细胞介素-6、肿瘤坏死因子-α、细胞间黏附分子-1、高敏C反应蛋白、脑源性神经营养因子水平比较差异无统计学意义(P>0.05)。见表3。

表3 两组脑卒中患者出院后1个月的血清分子标志物水平比较 [M(P25,P75)]
3 讨 论
脑卒中后抑郁是脑卒中最常见的情感障碍并发症之一,严重影响脑卒中患者的预后和死亡发生率。其主要表现为情绪悲观、睡眠障碍、社会功能下降、认知功能障碍及周期性躯体不适等。尽管学者们对脑卒中后抑郁进行了深入研究,但其发生机制仍不清楚。目前,国内研究主要集中在血清瘦素变化、炎症介质释放、神经递质变化及脑卒中后相关影响分子变化等方面[20-21]。
本研究中,18.7%的脑卒中患者在出院后7 d出现抑郁症状;出院后1个月的抑郁症患病率高达22.1%。与既往研究结果基本一致[22]。与男性患者相比,脑卒中后抑郁在女性中发病率更高[6],且脑卒中在工作和家庭方面对女性的压力更为明显。本研究未发现脑卒中诱因与脑损伤部位与脑卒中后抑郁之间的相关性。有研究发现,社会心理因素也是导致脑卒中患者出现抑郁的原因[23]。本研究结果显示,与子女同住的患者脑卒中后抑郁的比例更高。脑卒中后患者的劳动能力丧失,自理能力下降,认知及社交能力受损,因此必须和子女一起居住。患者居住地的迁移,特别是被迫迁移,使患者产生负性情绪[19],这可能与抑郁症存在相关性。
有研究显示,炎症因子和脑源性神经营养因子与脑卒中后抑郁存在相关性[24]。然而,本研究未发现炎症因子和脑源性神经营养因子与脑卒中后抑郁的相关性。此结论与既往研究[25]得出的结论不一致,但与陈晓莹等[26]的研究结论一致。由于本研究存在样本量较小、随访期短等局限,需进一步开展大型多中心随机对照研究。
目前,关于瘦素对抑郁症的作用仍存在争议。有研究发现,抑郁症患者的瘦素水平较高[27];也有研究显示,抑郁症患者和自杀未遂患者的瘦素水平较低[28]。本研究结果显示,出院后7 d和出院后1个月,脑卒中后抑郁组的血清瘦素水平明显高于单纯脑卒中组(P<0.01),而两组的炎症因子和脑源性神经营养因子水平比较差异无统计学意义(P>0.05),说明血清瘦素是与脑卒中后抑郁存在关联的唯一分子标志物,未发现炎症因子和脑源性神经营养因子与脑卒中后抑郁之间的联系。脑卒中后机体处于应激状态,下丘脑-垂体-肾上腺轴功能亢进,糖皮质激素分泌增加,从而促进脂肪组织中瘦素的合成及释放,导致脑卒中后血清瘦素水平升高,并通过血脑屏障与下丘脑等处的瘦素受体结合,然后通过Janus激酶-信号转导及转录活化因子等途径的信号转导,发挥瘦素的调节行为和能量平衡作用。此外,瘦素还具有保护神经、减少氧化应激等作用。众所周知,脑卒中后抑郁的发生和发展与5-羟色胺水平下降相关。5-羟色胺系统是控制食欲及情绪的主要通路,也是目前抗抑郁治疗的主要通路。而瘦素和5-羟色胺在分布及功能上有密切关系,提示瘦素与脑卒中后抑郁密切相关。
瘦素是发生脑卒中后抑郁的一个重要血清生物标志物。有研究显示,有抑郁症或情绪障碍病史的女性血清瘦素水平更高,但与女性的体质指数、年龄、吸烟、饮酒、运动无关;在5年的随访期内患抑郁症的女性中,瘦素水平升高预测女性患抑郁症的风险更高[6]。瘦素在能量平衡和炎症反应中起重要作用[29]。其通过调节下丘脑的食欲促进因子和食欲抑制因子来减少食物摄入。瘦素对于抑郁症的作用机制尚不明确,但瘦素参与下丘脑-垂体-肾上腺轴活动及糖皮质激素的关系已被证实。在抑郁症患者中,下丘脑-垂体-肾上腺轴系统功能亢进,糖皮质激素分泌增加,导致脑卒中后抑郁患者血清瘦素水平升高[30]。在抗抑郁治疗期间,下丘脑-垂体-肾上腺轴系统的变化与瘦素水平具有相关性[31]。神经营养因子在下丘脑中有重要的食物抑制作用,在维持调节与焦虑相关的行为,以及通过瘦素、胰岛素、葡萄糖来调节食物摄入的过程中有重要功能。本研究表明瘦素可能是标记脑卒中后抑郁的独立因素。脑卒中后抑郁会导致患者预后不良和死亡率增加,因此瘦素可能成为未来脑卒中后抑郁患者治疗的靶点。
综上所述,脑卒中患者出院后7 d与出院后 1个月的血清瘦素水平与脑卒中后抑郁存在明显相关性。这可能有助于发现新的治疗方案,但仍需进一步研究证实。然而,本研究也存在一定的局限性:①排除了严重言语障碍、意识水平损伤和严重脑卒中患者,这可能导致脑卒中后抑郁患病率降低。②随访期短,无法长期随访住院治疗对脑卒中后抑郁的影响。

