多系统萎缩合并抗利尿激素分泌不当综合征1例及文献复习
邱建美,申红霞,王德峰
(1.河北工程大学 临床医学院,河北 邯郸 056002;2.河北工程大学附属医院 内分泌科,河北 邯郸 056029)
多系统萎缩(multiple system atrophy,MSA)是主要累及椎体外系、小脑和自主神经系统的神经变性病,临床主要表现为帕金森综合征、小脑共济失调、自主神经功能障碍[1]。抗利尿激素分泌不当综合征(syndrome of inappropriate antidiuresis,SIAD)是指内源性抗利尿激素(antidiuretic hormone,ADH)分泌异常增多或作用增强,导致水潴留、尿排钠增多以及稀释性低钠血症等临床表现的一组综合征[2]。中枢神经系统疾病是导致SIAD的重要病因之一。目前关于MSA合并SIAD的临床报道罕见,对其临床表现、相互关系及发病机制尚认识不足。本研究通过回顾性分析河北工程大学附属医院收治的1例MSA合并SIAD患者的临床特征及诊疗经过,旨在为该病的临床诊断及治疗提供依据。
1 临床资料
患者男性,58岁,因“间断意识障碍伴咳嗽、咳痰1月余,再发2天”于2021年7月22日入院。1个月前无明显诱因间断出现意识障碍,表现为突然停止动作、双眼茫然凝视,持续数十秒后自行好转,偶有咳嗽、咳痰,无发热。于当地医院查白细胞计数、中性粒细胞百分比、降钙素原均未见异常,血钠127.1 mmol/L,胸部电子计算机断层扫描(computer tomography,CT)提示双肺炎性病变,给予补钠、抗感染治疗8天后意识好转,复查血钠135.1 mmol/L出院。出院后患者仍偶有咳嗽,有痰但不能咳出,体温曾升高至37.5 ℃,物理降温可降至正常。2天前患者再次出现上述意识障碍表现,1天前于外院门诊查血白细胞计数、中性粒细胞百分比未见异常,血钠113.1 mmol/L,胸部CT提示双肺炎性改变,为求进一步诊治收住我院内分泌科。既往病史:5年前因“急性尿潴留”,曾行手术治疗(具体不详),术后未再发生尿潴留。4年前因行走不稳,于当地医院诊断为“帕金森综合征”,给予口服“左旋多巴”治疗半年余未见效。1年前出现言语迟缓、体位性低血压,于北京某三甲医院就诊,行颅脑核磁共振成像(magnetic resonance imaging,MRI)检查提示“双侧额叶皮层下点状缺血灶,双侧侧脑室后角旁脑白质轻度脱髓鞘改变”,确诊为“MSA”,未予特殊治疗。近半年来言语明显减少,失去沟通能力,需靠外力辅助行走,多卧床,可自行翻身。入院体格检查:体温36.5 ℃,心率95次/min,呼吸20次/min,血压100/61 mmHg(1 mmHg=0.133 kPa)。意识清楚,精神萎靡。轮椅推入病房,被动体位。面具脸,言语迟缓、构音不清,可单字表达,睁闭眼示意。皮肤黏膜颜色正常,皮肤弹性正常。毛发分布正常。全身浅表淋巴结未触及肿大。双侧瞳孔正大等圆,对光反射灵敏,双侧眼球无突出,各向运动灵活,无震颤。咽无充血,扁桃体不大。甲状腺未触及肿大及结节。双肺呼吸音粗,可闻及广泛痰鸣音,无干啰音。心、腹未见明显异常。四肢肌力1级,肌张力减低,腱反射弱,双下肢巴彬斯基征阳性,双下肢无水肿。入院诊断:①重度低钠血症;②肺部感染;③MSA。
入院后患者间断发热,复查C-反应蛋白升高,白细胞计数、中性粒细胞百分比、降钙素原均正常;胸部CT示双肺多发炎性病变,左右主支气管内痰栓,双侧少量胸腔积液。经验性给予头孢他啶抗感染,3日后仍发热,痰培养未培养出致病菌,加用左氧氟沙星,入院7日后体温恢复正常(图1a),咳嗽、咳痰明显好转,入院16日复查胸部CT示炎症及胸腔积液完全吸收。
给予患者静脉联合口服补钠治疗1周后效果不佳,血钠为113.1~126 mmol/L(正常参考范围135~145 mmol/L)。考虑患者未长期应用利尿剂,无恶心、呕吐、脱水等表现,实验室检查无血液浓缩,排除利尿剂、肾外丢失、脑耗盐综合征等低容量性低钠血症。患者亦无水肿表现,心功能、肝功能、肾功能大致正常,排除心功能不全、肝硬化、肾功能衰竭等高容量性低钠血症。患者血浆渗透压为243.2 mOsm/(kg·H2O),考虑患者低钠血症类型为等容量性低渗性低钠血症。完善甲状腺功能、皮质醇节律试验、促肾上腺皮质激素测定均未见明显异常,24小时尿钠307.2 mmol/L,支持SIAD诊断。完善肿瘤标志物检测、颅脑CT、胸腹部CT均未提示占位性病变。经适当限水、补钠治疗后,血钠水平稳定在正常值下限(图1b),给予出院。出院后患者仍限水(每日入量约1 500 ml,尿量2 000 ml)、补钠(每日口服食盐胶囊4粒/次,3次/d,每粒食盐胶囊约含钠0.393 g),随访2个月一般情况良好,血钠水平在131~133 mmol/L。
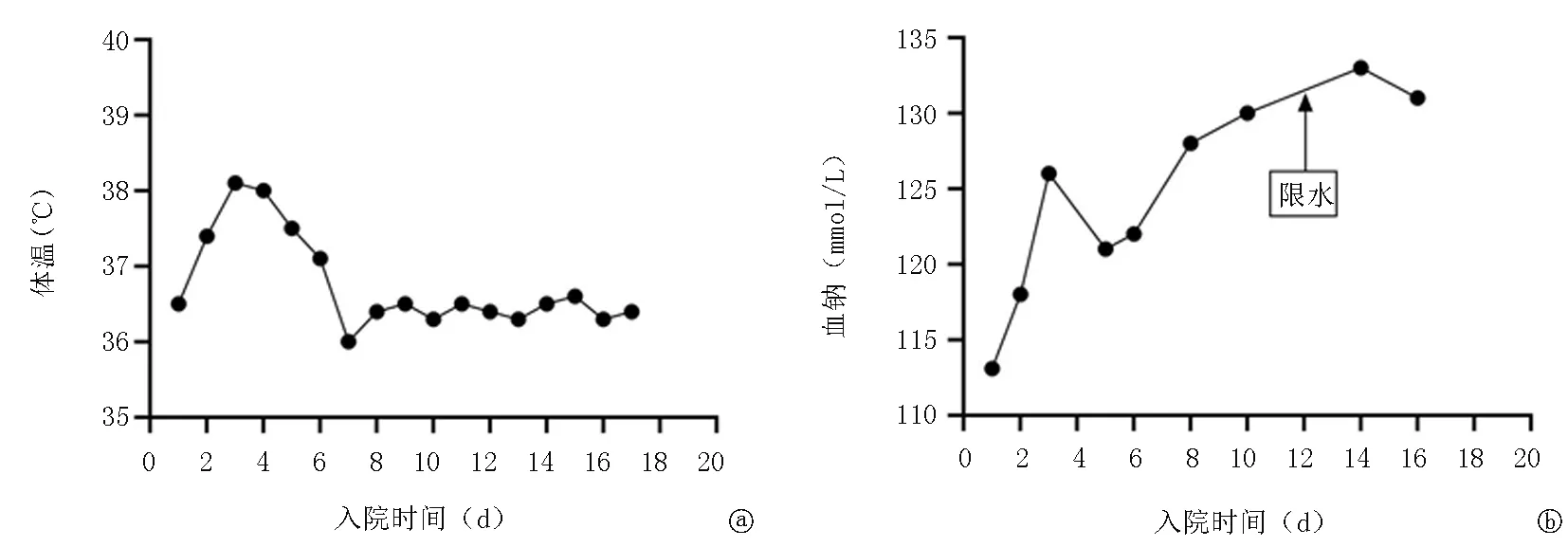
图1 入院后体温和血钠变化情况 a.体温;b.血钠
2 讨 论
ADH又称精氨酸加压素(arginine vasopressin,AVP),是由下丘脑视上核和室旁核神经细胞产生的九肽激素,作用于肾小管和集合管,是调节尿液浓缩和稀释的关键性激素[3]。SIAD指在没有肾脏或内分泌障碍的情况下,由于非生理性刺激(有效血浆渗透压升高或循环容量减少)产生AVP,导致游离水排出障碍,从而导致正常容量状态的低渗性低钠血症[2]。AVP不适当分泌可能是由于垂体释放增加或异位产生所致,也可能是由于集合管中的AVP活性增加或其2型受体功能改变所致[4]。SIAD是临床低钠血症的最常见原因,其病因大致可归类为恶性肿瘤(如小细胞肺癌)、肺部疾病(如肺部感染)、中枢神经系统疾病(如蛛网膜下腔出血、脑炎、吉兰巴雷综合征等)、药物治疗(如卡马西平)或其他原因(如感染、炎症和术后状态)[5]。目前SIAD的诊断标准[6]为:(1)有效血浆渗透压<275 mOsm/kg;(2)尿渗透压>100 mOsm/kg;(3)血容量正常;(4)尿钠浓度>30 mmol/L;(5)没有肾上腺、甲状腺、垂体或肾功能不全。一旦确诊为SIAD,并排除了肾上腺功能不全,应尽快查找SIAD的潜在病因[6]。尽管几乎无证据表明限制液体比安慰剂增加血钠浓度效果好,且对所需限制液体量无确切指南推荐,但限水仍是目前指南的一线推荐疗法[4]。
MSA是一种散发性、进行性、成人起病的神经退行性疾病,临床表现为自主神经功能障碍和(或)帕金森综合征和(或)小脑共济失调[7]。根据主要运动症状,分为两种临床表型:以小脑共济失调为主的MSA(MSA-C)和以帕金森综合征为主的MSA(MSA-P)[8]。MSA发病机制尚不完全清楚,病理学特征是α-突触核蛋白组成的少突胶质细胞胞浆内包涵体形成[1]。当前诊断采用MSA的第二个诊断共识标准[9],主要是基于临床特征、MRI、正电子发射计算机断层扫描和单光子发射计算机断层扫描进行辅助诊断。目前尚缺乏有效的治疗方法,主要以对症治疗为主[10]。
迄今为止,关于MSA合并SIAD致低钠血症的报道少见,首次见于1992年Nagumo等[11]报告的Shy-Drager综合征伴SIAD案例,随后Samukawa等[12]报告了7例相似病例。在我国,谢曼青等[13]曾报告3例MSA合并SIAD,其中可疑嗜肺军团菌感染1例,抗感染后仍存在较长时间的低钠血症;合并重症肺部感染1例,感染控制后血钠迅速恢复正常水平;顽固性低钠血症1例。苏停停等[14]报告1例MSA合并SIAD,患者有无汗、体温随环境温度变化等体温调节中枢受损的临床表现,且肺部感染治愈后SIAD持续存在,故考虑MSA可能为其病因。本例患者排除了恶性肿瘤、药物、颅脑外伤、脑膜炎、脑血管意外、脑水肿等可致SIAD因素,且肺部感染治愈后,随访2个月仍持续存在SIAD,故考虑SIAD可能为其原发病MSA所致。苏停停等[14]对其自身报道的(1例)及既往文献报道的(11例)共计12例MSA合并SIAD患者的临床特征进行了总结(表1),其中合并肺部感染4例,结合本研究患者亦合并肺部感染,推测肺部感染可能是MSA患者发生SIAD的易感因素。虽然MSA合并SIAD临床罕见,但应加强对MSA患者,尤其是合并肺部感染患者的水电平衡管理。本研究报道病例与苏停停等[14]报道的病例相似之处还表现在,虽然合并感染,但诊治过程中白细胞计数、中性粒细胞百分比、降钙素原均未见明显异常。提示MSA患者合并感染时,可能出现感染指标阴性可能,这在一定程度上可能会给抗感染治疗带来困难。
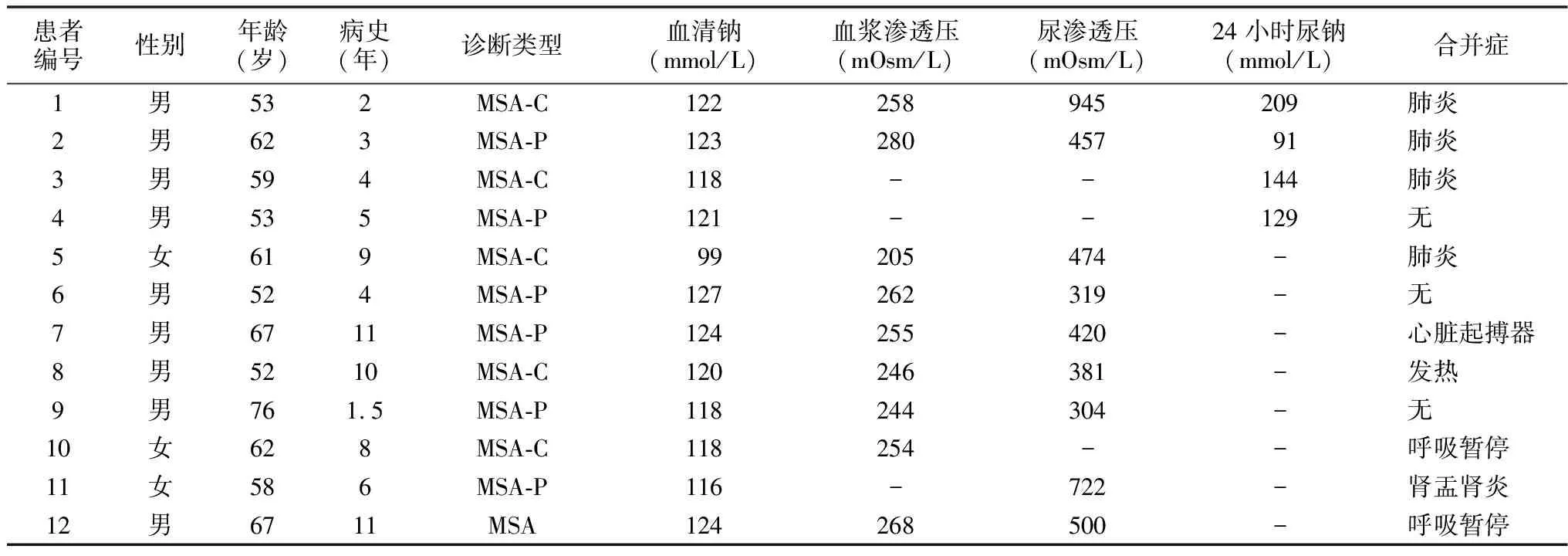
表1 文献报道的12例MSA合并SIAD患者的临床资料[14]
由于MSA无特效治疗方法,因此针对MSA合并SIAD的治疗,主要为去除诱因和保持水钠平衡。当前治疗SIAD的方法包括限制液体、静脉注射盐溶液、口服钠补充剂、口服袢利尿剂、口服尿素、口服地美环素、口服AVP受体拮抗剂(托伐普坦)等[2]。对于轻至中度低钠血症患者,尽管没有任何随机对照试验证明限制液体的有效性及安全性,但限制液体仍是目前公认的一线治疗方法;而二线治疗方法,如利尿剂、尿素、地美环素、AVP受体拮抗剂,仍存在很大争议[6]。为了使限制液体疗效更好,国外有学者建议,在限制所有液体的前提下,液体每日摄入量应限制在小于每日尿量的500 ml以内[6]。国内学者推荐,轻至中度SIAD患者每天摄入量限制在不显性丢失和尿液排出量的总和之下(0.8~1.0 L)[15]。值得注意的是,当该类患者合并感染或完全依赖胃肠外营养时,限制液体可能不利于病情恢复。因此,应结合患者的具体病情,采取个体化治疗方案。笔者认为,对于慢性失钠的患者,长期适量口服钠补充剂(如食盐胶囊)可能为一种更安全、有效、经济的治疗方案。但需要高质量的随机对照试验来证明。
MSA合并SIAD的具体机制尚未明确。有学者认为,可能与脑干对下丘脑的传入刺激减弱有关,从而导致下丘脑抗利尿激素能神经元超敏化,引起ADH分泌增多[15-17]。由肺部感染引起SIAD的确切病理生理机制亦不清楚,可能与炎症刺激压力感受器、肺静脉回流减少以及缺氧或高碳酸血症有关[18]。而MSA、肺部感染、SIAD之间的复杂关系尚待深入研究。
综上所述,MSA可能是SIAD的病因,而肺部感染可能是MSA合并SIAD的易感因素。对MSA患者,尤其是合并肺部感染的应加强水钠平衡管理。

