慢性HBV感染不确定期患者的临床治疗现状及展望
0 引言
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是影响世界公共卫生的重大问题.根据世界卫生组织的报告,2015年全球约有2.57亿人(占全球人口的3.5%)长期感染HBV,乙肝表面抗原(hepatitis B virus surface antigen,HBsAg)的全球流行率约为3.9%
,其中每年约有100万人死于HBV相关并发症,而因肝硬化、肝癌死亡的患者约占为90%
.据估计,目前中国一般人群中HBsAg的患病率为5%-6%,约有7000万人感染了慢性HBV,其中约有2000-3000万是慢性乙型肝炎(chronic hepatitis B,CHB)患者.此外,我国确诊的肝硬化及肝细胞癌(hepatocellular carcinoma,HCC)的患者,由HBV感染所致者分别占据77%及84%
.尽管在过去的三十年,我国乙肝疫苗高接种率在抑制HBV的传播中起到了很大的作用,但目前的一线抗病毒治疗药物-长效干扰素和核苷(酸)类似物都不能直接清除肝细胞核内的共价闭合环状脱氧核糖核酸(deoxyribonucleic acid,DNA),因此要完全消除慢性HBV感染对全球生命健康的威胁,仍然是一个巨大的挑战
.虽然我国《慢性乙型肝炎防治指南(2019年版)》
和《扩大慢性乙型肝炎抗病毒治疗的专家意见(2022年版)》
更新了抗病毒治疗指征,但临床上仍有一部分患者尚未纳入现有指南抗病毒指征,并且在长期的随访过程中进展为肝硬化、肝癌.
选取2016年1月至2016年12月于我院进行CIN筛查的125例患者为研究对象,研究对象年龄20~55岁,平均年龄(41.06±6.29)岁。
1 慢性乙型肝炎自然病程分期
慢性HBV感染是指血清HBsAg阳性和(或)HBV DNA阳性6 mo以上,CHB是指由慢性HBV感染引起的肝脏炎症性疾病.根据HBV、肝细胞和患者免疫系统之间相互作用的动态状态,慢性HBV感染的自然病程通常为免疫耐受期(亦称慢性HBV携带状态)、免疫清除期[亦称乙肝e抗原(hepatitis B virus e antigen,HBeAg)阳性CHB]、免疫控制期(亦称非活动性HBsAg携带状态)和再活动期(亦称HBeAg阴性CHB)四个阶段.分期标准基于以下标记物:丙氨酸氨基转移酶(alanine aminotransferase,ALT),HBV DNA、HBeAg,HBsAg以及疾病活动情况
.2018年美国肝病研究学会(American Association for the Study of Liver Diseases,AASLD)将CHB诊断标准定义为HBsAg阳性大于6 mo,血清HBV DNA从不可测至大于10
IU/mL不等,ALT和(或)天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平持续正常或升高,肝活检表现为伴不同程度的慢性肝脏坏死性炎症和(或)纤维化.同时将CHB的自然病程命名为:免疫耐受期、HBeAg阳性CHB期、非活动性CHB、HBeAg阴性CHB期
.2017年欧洲肝病研究学会(European Association for the Study of the liver,EASL)增加了一个分期-隐匿性HBV感染(HBsAg阴性阶段),此外基于“慢性”的两个主要特征-感染或肝炎,同时根据HBeAg的状态、HBV DNA水平、ALT值,将乙肝自然病程定义为以下五个阶段:HBeAg阳性的慢性HBV感染、HBeAg阳性的CHB、HBeAg阴性的慢性HBV感染、HBeAg阴性的CHB以及隐匿性HBV感染
.
对慢性HBV感染自然史的研究发现,母婴垂直传播或幼年期感染HBV后,绝大多数感染者会出现免疫耐受,即ALT正常、HBeAg阳性、HBV DNA持续高水平,无明显坏死性炎症和肝纤维化.随着时间的推移,这种免疫耐受状态会自发地完全或不完全被打破而出现免疫清除,伴肝组织炎症、免疫损伤,导致疾病逐渐进展,甚至进展或隐匿进展为肝硬化或肝细胞癌.目前AASLD、EASL等地区指南均建议对HBeAg阳性CHB期、HBeAg阴性CHB期患者进行抗病毒治疗,以降低肝硬化和肝癌的发病率;而对HBeAg阳性和HBeAg阴性的慢性HBV感染期患者,未建议直接抗病毒治疗,建议长期随访,定期监测ALT、HBV DNA水平,必要时行肝活检
.
2 不属于传统分期的不确定期患者
2.1 不确定期定义 值得注意的是,一部分患者不属于上述任何一个分期.2017年EASL指出,慢性HBV感染是一种动态变化的疾病,即使对HBeAg、ALT、HBV DNA进行连续检测,也存在一些慢性HBV感染患者处于不属于任何一个常见分期的灰区(grey area)
.庄辉院士提议将这种情况称为不确定期,是否需要治疗需要个性化管理
.近年来关于慢性HBV感染不确定期的讨论也越来越多.
与此同时,与同行业公司毛利率比较来看,报告期内同行业公司平均毛利率分别为61.81%、60.07%、52.68%,米奥会展的毛利率显著低于行业平均,一定程度上反映其在行业内竞争力不足。
4.3.2 免疫控制期相关的不确定期存在疾病进展:越来越多的研究表明
,高水平的HBV DNA与肝硬化、肝细胞癌发生风险相关.根据我国指南
,HBV DNA<2000 IU/mL是区分HBeAg阴性CHB患者处于非活动期的一个重要指标.有报道
,在2006-2013间对慢性HBV感染的大型队列研究中发现不确定期中有9%的患者会进展为肝硬化.一项回顾性研究中发现
,2009年至2018年间接受肝活检的327例HBeAg阴性,正常ALT(≤ULN,40 U/L),HBV DNA≥2000 IU/mL组发生肝坏死性炎症(≥G2)和纤维化(≥F2)的比例显著高于HBV DNA<2000 IU/mL的患者.另一项研究也发现在HBeAg阴性,ALT正常(≤ULN,40 U/L)慢性HBV感染患者中,2000≤HBV DNA≤20000 IU/mL比HBV DNA<2000 IU/mL的患者进展为晚期肝病(≥F2)的比例更高
.以上数据表明与免疫控制期相关的不确定期患者其疾病进展的风险相比于真正的免疫控制期患者更高,更应该引起我们的关注.
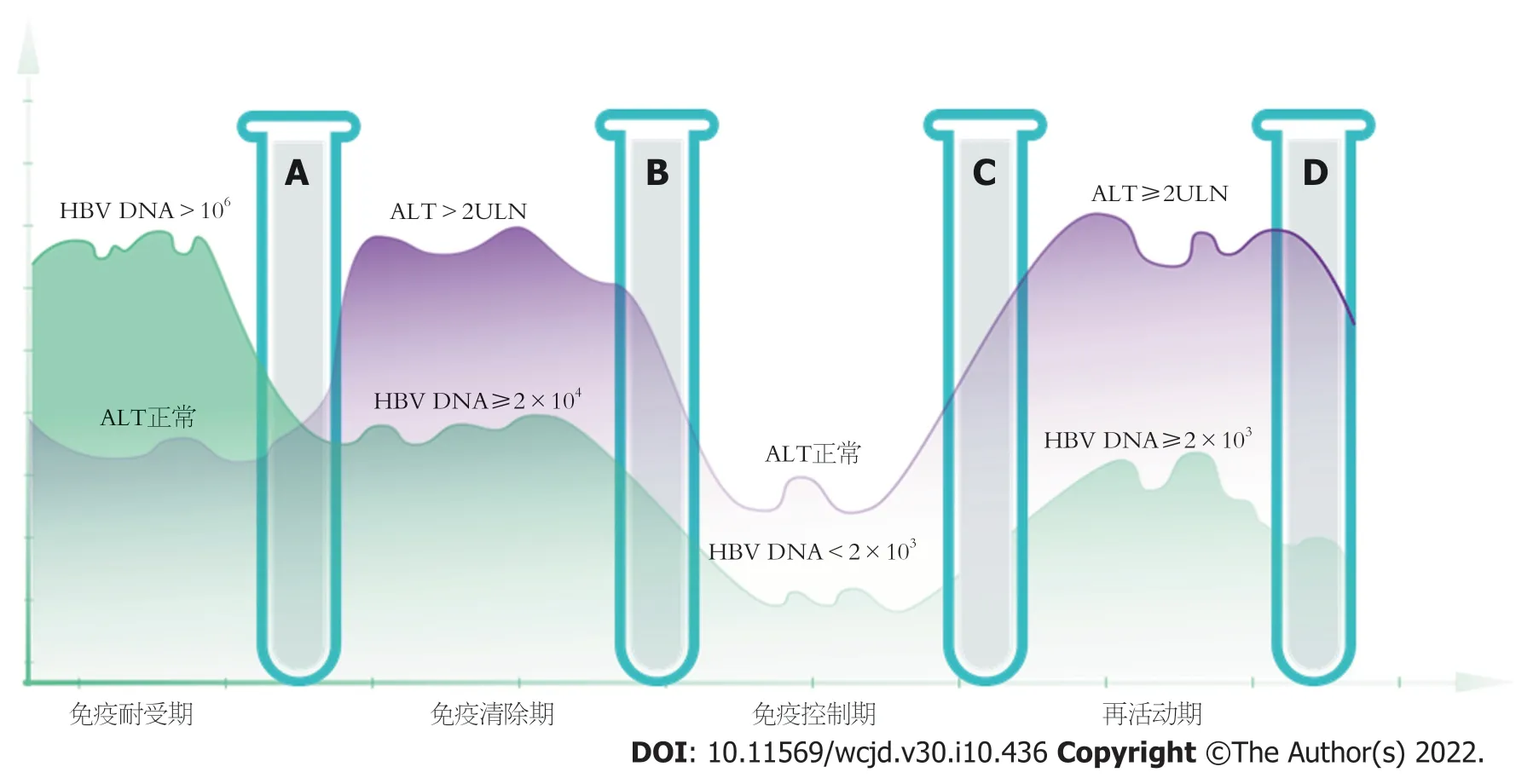
慢性乙型肝炎自然病程分期受到患者HBV DNA、ALT、HBeAg状态以及肝脏组织学的严格限定,而上述指标容易受到机体免疫状态、合并其他慢性肝病(如非酒精性脂肪性肝病)、检测精度、实验误差等多方面因素影响,但凡出现某一项检测结果的异常,便有可能无法纳入分期,所以目前提出“不确定期”是很有必要的,学术界展开了广泛讨论.2021年,庄辉院士发表的《不确定期慢性乙型肝炎应否治疗?》
一文中,将不确定期CHB定义为:初治慢性HBV感染者随访1年,其乙肝DNA和ALT模式不同于4个传统慢性HBV感染分期,同时参考2018年AASLD指南
,将不属于任何一个常见分期的不确定期患者分为以下四组:(1)免疫耐受期相关不确定期:其余指标符合免疫耐受期,但HBV DNA<10
IU/mL或肝脏有显著炎症和纤维化;(2)免疫清除期相关不确定期:其余指标符合免疫清除期,但HBV DNA<2×10
IU/mL或ALT 1-2倍正常值上限(the upper limits of normal,ULN);(3)免疫控制期相关不确定期:其余指标符合免疫控制期,但HBV DNA>2×10
IU/mL或有显著炎症和纤维化;(4)再活动期相关不确定期:其余指标符合再活动期,但HBV DNA<2×10
IU/mL或ALT 1-2 ULN.(图1).
2.2 不确定期患者存在疾病进展 研究发现
,不确定期CHB患者的肝癌风险是非活动性患者的14倍.一项来自南京鼓楼医院的报道,767例不确定期患者中,使用APRI和FIB-4评分发现77例(10.0%)患者有进展性疾病
.另一项回顾性研究中
,将未经治疗、HBV DNA持续>2000 IU/mL,而其他指标不符合2018 AASLD抗病毒要求的这部分患者定义为轻微活性CHB,在平均75.1 mo的随访中发现这部分患者肝癌发生率明显大于免疫控制期.以上数据表明,在慢性HBV感染的自然病程中的这部分未经治疗的不确定期患者存在疾病进展,而抗病毒治疗能够改善预后,减少肝癌发生率.目前,由于不确定期患者的肝组织损伤程度和长期预后尚不明确,国际上,对于这部分患者是否启动抗病毒治疗仍无明确意见,需要更多研究来评估抗病毒治疗的成本效益,为不确定期患者的治疗和管理提供更加完善的指导.
According to the Japanese guidelines on the gastric cancer treatment issued by JGCA (2011)[13], the algorithm of surgical treatment in patients with GC is as follows (Figure 7).
医院收入主要来源于门诊住院收入,对货币资金的控制重点在门诊住院预交金的内部控制上,除了做到日结月清,上交金额与报表金额一致,还应加强收费系统内预交金发生额和余额的审核,并与会计核算系统匹配一致,做到预交金收入、冲销、退出明细账金额与会计核算系统中预交金账户借方、贷方发生额相等,收费系统中预交金账户总余额、病人账户余额明细总额、会计核算系中预交金余额三相符。实现账账相符、账实相符,形成完整的链条,确保资金安全。
3 免疫控制期
3.1 免疫控制期的定义 2019版中国慢乙肝防治指南对免疫控制期定义如下:HBeAg阴性,HBV DNA<2000 IU/mL,HBsAg一般为低水平(<1000 IU/mL),ALT水平持续正常,没有或仅有轻微肝脏损伤的慢性HBV感染
.在免疫控制期患者中,肝脏损伤并不常见,目前AASLD、亚太肝脏研究协会,对于ALT正常且HBV DNA<2000 IU/mL的HBeAg阴性患者,未主张抗病毒治疗,建议定期监测HBV DNA和ALT水平,至少一年时间,或进行肝活检
.
研究发现在不确定期患者中,免疫耐受期、HBeAg阳性CHB、免疫控制期、HBeAg阴性CHB相关的不确定期患者分别占13.92%、7.79%、24.73%、53.56%
.其中,HBeAg阳性(免疫清除期)或阴性CHB(再活动期)相关的不确定期,符合我国2019年版本慢乙肝防治指南推荐意见6:血清HBV DNA阳性、ALT持续异常(>ULN)且排除其他原因所致者,建议抗病毒治疗
,因此本文不再讨论.2021年庄辉院士等专家在《临床肝胆病杂志》所设专栏中,对慢性HBV感染免疫耐受期应否进行抗病毒治疗进行了深入讨论,同时建议扩大对免疫耐受期CHB的治疗,并开展相关研究,以提供更多的循证医学证据
.而免疫控制期及与其相关的不确定期是否需要抗病毒治疗暂未被指南涵盖,目前相关研究较少,因此本文将重点讨论.
4.2 免疫控制期相关的不确定期不建议抗病毒的理由 有学者对处于免疫控制期及与其相关不确定期的287名患者中位随访8.2年,其中不确定期患者中仅18例(6.3%)出现HBeAg阴性CHB,没有患者出现肝硬化或进展性肝纤维化,其中1名感染了C型基因型的亚洲不确定期患者在没有肝硬化的情况下发生了肝癌
.另一项对246名持续ALT<40 U/L,HBeAg阴性HBV DNA≤20000 IU/mL的患者进行肝活检的研究发现,10%的患者存在轻度及轻度以上的肝脏坏死性炎症活动,8%的患者有轻度及轻度以上的肝纤维化,无肝硬化患者
.在一项长期前瞻性随访研究中发现,免疫控制期不确定期患者预后良好,五年内有54.3%的患者仍处于此期,43.5%的患者转变为免疫控制期,仅2.2%的患者转变为HBeAg阴性CHB
.
3.2 免疫控制期患者的治疗现状 2021年我国对4759名初治的CHB患者研究显示,大约有36.08%的患者可以归于免疫控制期
.既往观念认为该期患者病毒处于低复制水平,肝脏一般没有显著的炎症或纤维化,疾病进展速度缓慢.但最近的一些研究结果显示,HBeAg阴性、ALT水平持续正常的患者,即使是病毒载量较低(HBV DNA<2000 IU/mL),仍有30%-50%可能存在显著肝脏组织学改变,甚至发生肝硬化和肝细胞癌
.这意味着传统意义上的“免疫控制期”可能存在活动性肝病,仅用ALT和HBV DNA水平来定义HBeAg阴性慢性HBV感染,可能会遗漏部分具有显著肝脏组织学改变的不确定期患者
.虽然肝活检被认为是评估肝组织病理学的金标准
,然而在临床上,由于肝脏组织学的动态改变以及反复肝活检的风险和成本等原因,定期进行肝活检难以实现
.
4.1 免疫控制期相关不确定期定义 2017年EASL指出部分免疫控制期患者的HBV DNA水平可能在2000 IU/mL-20000 IU/mL之间波动
.另外,2018年AASLD也指出,在对HBeAg阴性患者的动态监测中发现,有一部分患者HBV DNA、ALT介于免疫控制期和HBeAg阴性CHB之间的灰区
.这表明存在与免疫控制期相关的不确定期:HBeAg阴性,ALT
.为改善不确定期患者不良临床预后,这部分患者是否进行需要抗病毒治疗值得进一步讨论.

4 免疫控制期相关不确定期
最近的研究表明,免疫控制期的患者也可以达到较高的病毒学应答.一项对123名HBeAg阴性的ALT正常或轻度升高的慢性HBV感染患者进行肝活检的研究中发现,51.19%的患者G≥2和/或S≥2,对这部分患者进行抗病毒治疗,72 wk时病毒学应答率为90.7%,同时肝活检发现,抗病毒治疗也有效地改善了患者的肝纤维化、肝硬化程度
.另外,在一项使用聚乙二醇干扰素联合阿德福韦酯治疗免疫控制期患者的前瞻性队列研究中发现,96 wk时HBsAg清除率和血清转换率分别达到45.2%和38.5%,明显高于未经治疗组,且安全性良好
.我们团队使用富马酸丙酚替诺福韦对免疫控制期患者进行抗病毒治疗,结果显示疗效十分显著,12 wk的病毒学应答率甚至达到了100%
.目前,免疫控制期患者抗病毒治疗的数据有限,但考虑到HBV DNA的存在会增加肝硬化和肝癌的风险,而抑制乙肝病毒可以改善远期预后,降低肝病相关不良事件的发生率.2017年EASL建议HBeAg阴性慢性HBV感染合并肝硬化或肝癌家族史,或有肝外表现时可进行抗病毒治疗
.我国2022年《扩大慢性乙型肝炎抗病毒治疗的专家意见》
建议,对于血清HBV DNA阳性者,无论ALT水平高低,将有乙型肝炎肝硬化或HCC家族史,年龄>30岁作为独立的抗病毒指征(表1).当前考虑到免疫控制期患者仍存在疾病进展的可能,国内外指南对该期的抗病毒指征已有不断放宽的趋势,但仍有一定数量的患者在治疗指征之外,这部分人群的自然预后以及抗病毒疗效受到了愈来愈多地关注.
英有时候也老在想,其实死亡也并不是那么可怕,还有什么伤痛自己无法承受呢?死亡,也许不是那么无比漫长,它可能是一念之间,或者就顺其自然地睡着了,自己必须从容应对。因为,等到死亡真的来临时,害怕与悲伤都是徒劳的。
基于以上研究,部分学者认为处于免疫控制期相关的不确定期患者,机体内病毒处于低复制水平,一般无活动性肝炎,疾病一般无进展,不良事件发生率低;此外由于长期口服抗病毒药物带来的经济负担,以及药物可能存在的耐药风险及毒副作用,不推荐抗病毒治疗,而是定期随访.
4.3 免疫控制期相关的不确定期抗病毒理由
4.3.1 不确定期患者的免疫状态:传统观念认为,不确定期患者不具有免疫活性,不需要抗病毒治疗.然而一项对慢性HBV感染中自然杀伤细胞抗病毒能力的研究表明,由HBeAg、ALT、HBV DNA定义的不确定期并不能准确反映真正的免疫状态.事实上,不确定期患者自然杀伤细胞仍保留着免疫功能,并且他们对抗病毒治疗的反应可能与免疫活性CHB相似.这表明,早期启动不确定期患者的抗病毒治疗或许能够诱导真正的免疫控制,避免不良预后
.
在一项CHB研究的队列中,36.6%的患者处于不确定期
.对1390名CHB患者进行的研究显示,近38%的患者不属于慢性HBV感染的四期,并被视为不确定期患者
.最近一项大型研究也显示,在未经治疗的CHB患者中,有36.08%处于非活动期,只有4.9%为HBeAg阳性慢性HBV感染,有27.88%不属于常见的四种免疫状态,被认为是不确定期,需定期监测ALT、HBV DNA或肝组织活检
.来自美国和台湾的报道,3366名未经治疗的非肝硬化CHB患者的队列中,38.7%的患者处于不确定期,这些患者在第10年时仍有52.7%处于不确定期,21.7%出现免疫活性
.一项来自非洲的队列研究发现,120名未接受治疗慢性HBV感染的个体中,2.5%被归类为免疫耐受期,11.7%患者为免疫活性CHB,35.6%为免疫控制期患者,而46.7%处于不确定期,需要临床随访
.对2006年至2013年1598名慢性HBV感染的队列研究也发现,886名(55%)患者处于不确定期
.以上研究表明,慢性HBV感染不确定期患者的占比不等,一般在20%-50%左右,这对目前慢性乙型肝炎自然病程分期提出了挑战.
4.3.3 免疫控制期相关的不确定期抗病毒效果明显:研究发现
,HBeAg阴性,ALT正常(
.在一项5414名HBeAg阴性慢性HBV感染的回顾性队列研究中发现,未经治疗的HBeAg阴性、ALT无明显升高,HBV DNA>2000 IU/mL的患者肝癌、肝移植/死亡发生风险分别是使用口服核苷(酸)类似物治疗的再激活期患者1.76倍和2.14倍
.这些研究结果表明HBeAg阴性的慢性HBV感染患者,根据血清HBV DNA水平,在ALT升高之前进行早期抗病毒干预,可以有效预防肝癌和肝移植/死亡的发生.我们团队最近对ALT正常,HBV DNA>2000 IU/mL,大多为HBeAg阴性患者的研究表明
,富马酸丙酚替诺福韦抗病毒治疗24 wk后的完全病毒学应答率高达94.4%.因此,我们不仅要根据HBV DNA和ALT水平对疾病活动进行持续的评估,还要注意潜在的肝组织损伤可能
.同时,根据我国最新版《扩大慢性乙型肝炎抗病毒治疗的专家意见》(2022年),不确定期CHB疾病进展的风险仍然较高,应积极对这部分患者进行抗病毒治疗
.虽然进一步扩大抗病毒指征是目前管理和治疗慢性CHB患者的趋势,目前仍需要大量相关研究为免疫控制期及与其相关的不确定期患者的治疗提供更多的循证医学证据.
5 启动抗病毒治疗的ALT阈值是否需要下调?
使用不同指南定义的ALT正常值上限对慢性HBV感染患者免疫状态的分期存在影响,下调ALT正常值上限会进一步增加免疫控制期相关不确定期的人群抗病毒治疗,如何定义启动抗病毒治疗的ALT阈值目前仍存在一些争议
.一项对153名慢性HBV感染研究发现,ALT ULN定为40 U/L时不确定期患者所占比例为36.6%,而ALT ULN调整下降至男性30 U/L、女性19 U/L时,28.1%的患者出现分期变化,其中72.1%(31/43人)的患者从免疫耐受期不确定期转变为免疫清除期和再激活期,这提示下调ALT阈值在确定需要抗病毒治疗方面更为敏感
.
大约五分之一的ALT≤40 U/L 的CHB患者可能有明显的肝纤维化
.一项回顾性研究发现,70.8%的初治慢性乙型肝炎合并肝癌患者为HBeAg阴性患者,超过20.0%的患者HBV DNA水平较低,ALT水平正常
.也有研究发现HBeAg阴性,ALT正常(≤ULN,40 U/L)的患者中,ALT(>20 U/L)组发生显著肝纤维化的患者明显高于ALT(≤20U/L)组
.另外一项研究发现ALT为0.5-1.0 ULN的CHB患者发生肝脏组织显著改变(HAI(炎症)≥4分,Ishak(纤维化)≥F3)的人数明显多于ALT≤0.5 ULN的患者,分别为40.0%和16.6%
.在192名接受肝活检的慢性HBV感染的队列研究也发现,ALT持续正常的( . 以上研究均表明ALT较高的患者相较ALT较低的患者疾病进展的风险更大,临床启动抗病毒治疗的ALT阈值需要进一步评估和调整.我们最近的研究观察到富马酸丙酚替诺福韦对ALT<40 U/L的慢性HBV感染患者具有明显疗效 .我国《ALT持续正常的慢性HBV感染者诊疗专家共识》和《扩大慢性乙型肝炎抗病毒治疗的专家意见》指出对于血清 HBV DNA阳性,ALT持续高于治疗阈值(男性30 U/L、女性19 U/L),1年内连续随访3次以上,每次至少间隔3 mo,且排除其他原因所致者,建议抗病毒治疗 .综上,下调启动抗病毒治疗的ALT阈值,能够扩大抗乙肝病毒人群,减少慢性HBV感染患者的肝病相关风险. 通过“微课”混合式教学模式的引入课堂,课堂上,学生的注意力明显集中,调动了学生的学习兴趣和积极性,大部分同学主动完成学习任务,整体学习氛围浓厚。 慢性HBV感染自然病程通常分为免疫耐受期、免疫清除期、免疫控制期、再活动期.然而,一部分患者不属于上述任何一个分期,被定义为不确定期,存在疾病进展的可能.研究发现,免疫控制期及与其相关的不确定期仍有发生肝硬化和肝癌的风险.传统意义上的“非活动性携带者”并非全部处于真的免疫控制状态,即使ALT正常、HBV DNA<2000 IU/mL仍然有可能存在肝炎活动,故积极推荐行肝活检,对于有明显肝脏组织改变(G≥2和/或S≥2)的患者进行抗病毒治疗.目前的研究表明,与免疫控制期相关不确定期的患者疾病进展较免疫控制期患者更加显著,使用抗病毒药物对这部分不确定期患者是安全而有效的,及早抗病毒治疗能够减少肝硬化、肝癌发生的风险,改善患者的预后.另外,通过降低抗病毒治疗的ALT阈值,扩大抗病毒的慢性HBV感染人群,同样能够达到这一目的.综上所述,扩大抗病毒适应症是一种趋势,然而,目前关于免疫控制期及与其相关不确定期的抗病毒治疗研究较少,需要更多的研究为进一步扩大抗病毒治疗提供循证医学证据. 1 Polaris Observatory Collaborators.Global prevalence,treatment,and prevention of hepatitis B virus infection in 2016:a modelling study. 2018;3:383-403 [PMID:29599078 DOI:10.1016/S2468-1253(18)30056-6] 2 WHO.Hepatitis B.2021.Available from:https://www.who.int/news-room/fact-sheets/detail/hepatitis-b 3 中华医学会感染病学分会,中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版).临床肝胆病杂志 2019;35:2648-2669[DOI:10.3969/j.issn.1001-5256.2019.12.007] 4 Liu J,Liang W,Jing W,Liu M.Countdown to 2030:eliminating hepatitis B disease,China. 2019;97:230-238 [PMID:30992636 DOI:10.2471/BLT.18.219469] 5 Chinese Society of Hepatology,Chinese Medical Association.[Expert opinion on expanding anti-HBV treatment for chronic hepatitis B]. 2022;30:131-136[PMID:35359064 DOI:10.3760/cma.j.cn501113-20220209-00060] 6 Liaw YF.Natural history of chronic hepatitis B virus infection and long-term outcome under treatment. 2009;29 Suppl 1:100-107 [PMID:19207972 DOI:10.1111/j.1478-3231.2008.01941.x] 7 Terrault NA,Lok ASF,McMahon BJ,Chang KM,Hwang JP,Jonas MM,Brown RS Jr,Bzowej NH,Wong JB.Update on prevention,diagnosis,and treatment of chronic hepatitis B:AASLD 2018 hepatitis B guidance. 2018;67:1560-1599[PMID:29405329 DOI:10.1002/hep.29800] 8 European Association for the Study of the Liver.European Association for the Study of the Liver.EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. 2017;67:370-398 [PMID:28427875 DOI:10.1016/j.jhep.2017.03.021] 9 庄辉.不确定期慢性乙型肝炎应否治疗?临床肝胆病杂志 2021;37:2033-2036 [DOI:10.3969/j.issn.1001-5256.2021.09.007] 10 Hsu YN,Pan CQ,Abbasi A,Xia V,Bansal R,Hu KQ.Clinical presentation and disease phases of chronic hepatitis B using conventional versus modified ALT criteria in Asian Americans. 2014;59:865-871 [PMID:24519522 DOI:10.1007/s10620-014-3054-1] 11 Di Bisceglie AM,Lombardero M,Teckman J,Roberts L,Janssen HL,Belle SH,Hoofnagle JH;Hepatitis B Research Network(HBRN).Determination of hepatitis B phenotype using biochemical and serological markers. 2017;24:320-329 [PMID:27917600 DOI:10.1111/jvh.12643] 12 Yao K,Liu J,Wang J,Yan X,Xia J,Yang Y,Wu W,Liu Y,Chen Y,Zhang Z,Li J,Huang R,Wu C.Distribution and clinical characteristics of patients with chronic hepatitis B virus infection in the grey zone. 2021;28:1025-1033 [PMID:33797145 DOI:10.1111/jvh.13511] 13 Huang DQ,Li X,Le MH,Le AK,Yeo YH,Trinh HN,Zhang J,Li J,Wong C,Wong C,Cheung RC,Yang HI,Nguyen MH.Natural History and Hepatocellular Carcinoma Risk in Untreated Chronic Hepatitis B Patients With Indeterminate Phase. 2021 [PMID:33465482 DOI:10.1016/j.cgh.2021.01.019] 14 Vinikoor MJ,Sinkala E,Kanunga A,Muchimba M,Nsokolo B,Chilengi R,Wandeler G,Mulenga J,Chisenga T,Bhattacharya D,Saag MS,Foster G,Fried MW,Kelly P.Chronic hepatitis B virus monoinfection at a university hospital in Zambia. 2018;10:622-628 [PMID:30310540 DOI:10.4254/wjh.v10.i9.622] 15 Spradling PR,Xing J,Rupp LB,Moorman AC,Gordon SC,Teshale ET,Lu M,Boscarino JA,Schmidt MA,Trinacty CM,Holmberg SD;Chronic Hepatitis Cohort Study Investigators.Distribution of disease phase,treatment prescription and severe liver disease among 1598 patients with chronic hepatitis B in the Chronic Hepatitis Cohort Study,2006-2013. 2016;44:1080-1089 [PMID:27640985 DOI:10.1111/apt.13802] 16 Lee HW,Kim SU,Baatarkhuu O,Park JY,Kim DY,Ahn SH,Han KH,Kim BK.Progression of Untreated Minimally Active Chronic HBV Infection Compared to Inactive Infection. 2019;17:2808-2810.e2 [PMID:30639778 DOI:10.1016/j.cgh.2019.01.002] 17 Terrault NA,Bzowej NH,Chang KM,Hwang JP,Jonas MM,Murad MH;American Association for the Study of Liver Diseases.AASLD guidelines for treatment of chronic hepatitis B. 2016;63:261-283 [PMID:26566064 DOI:10.1002/hep.28156] 18 Sarin SK,Kumar M,Lau GK,Abbas Z,Chan HL,Chen CJ,Chen DS,Chen HL,Chen PJ,Chien RN,Dokmeci AK,Gane E,Hou JL,Jafri W,Jia J,Kim JH,Lai CL,Lee HC,Lim SG,Liu CJ,Locarnini S,Al Mahtab M,Mohamed R,Omata M,Park J,Piratvisuth T,Sharma BC,Sollano J,Wang FS,Wei L,Yuen MF,Zheng SS,Kao JH.Asian-Pacific clinical practice guidelines on the management of hepatitis B:a 2015 update. 2016;10:1-98 [PMID:26563120 DOI:10.1007/s12072-015-9675-4] 19 Chu CM,Liaw YF.Incidence and risk factors of progression to cirrhosis in inactive carriers of hepatitis B virus. 2009;104:1693-1699 [PMID:19455130 DOI:10.1038/ajg.2009.187] 20 Wang H,Ru GQ,Yan R,Zhou Y,Wang MS,Cheng MJ.Histologic Disease in Chinese Chronic Hepatitis B Patients With Low Viral Loads and Persistently Normal Alanine Aminotransferase Levels. 2016;50:790-796[PMID:27182648 DOI:10.1097/MCG.0000000000000544] 21 Liao B,Wang Z,Lin S,Xu Y,Yi J,Xu M,Huang Z,Zhou Y,Zhang F,Hou J.Significant fibrosis is not rare in Chinese chronic hepatitis B patients with persistent normal ALT. 2013;8:e78672 [PMID:24205292 DOI:10.1371/journal.pone.0078672] 22 Duan M,Chi X,Xiao H,Liu X,Zhuang H.High-normal alanine aminotransferase is an indicator for liver histopathology in HBeAg-negative chronic hepatitis B. 2021;15:318-327[PMID:33638049 DOI:10.1007/s12072-021-10153-2] 23 Choi GH,Kim GA,Choi J,Han S,Lim YS.High risk of clinical events in untreated HBeAg-negative chronic hepatitis B patients with high viral load and no significant ALT elevation. 2019;50:215-226 [PMID:31135074 DOI:10.1111/apt.15311] 24 Kumar M,Sarin SK,Hissar S,Pande C,Sakhuja P,Sharma BC,Chauhan R,Bose S.Virologic and histologic features of chronic hepatitis B virus-infected asymptomatic patients with persistently normal ALT. 2008;134:1376-1384[PMID:18471514 DOI:10.1053/j.gastro.2008.02.075] 25 Rockey DC,Caldwell SH,Goodman ZD,Nelson RC,Smith AD;American Association for the Study of Liver Diseases. 2009;49:1017-1044 [PMID:19243014 DOI:10.1002/hep.22742] 26 Bedossa P,Carrat F.Liver biopsy:the best,not the gold standard. 2009;50:1-3 [PMID:19017551 DOI:10.1016/j.jhep.2008.10.014] 27 Yan JY,Li ZQ,Yu ZJ,Kan QC.Management of individuals with chronic hepatitis B virus infection and persistent normal or mildly elevated aminotransferase levels. 2019;120:6632-6641 [PMID:30368885 DOI:10.1002/jcb.27959] 28 曹振环,柳雅立,马丽娜,鲁俊锋,金怡,何智敏,耿楠,郑燕红,陈新月.非活动性乙型肝炎表面抗原携带者抗病毒治疗效果及安全性研究.中华传染病杂志 2017;35:387-392 [DOI:10.3760/cma.j.issn.1000-6680.2017.07.002] 29 Gao WK,Shu YY,Chen Y,Ai Y,Yang XQ,Du F,Ye J.Effectiveness of Tenofovir Alafenamide in Chronic Hepatitis B Patients with Normal Alanine Aminotransferase and Positive Hepatitis B Virus DNA. 2022;10:112-119[PMID:35233379 DOI:10.14218/jcth.2021.00131] 30 Bonacci M,Lens S,Mariño Z,Londoño MC,Rodríguez-Tajes S,Mas A,García-López M,Pérez-Del-Pulgar S,Sánchez-Tapias JM,Forns X.Anti-viral therapy can be delayed or avoided in a significant proportion of HBeAg-negative Caucasian patients in the Grey Zone. 2018;47:1397-1408 [PMID:29577350 DOI:10.1111/apt.14613] 31 Papatheodoridis GV,Manolakopoulos S,Liaw YF,Lok A.Follow-up and indications for liver biopsy in HBeAg-negative chronic hepatitis B virus infection with persistently normal ALT:a systematic review. 2012;57:196-202 [PMID:22450396 DOI:10.1016/j.jhep.2011.11.030] 32 Oliveri F,Surace L,Cavallone D,Colombatto P,Ricco G,Salvati N,Coco B,Romagnoli V,Gattai R,Salvati A,Moriconi F,Yuan Q,Bonino F,Brunetto MR.Long-term outcome of inactive and active,low viraemic HBeAg-negative-hepatitis B virus infection:Benign course towards HBsAg clearance. 2017;37:1622-1631 [PMID:28296013 DOI:10.1111/liv.13416] 33 Li X,Zhou L,Gu L,Gu Y,Chen L,Lian Y,Huang Y.Veritable antiviral capacity of natural killer cells in chronic HBV infection:an argument for an earlier anti-virus treatment. 2017;15:220 [PMID:29089040 DOI:10.1186/s12967-017-1318-1] 34 Iloeje UH,Yang HI,Su J,Jen CL,You SL,Chen CJ;Risk Evaluation of Viral Load Elevation and Associated Liver Disease/Cancer-In HBV (the REVEAL-HBV) Study Group.Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. 2006;130:678-686 [PMID:16530509 DOI:10.1053/j.gastro.2005.11.016] 35 Chen CJ,Yang HI,Su J,Jen CL,You SL,Lu SN,Huang GT,Iloeje UH;REVEAL-HBV Study Group.Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. 2006;295:65-73 [PMID:16391218 DOI:10.1001/jama.295.1.65] 36 Koc ÖM,Robaeys G,Topal H,Bielen R,Busschots D,Fevery J,Koek GH,Nevens F.Outcome in Caucasian patients with hepatitis B e antigen negative chronic infection:A long-term observational cohort study. 2020 [PMID:32343427 DOI:10.1002/jmv.25950] 37 Lin D,Yang HI,Nguyen N,Hoang J,Kim Y,Vu V,Le A,Chaung K,Nguyen V,Trinh H,Li J,Zhang J,Hsing A,Chen CJ,Nguyen MH.Reduction of chronic hepatitis B-related hepatocellular carcinoma with anti-viral therapy,including low risk patients. 2016;44:846-855 [PMID:27549411 DOI:10.1111/apt.13774] 38 Lai M,Hyatt BJ,Nasser I,Curry M,Afdhal NH.The clinical significance of persistently normal ALT in chronic hepatitis B infection. 2007;47:760-767 [PMID:17928090 DOI:10.1016/j.jhep.2007.07.022] 39 Chao DT,Lim JK,Ayoub WS,Nguyen LH,Nguyen MH.Systematic review with meta-analysis:the proportion of chronic hepatitis B patients with normal alanine transaminase ≤ 40 IU/L and significant hepatic fibrosis. 2014;39:349-358 [PMID:24387289 DOI:10.1111/apt.12590] 40 Zeng DW,Dong J,Zhang JM,Zhu YY,Jiang JJ,Liu YR.HBeAgnegative chronic hepatitis patients should be monitored more strictly:a cross-sectional retrospective study on antiviral treatment-naïve patients. 2015;87:1682-1688 [PMID:25965250 DOI:10.1002/jmv.24217] 41 Gui HL,Wang H,Yang YH,Wu YW,Zhou HJ,Guo SM,Lin LY,Wang L,Cai W,Chen R,Guo Q,Zhou XQ,Bao SS,Xie Q.Significant histopathology in Chinese chronic hepatitis B patients with persistently high-normal alanine aminotransferase. 2010;17 Suppl 1:44-50 [PMID:20586933 DOI:10.1111/j.1365-2893.2010.01270.x] 42 陈永平,杨永平,丁惠国,林明华,张明香,陈良,邓存良,邬小萍,李用国,林锋.ALT持续正常的慢性HBV感染者诊疗专家共识.临床肝胆病杂志 2021;37:2286-2291 [DOI:10.3969/j.issn.1001-5256.2021.10.007]6 总结

