添加可溶性膳食纤维的肠内营养对重症急性胰腺炎患者肠道菌群、胃肠激素水平及肠粘膜屏障功能的影响
魏雪静 刘璐 裴佳佳 高倩倩
(1.河南科技大学第一附属医院门诊部,河南科技大学护理学院,河南 洛阳 471000;2.河南科技大学第一附属医院妇科河南科技大学护理学院,河南 洛阳 471000;3.河南科技大学第一附属医院神经内科,河南科技大学护理学院,河南 洛阳 471000;4.河南科技大学第一附属医院胃肠外科,河南科技大学护理学院,河南 洛阳 471000)
急性胰腺炎是临床上比较常见的一种急腹症,是多种原因引起的胰腺自身的化学性炎症,其影响胰腺本身,也可导致其它器官功能受损,若就诊不及时,易发展为重症急性胰腺炎(Severe acute pancreatitis,SAP)。
目前,针对SAP 患者多应用常规肠内营养进行干预,可改善机体营养状态,但部分患者可能存在不耐受现象[1]。
研究表明,纤维膳食营养可调节胃肠功能不佳患者的胃肠动力,改善胃肠道症状[2]。本研究旨在探索添加可溶性膳食纤维的肠内营养对SAP 患者肠道菌群、胃肠激素水平及肠粘膜屏障功能的影响。
1 资料与方法
1.1 一般资料
选取我院2019 年3 月至2021 年5 月期间收治的108 例SAP 患者作为研究对象,依据肠内营养方式不同分为常规组和膳食纤维组,各54 例。
常规组男33 例,女21 例;年龄35~63 岁,平均年龄49.27±6.25 岁;病程8~11 h,平均病程9.57±0.26 h。膳食纤维组男31 例,女23 例;年龄33~62岁,平均年龄48.65±6.34 岁;病程8~11 h,平均病程9.64±0.23 h。两组SAP 患者在文化程度、病程等方面经比较无差异(P>0.05),具有可比性。
纳入标准:符合《中国急性胰腺炎多学科诊治共识意见》中SAP 诊断标准[3],且经血清淀粉酶、CT等检查确诊。排除标准:肠道其它原发性疾病者;合并血液系统疾病者;合并精神疾病者。本研究经我院医学伦理委员会审核批准(伦理批号:20190314)。
1.2 方法
两组患者均禁食,并给予抗炎、胃肠减压、纠正水电解质紊乱等基础治疗,待患者恢复肠鸣音、生命体征稳定后,开始肠内营养治疗。
常规组患者采用常规肠内营养,利用胃肠营养泵将百普力(规格:1 kcal·mL-1,纽迪希亚制药(无锡)有限公司,国药准字:H20010285)经鼻空肠营养管以匀速泵入,速度从30 mL·h-1 开始,依据患者自身实际情况以及耐受程度,速度最快不超过100 mL·h-1。当肠内营养热量达到25 Kcal·(kg·d)-1时,即完成目标热量。
膳食纤维组患者在常规组的基础上在肠内营养液中添加可溶性膳食纤维,添加剂量为每500 mL百普力添加10 g 可溶性膳食纤维。
两组均持续干预1 周。比较两组患者干预前、干预1 周后的肠道菌群组成、胃肠激素水平和肠粘膜屏障功能。
1.3 观察指标
1.3.1 肠道菌群组成
收集新鲜大便标本,取适量标本将其稀释后,于选择培养基上,在37℃状态下进行培养24 h,统计双歧杆菌、乳酸杆菌、葡萄球菌、大肠杆菌的百分比。
1.3.2 胃肠激素
抽取患者清晨空腹肘静脉血3 mL,3700 rpm 离心11 min,分离血清,采用放射免疫法测定胃动素(Motilin,MTL)、胆囊收缩素(Cholecystokinin,CCK)、血管活性肠肽(Vasoactive intestinal peptide,VIP)水平。
1.3.3 肠粘膜屏障功能
取适量上步获得的血清标本,采用酶联免疫吸附法测定二胺氧化酶(Diamine oxidase,DAO)、D-乳酸、内毒素、白介素-6(Interleukin-6,IL-6)水平。
1.4 统计学分析
所有数据使用SPSS23.0 软件进行统计学分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以例数(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 肠道菌群组成
两组干预1 周后,双歧杆菌、乳酸杆菌水平较干预前明显升高,且膳食纤维组明显高于常规组(P<0.05);葡萄球菌、大肠杆菌水平较干预前明显降低,且膳食纤维组低于常规组(P<0.05)。见表1。
表1 肠道菌群组成(,n=54)

表1 肠道菌群组成(,n=54)
注:与干预前相比,△P<0.05;与常规组相比,*P<0.05。
2.2 胃肠激素
两组干预1 周后,MTL、CCK 水平较干预前明显升高,且膳食纤维组明显高于常规组;VIP 水平较干预前明显降低,且膳食纤维组明显低于常规组(P<0.05)。见表2。
表2 胃肠激素(,n=54)

表2 胃肠激素(,n=54)
注:与干预前相比,△P<0.05;与常规组相比,*P<0.05。
2.3 肠粘膜屏障功能
两组干预1 周后,DAO、D-乳酸、内毒素、IL-6 水平较干预前明显降低,且膳食纤维组明显低于常规组(P<0.05)。见表3。
表3 肠粘膜屏障功能(,n=54)
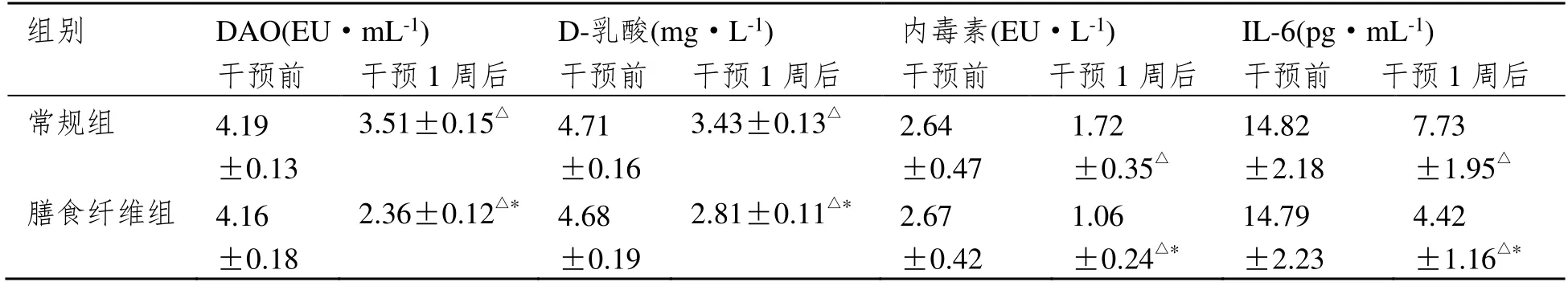
表3 肠粘膜屏障功能(,n=54)
注:与干预前相比,△P<0.05;与常规组相比,*P<0.05。
3 讨论
SAP 为消化系统较为严重的疾病之一,其发病后的临床症状,主要表现为持续发作的腹痛、腹胀,恶心呕吐、发热、低氧血症、意识障碍以及休克等。胃肠功能障碍作为SAP 常见并发症之一,临床上常采用常规肠内营养治疗,可改善胃肠功能,但部分患者可能出现腹胀、腹泻等症状。研究证实,膳食纤维可调节患者肠粘膜屏障,改善临床预后[4]。
不良饮食及生活习惯、病原体释放的毒素都能增加胰腺氧化应激的风险,破坏胰腺功能,导致抗菌肽分泌减少,致使小肠细菌过度生长,破坏肠道菌群平衡。常规肠内营养可改善机体营养状态,提高机体防御能力,但由于部分患者不耐受,致使肠道菌群的调节效果不理想[5]。
而添加可溶性膳食纤维,其经肠道微生物分解,其分解产物中的果聚糖为肠道有益菌的增殖因子,可有效促进双歧杆菌增殖;分解产生的聚葡萄糖可改善肠道微生态环境,促进乳酸杆菌、双歧杆菌等有益菌群的生长,对致病菌的生长具有抑制作用;且其经发酵产生的短链脂肪酸对肠道pH 值具有调节作用,可抑制胺、酚类化合物等生成,拮抗大肠杆菌、葡萄球菌等致病菌生长[6]。本研究发现膳食纤维组干预1 周后双歧杆菌、乳酸杆菌水平高于常规组;葡萄球菌、大肠杆菌水平低于常规组,表明添加可溶性膳食纤维的肠内营养可调节SAP 患者肠道菌群。
由于ASP 的发生,患者机体内胃肠激素异常分泌,致使胃肠动力降低,导致胃肠功能紊乱。本研究显示膳食纤维组干预1 周后MTL、CCK 水平高于常规组;VIP 水平低于常规组,表明添加可溶性膳食纤维的肠内营养可改善SAP 患者胃肠激素。常规肠内营养可为机体提供必需营养素,维持机体营养均衡,利于胃肠动力的恢复,但由于液体渗透压较高,致使胃肠激素水平的调节程度有限[7]。添加可溶性膳食纤维的肠内营养经结肠发酵,将可溶性膳食纤维分解产生二氧化碳、氢气等气体,对肠粘膜具有刺激作用,加快胃肠蠕动,提高胃肠动力;且发酵产生丁酸、乙酸等,可对肠动力障碍具有改善作用,依据肠蠕动频率状态,对肠动力进行双向调节;加之经肠道微生物分解而产生的果胶、果聚糖等,对于胃肠蠕动具有促进作用,提高机体消化能力,调节胃肠激素水平[8]。
由于胃肠道内细菌过度繁殖,SAP 患者机体的细菌异位及内毒素过度释放,致使肠粘膜屏障受损。常规肠内营养通过为机体提供所需氨基酸、微量元素等,减少细菌异位,可一定程度地调节肠粘膜屏障功能[9]。添加可溶性膳食纤维的肠内营养应用可溶性膳食纤维,其经肠道消化时可诱导短链脂肪酸
的合成,对肠道pH值具有降低作用,保护肠粘膜,一方面避免细菌异位,减少因细菌异位代谢产物D-乳酸以及内毒素的释放;另一方面降低肠粘膜上皮细胞损伤,减少因黏膜上皮细胞破坏引起的DAO的分泌,提高肠粘膜防御功能,降低致炎物质合成,调节IL-6水平,进而调节肠粘膜屏障功能[10]。本研究显示膳食纤维组干预1周后DAO、D-乳酸、内毒素、IL-6水平低于常规组,表明添加可溶性膳食纤维的肠内营养可调节SAP患者肠粘膜屏障功能。
综上所述,添加可溶性膳食纤维的肠内营养,对SAP患者进行营养干预,通过抑制细菌异位,改善肠粘膜的屏障功能,调节胃肠激素水平,调控肠道菌群,疗效优于常规肠内营养,值得在临床推广应用。

