基于过冷液体凝固放热的无源输血加温器对血液质量的影响评估
李玉璇 张玉龙 马兴焕 强书毓 王小慧 詹林盛
快速输血补液,迅速恢复血容量是抢救大失血休克伤员的重要治疗方式,能够有效的防止因低灌注导致的多器官功能衰竭[1-3]。院前条件下,尽早为大量失血伤员输注血液制品是美军战伤救治指南中的重要原则。不仅是军方,美国地方急救中心也推荐创伤大失血伤员院前即接受输血治疗。严重创伤后由于大量失血、暴露于寒冷环境及维持正常体温能力下降等原因,低体温发生率高达10%~65%[4-5]。体温过低合并器官灌注不足容易导致多脏器功能损伤,引起体内各种生物酶活性降低,被认为是伤员预后不良的独立危险因素。低体温、酸中毒以及凝血功能异常被称为大失血伤员的“死亡三联征”[6]。院前环境的医疗设施和救治条件相对较差,伤员有可能会暴露在较为寒冷的环境中,低体温的发生率可能会更高。因此,在创伤大失血伤员的院前救治中,伤员的体温管理十分重要。
预防伤员低体温的方式主要包括2类:可以通过加热毯包裹伤员以维持体温;其次是在输血和输液过程中预先加温液体,防止大量冷藏低温血液短时间内进入人体,诱发伤员的低体温症[7]。因此,使用场景广泛,便于携带的输血加温装置用于院前输血救治很有必要。电源供电的输血加温器受限于环境条件,在院前环境中应用较少;蓄电池供电的输血加温器较为适合院前输血使用,但目前蓄电池技术尚未有突破性的进展,通常充电需要耗费较长的时间,且蓄电池日常需要较为频繁的保养工作[3,8-9]。据此,考虑到院前环境的特殊性,基于过冷液体四水硝酸钙凝固放热原理,我们设计了一种无源输血输液加温器,该装置的特性包括如下5点:(1)无需电源供电,使用场景广泛;(2)体积小,重量轻,便于携带;(3)启动发热迅速,可在开启后1 min内达到工作温度;(4)工作温度恒定保持在40℃,较为接近人体体温。
为了进一步研究使用该产品加温后是否会对血液质量产生影响,在本研究中我们分别加温了全血和悬浮红细胞,比较了加温前后溶血率、血常规、生化指标、形态学参数、膜损伤程度及凝血功能等指标的变化,为该便携式无源输血输液加温器的转化应用提供数据支撑。
材料与方法
1 血液来源 9份志愿者全血由解放军总医院第七医学中心输血科提供,每份30 mL,取出14 mL用于全血检测,剩余16 mL血液常规制备悬浮红细胞用于悬浮红细胞检测,之后置于4℃冰箱保存,经48 h冷藏保存后待用。
2 仪器与试剂 一次性使用塑料血袋(四川南格尔生物科技有限公司),柠檬酸盐-磷酸盐-葡萄糖-腺嘌呤红细胞保存剂(CPDA)(Sigma,批号:SLCF1808),注射泵(兰格恒流泵有限公司),全自动血细胞分析仪(BC-5130深圳迈瑞公司),全自动生化分析仪(罗氏,CobasC701),pH计(S210-8梅特勒-托利多仪器(上海)有限公司),瑞式染液(索莱宝,批号:20210517),显微镜(BDS400重庆奥特光学仪器有限责任公司),微量游离血红蛋白测试盒(南京建成生物工程研究所,批号:A071-1-1),多功能酶标仪(SpectraMaxM5美国Molecular Devices公司),流式细胞仪(美国BD公司),PE耦联Annexin-V凋亡检测试剂盒(美国BD公司,批号:0027279),FITC耦联anti-human CD47(Bio Legend,批号:B329356),血栓弹力图仪(深圳优迪生物技术有限公司),全自动凝血测试仪(SF-8050北京赛科希德科技股份有限公司)。
3 实验方法
3.1 自制基于过冷液体凝固放热的无源输血加温器:本装置的加温原理为过冷液体凝固放热[10]。四水合硝酸钙熔点为40℃,高纯度的固态四水合硝酸钙融化后自然冷却能够以液态的形式在0℃以上的环境中稳定存在,这样的低于凝固点依然以液态形式存在称为过冷液体。过冷液体在加入固态四水合硝酸钙后整个体系会迅速开始结晶,同时放出凝固热,而使温度上升到凝固点40℃,整个体系呈现为一种固态四水合硝酸钙和液态四水合硝酸钙的混合状态,当体系中的液态四水合硝酸钙完全凝固后,体系温度开始下降。本加温器的设计原理即基于此,第一腔室灌装大量液态四水合硝酸钙,约600 mL,第二腔室(包含输血管路)放置少量固态四水合硝酸钙,约50 g。使用前将两腔室间的易碎带掰开,将第一腔室的液态四水合硝酸钙挤入第二腔室,整个体系温度会在1 min内迅速升至40℃,即可开始进行血液加温(图1A、1B)。使用时血袋与加热器的管路连接如图1C所示,通过加温器管路两侧的内旋和外旋鲁尔接头与输血器和穿刺针一侧的外旋和内旋鲁尔接头连接,输注完毕后,管路里残留的血液(约15 mL)处理方案与临床输血相同,通过将输血器从空血袋上拔出,连接到生理盐水袋上,通过生理盐水将管路中残留的血液完全回输到体内。
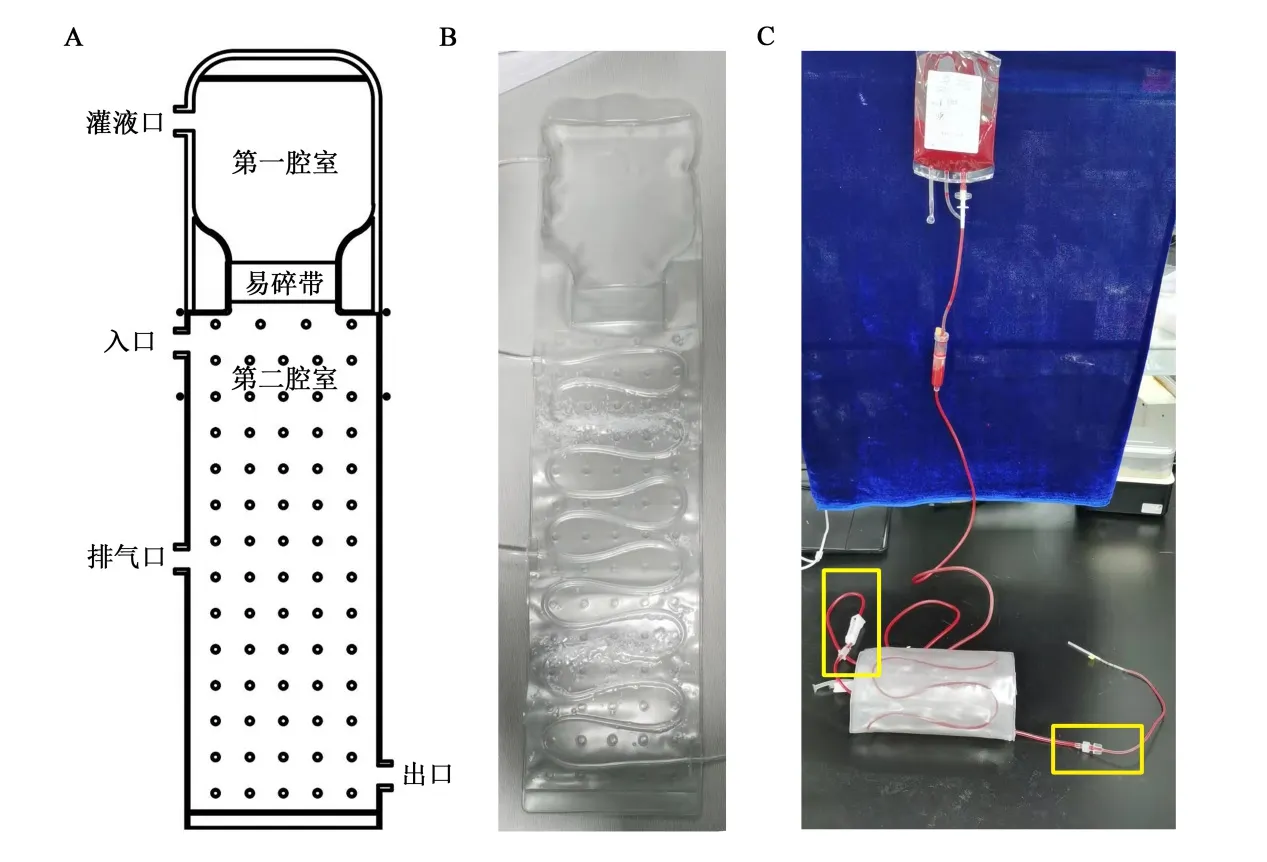
图1 基于过冷液体凝固放热的无源输血加温器
3.2 输血效果及血液质量检测:每个样本实验前留取5 mL作为对照,另取5 mL经无源输血加温器加温。因使用了较少的血液(5 mL)进行模拟实验,实验过程中使用注射泵控制血液流速为5 mL/min以最大限度模拟实际状态。首先使用20 mL注射器吸取15 mL空气,然后吸取5 mL冷藏血液,之后迅速与加温器连接,注射泵和注射器口朝下垂直放置,保证血液先进入加温器,最后通过注射器内预先吸入的空气推动血液流出加温器,检测加温后的血液质量。全自动血细胞分析仪检测血常规各项指标,pH值采用微量pH计测定,生化指标Na+(钠离子)/K+(钾离子)/GLU(葡萄糖)/LDH(乳酸脱氢酶)由全自动生化分析仪检测,瑞式染色后镜下观察红细胞形态,按照游离血红蛋白检测试剂盒说明书测定细胞中FHb(游离血红蛋白)含量,红细胞表面PS(磷脂酰丝氨酸)暴露和CD47表达使用流式细胞仪进行检测,凝血四项采用全自动凝血测试仪检测,TEG(血栓弹力图)使用血栓弹力图仪检测。全血和悬浮红细胞质量评价检测指标如图2所示。

图2 全血和悬浮红细胞质量评价检测指标
4 统计学处理 采用GraphPad Prism 9统计学软件进行数据分析,血常规、生化指标和凝血相关指标等计量资料以±s表示。统计学分析采用配对t检验,P<0.05表示差异有统计学意义。
结 果
1 输血速度与加温温度测试结果 在加温器研发阶段,我们对不同的输血速度下加温后血液温度进行了测试,结果如表1所示。本试验中的血液流速我们设置为5 mL/min,需要说明的是大量失血伤员的急救输血,其流速有时候可能会达到30~60 mL/min甚至更高,以快速的恢复伤员的血容量。但是我们设计的无源输血加温器,加温管路长度固定,发热液温度恒定,因此流速与加温时间和加温后血液的温度成反比,即流速越慢单位体积血液加温时间越长,加温后血液的温度越高。因此在本研究中选择了临床输血治疗推荐的相对较慢的输血速度5 mL/min进行试验。
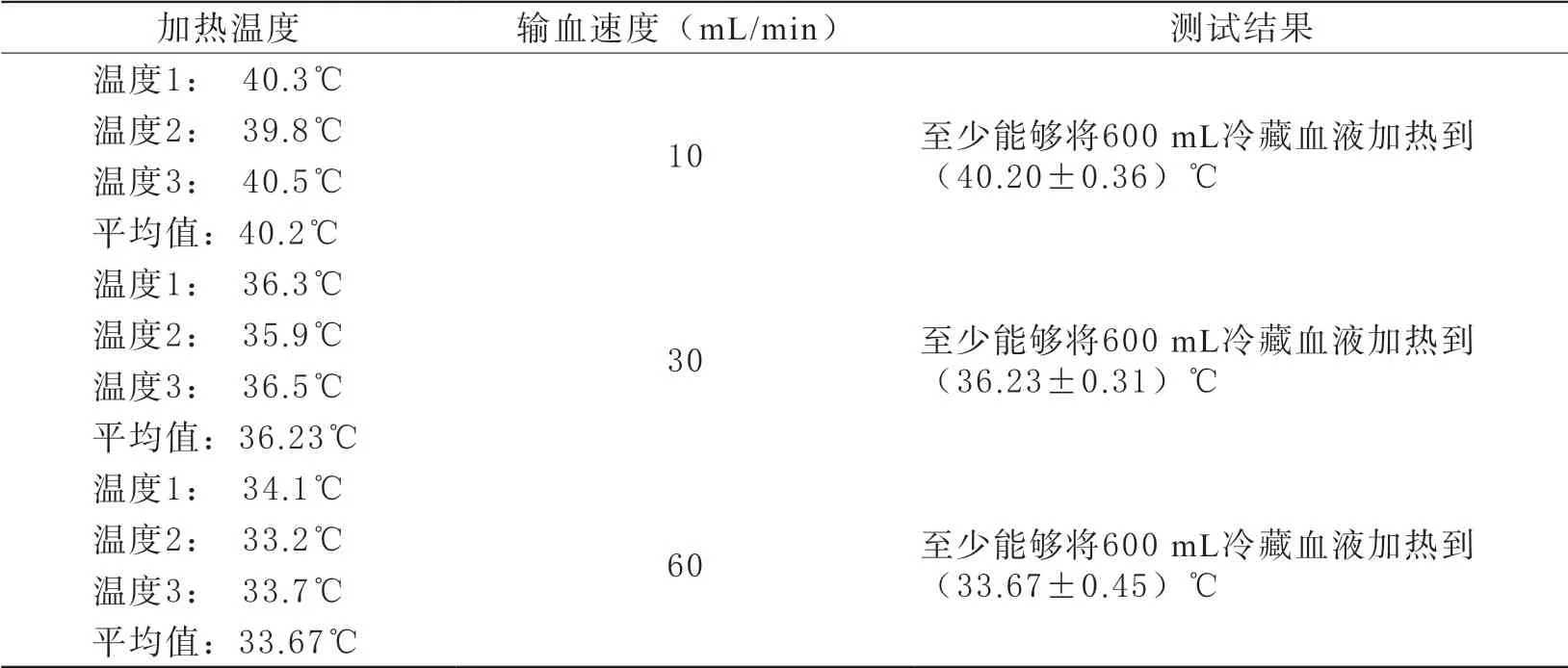
表1 输血速度与加温温度测试结果
2 溶血率及血常规指标检测结果 如图3和表2所示,全血加温后游离血红蛋白(FHb)、溶血率、RBC计数、PLT计数、HGB含量及HCT均无明显变化,血常规各项检测结果之间的前后差异无统计学意义;WBC计数减少,从(6.17±2.44)×109/L降低至(5.87±2.49)×109/L,且差异有统计学意义(t=2.333,P<0.05)。悬浮红细胞加温后FHb浓度升高,从(386.40±78.87)mg/L升高至(431.67±84.92)mg/L,差异有统计学意义(t=5.817,P<0.001);溶血率升高,从(0.39±0.08)%升高至(0.43±0.08)%,差异有统计学意义(t=2.828,P<0.05),但在国标允许的范围内;RBC计数升高,但差异无统计学意义,HGB含量增加,差异无统计学意义,HCT值升高,差异也无统计学意义,说明加温前后对悬浮红细胞血液成分无明显影响。
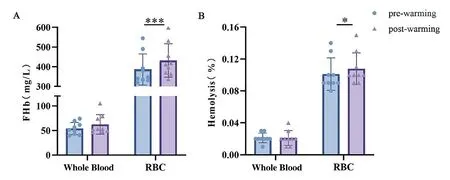
图3 全血和悬浮红细胞加温前后溶血率变化

表2 全血和悬浮红细胞加温前后血常规检测结果(±s)
3 生化指标检测结果 如图4所示,全血及悬浮红细胞加温前后pH值无明显变化。如表3所示,观察加温后各项生化指标发现,全血Na+、GLU、LDH及悬浮红细胞Na+、K+、GLU加温前后变化差异无统计学意义。全血加温后K+浓度升高,从(3.41±0.27)mmol/L升高至(3.61±0.26)mmol/L,且差异有统计学意义(t=5.468,P<0.001);悬浮红细胞加温后LDH浓度升高,从(185.56±32.00)U/L升高至(198.77±32.19)U/L,且差异有统计学意义(t=3.643,P<0.01)。

图4 全血和悬浮红细胞加温前后pH变化
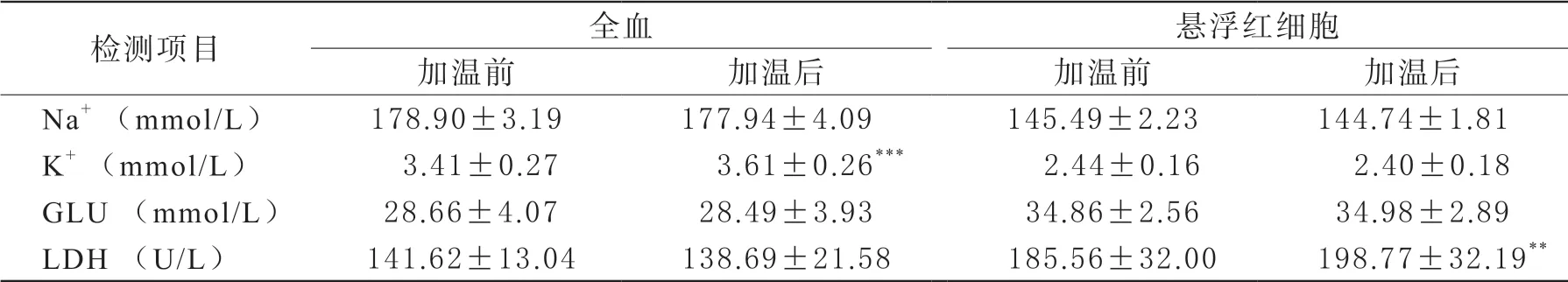
表3 全血和悬浮红细胞加温前后生化指标检测结果( ±s)
4 红细胞形态学变化 如图5所示,全血加温后,MCV(平均红细胞体积)、RDW(红细胞分布宽度)、MPV(平均血小板体积)、PDW(血小板分布宽度)均无明显改变。全血和悬浮红细胞加温前后取血液进行常规涂片,瑞式染色后在显微镜高倍视野和油镜下观察其红细胞、血小板形态,结果显示加温前后红细胞、血小板形态完整,其中存在极少数变形的红细胞,这些结果均显示无源输血加温器不会引起明显的红细胞破坏,对血液中有形成分的影响很小。
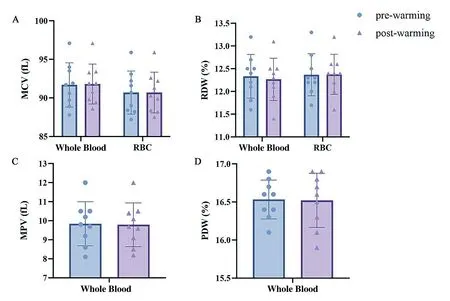
图5 全血和悬浮红细胞加温前后形态学指标变化
5 膜损伤指标检测结果 如图6所示,全血及悬浮红细胞加温前后PS暴露和CD47分子表达平均荧光强度虽略有改变,但差异无统计学意义。
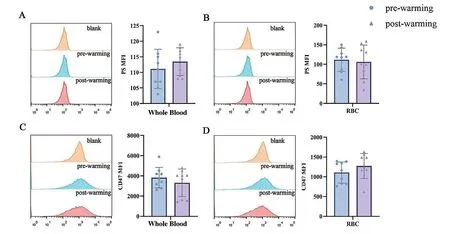
图6 全血和悬浮红细胞加温前后PS、CD47变化
6 凝血功能相关指标检测结果 表4为全血加温后凝血功能相关指标变化情况。由表可见,MA值从(59.34±4.19)min升高至(65.19±3.51)min,差异有统计学意义(t=4.961,P<0.01);而其余指标加温前后均无明显变化。

表4 全血血栓弹力图和凝血四项检测结果(±s)
讨 论
加温输血在战争现场大量失血伤员救治中具有重要意义。大量快速输血前,通常建议将血液制品复温后再回输,血液复温能够增强其流动性,有利于灌注,还可以避免大量冷藏库存血输入后引起受者低体温而诱发严重的不良反应[11]。可以使用专用的设备或者是在温水进行血液复温,水温一般控制在37℃左右,以免过热造成红细胞损伤而引起急性溶血反应。本研究中我们使用的输血加温器,其加温原理为四水合硝酸钙过冷液体凝固放热,四水合硝酸钙的熔点为40℃,根据不同的血液流速需要,其加热温度介于33.67℃~40.20℃,在此条件下我们评价了全血和悬浮红细胞经无源输血加温器加温后其溶血率、生化指标、膜损伤及凝血功能相关指标的变化。
研究发现,首先全血加温后K+浓度略有升高,但FHb和溶血率均无明显改变。通常血液制品储存过程中阳离子泄露是由于红细胞破坏或通透性增加,导致胞内K+外流,血浆中K+浓度升高,因此在红细胞储存损伤的研究中一般K+浓度增加与溶血显著相关。那加温为什么溶血率没有变化而K+浓度升高呢?结合血常规中白细胞数目降低,作者认为可能是白细胞对温度敏感性较高,导致白细胞破坏或通透性增加,引起的胞内钾离子外流及血常规计数减少,全血中红细胞K+浓度变化的差异也可以得到解释。MA值升高,MA是TEG图上的最大振幅,即最大切应力系数,反映正在形成的血凝块的最大强度及血凝块形成的稳定性,正常值为50~70 min,MA主要受纤维蛋白原及血小板两个因素的影响,其中血小板的作用(约占80%)要比纤维蛋白原(约占20%)大,加温后MA值升高,但血小板其他相关指标均无明显变化,说明加温对血小板功能的影响在可接受的正常范围内[12],禤健蓉等[13]研究了升温对血小板功能的影响,研究表明体外41℃加温10 min对血小板含量和TEG-MA均无明显影响,与我们的结论相一致。其次,悬浮红细胞是全血经离心移除大部分血浆后加入红细胞保存液制成,而红细胞保存液和残留的血浆对热有一定的缓冲能力,加温后,其红细胞计数,血红蛋白浓度,红细胞压积略有升高,其值依旧在正常范围内,且差异无统计学意义;游离血红蛋白和溶血率升高,但仍在国家标准规定的游离血红蛋白≤0.72 g/L,溶血率<红细胞总量的0.8%范围内。
基于过冷液体凝固放热的无源输血加温器造成红细胞损伤的可能机制主要表现在以下几方面:首先是温度因素,在加温过程中,热量在细胞内积累、扩散,超出红细胞的热平衡和热耐受限度,造成膜通透性增加,THOMAS G PODER等[14]对血液加温与溶血关系进行分析,分析结果表明温度≤43℃时,温度对红细胞溶血的影响极低,而我们设计的加温器工作温度为40℃,结合以上研究结果,此温度下对红细胞质量影响较小;其次是机械力因素,加温过程中血液快速通过加温输血管路,途径输血管内部流场环境及细口径输血针头时,红细胞会受到外力冲击及管壁的摩擦力造成溶血,但马印图等[15]研究中血液流速为80 mL/min,对红细胞数量、形态、溶血率及游离血红蛋白几乎没有影响,因此本研究中采用临床最小流速来最大化温度对血液质量的影响;最后与红细胞年龄有关,在新鲜采集的血液中,也存在年轻红细胞和衰老红细胞,加温过程中衰老红细胞更容易受到热损伤和机械应力破坏,溶血率升高。
总结本研究的结果,全血短暂加温后,其血液质量无明显变化;悬浮红细胞短暂加温后,其质量相关指标虽略有变化,但仍在正常范围内。全血和悬浮红细胞经无源输血加温器加温后,游离血红蛋白、溶血率等相关指标符合国家标准“全血及成分血质量要求GB18469-2012”[16]。
利益冲突所有作者均声明不存在利益冲突

