改良型平板流动小室的研制及其在病理血管条件下血小板黏附功能检测中的应用*
牛思颖 徐嘉婕 徐梦瑶 张议丹 夏利军 江淼
血小板作为维持机体正常止血的主要成分,它与血管壁之间的相互作用启动了一系列生理止血过程:血小板黏附到破损的血管壁上,随后发生活化、聚集、并在纤维蛋白原帮助下形成血小板血栓[1]。这一过程同样也是病理性血栓形成的起始环节,而抑制血小板黏附已成为多个抗血栓药物的作用靶点[2-3]。因此,在体外建立合适的模型以研究血小板在血管壁上的黏附对于分析血小板功能、判断血栓发生风险、检测抗血栓药物疗效均有重要的作用[4]。
由于血小板在流体剪切力条件下的黏附、活化机制与静止条件下存在极大的差异,因此检测血小板黏附的模型需要最大限度地还原机体内的血流环境。许多实验室根据不同的实验目的和实验方法,建立了相应的流动装置,从最简单的锥板黏度仪到采用微流控技术的BioFlux系统等等,这些系统以不同方式模拟血流状态[5-8]。由于方法学的限制,这些系统对血管管腔的设计局限为正常的直通血管,对于存在局部狭窄、血管分支、瓣膜受损等病理血管条件则无法模拟,而这些病理血管条件恰恰是诱发病理性血栓生成的重要因素。本研究以平行平板流动小室(parallel plate flow chamber)为基础,对其中的模拟血管管腔进行了针对性的改良,使用该装置对不同血流条件下的血小板黏附进行了检测。
材料与方法
1 改良型平板流动小室的设计
1.1 材料和设备:有机玻璃板(苏州惠诺有机玻璃有限公司)、硅胶垫片及聚四氟乙烯硅胶管(深圳正光硅胶制品有限公司)、LSP2-2A型恒流泵(保定兰格恒流泵有限公司)、Axiovert 40倒置显微镜(德国Leica)、彩色制冷CCD相机(加拿大Qicam公司);五分类血球计数仪(日本SYSMEX公司);血小板聚集仪(美国Chrono-log公司);Streampix视频录制软件(加拿大Norpix公司)、可溶性Ⅰ型胶原蛋白(德国Sigma)、Calcein-AM荧光染料(日本东仁化学)、3.2%柠檬酸钠静脉血液真空采集管(上海碧迪)。抗血小板抗体SZ-2、抗胶质瘤抗体SZ-39由江苏省血液研究所血栓与止血实验室提供。
1.2 平板流动小室的设计:该装置包括上下两块有机玻璃平板,中间夹有硅胶垫片和载玻片。上层平板两端设有连接进、出液体的接口,下层平板中央留有直径3 cm的圆孔以供倒置显微镜镜头贴近载玻片。硅胶垫片厚度为1.5 mm,垫片中划出20 mm×2 mm的缺口。上下层平板、硅胶以及载玻片通过螺栓拧紧组合后,上层平板与载玻片在硅胶垫片留出的缺口处形成密闭的血流通道,该通道的下底面为载玻片,在载玻片上可包被胶原、VWF蛋白等不同基质,也可在其表面接种血管内皮细胞(图1A)。通过激光雕刻技术可以在硅胶垫片中刻画出不同宽窄的缺口,以此模拟不同直径的血管,还可通过改变缺口形状模拟管腔中存在狭窄、分支等病理血管状态(图1B)。
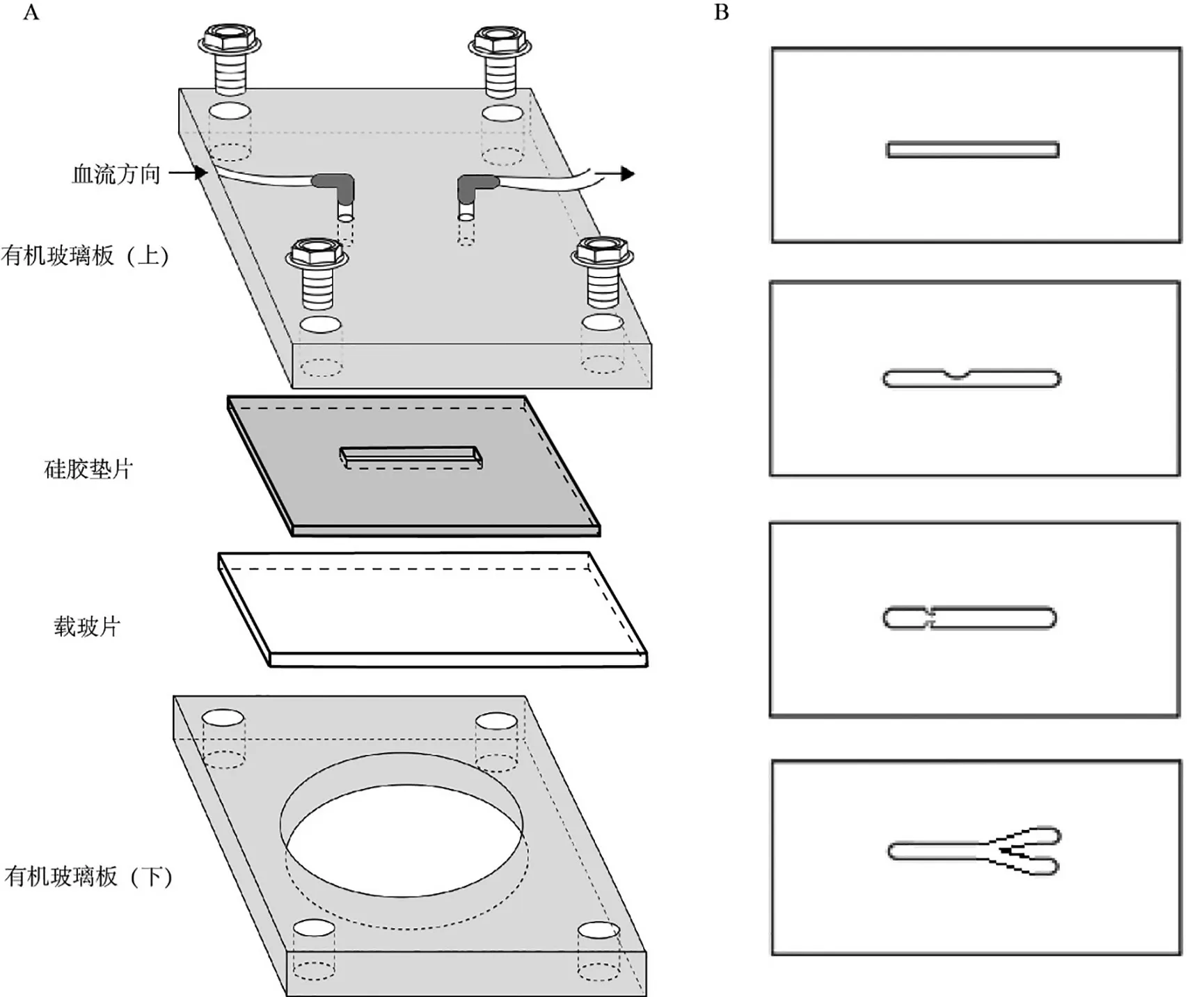
图1 改良的平板流动小室各部分组件示意图
2 血样采集和血小板预处理 采用健康成年志愿者10人(经苏州大学附属第一医院伦理委员会批准,批准文号:2020伦审批第200040号, 男女各半,年龄21~47岁)的血样作为对照组模拟正常平直血管内的血小板黏附,其中5人的血样又分别加入SZ-39单抗(阴性对照,终浓度20 μg/mL)和SZ-2单抗(20 μg/mL)进行抗黏附药效学实验。志愿者血小板数量>150×109/L,血脂正常,2周内无服药史,采集前签署知情同意书。静脉血液样品以肝素(40 U/mL)抗凝管抗凝,室温(25℃)保存,2 h内使用。进行黏附实验前15 min以Calcein-AM荧光染料对血小板进行标记:将浓度为1 mmol/L Calcein-AM 荧光染料按1∶1 000(v/v)加入血样,轻轻混匀,放入37℃温箱孵育。
为进行血小板黏附抑制实验,将10 μL生理盐水溶液配制的20 μg/mL的SZ-2抗体加入到血样中作为药物处理组,以20 μg/mL SZ-39抗体加入血样作为阴性对照组,只加入10 μL生理盐水的血液样品作为空白对照组。
3 血小板黏附功能检测 在使用平板流动小室检测血小板黏附功能之前,以Ⅰ型胶原对平板内的血流通道进行包被:以浓度为50 μg/mL乙酸酸化的Ⅰ型胶原蛋白溶液注入平板流动小室,封闭两端出入水口,于室温静置孵育过夜后以2% BSA溶液室温孵育2 h,随后以PBS溶液轻微冲洗通道2次,4℃保存备用。
将胶原包被后的平板流动小室放置于倒置显微镜恒温载物台,用硅胶管(内径1.0 mm)将流动小室的液体入口与恒流泵相连,使用恒流泵控制血液样本通过流动小室(图2)。血流流速与剪切率通过近似泊肃叶(Poiseuille)方程换算:v=6Qa2b,其中,v(s-1)表示剪切率,Q(μL/s)代表流量,a(mm)代表小室深度,b(mm)代表小室宽度。经过荧光标记的血液由恒流泵泵出后,经硅胶管道流入流动小室,流动小室上,显微镜物镜靠近载玻片下底面,显微镜CCD相机对载玻片上的血小板黏附状态进行实时记录。利用Image J软件对采集的序列图像进行分析,计算出每张图像中的荧光标记血小板聚集体的表面覆盖率。
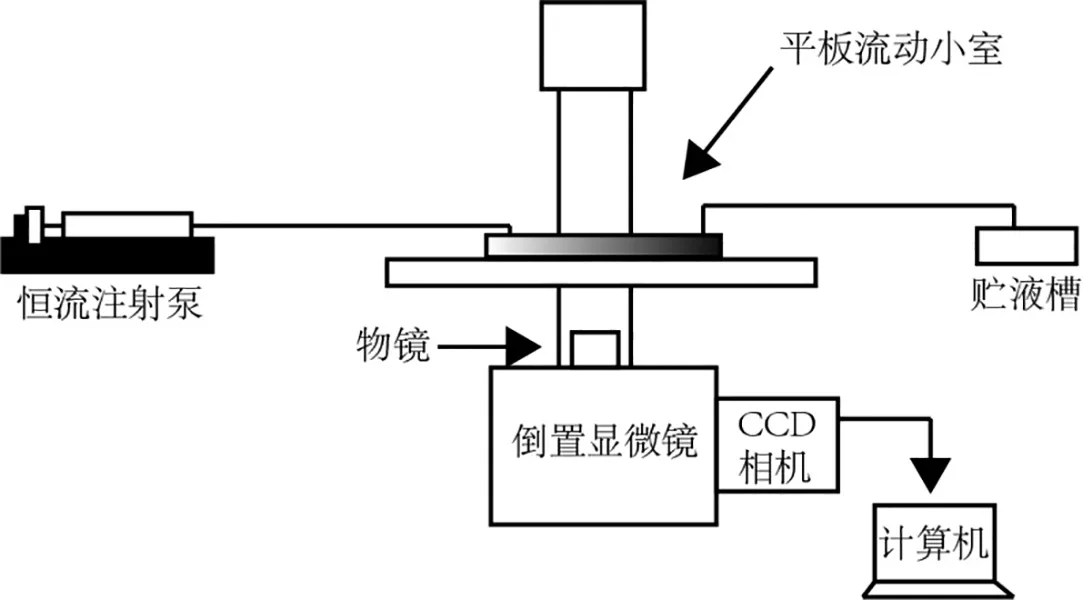
图2 平板流动小室的检测装置示意图
4 血小板聚集功能及血小板表面CD-62P表达检测 收集流出平板流动小室的血样,根据体积补充1∶9枸橼酸钠抗凝剂,充分混匀后以1 100 r/min分离心5 min分离出富血小板血浆(PRP),剩余样品以3 000 r/min离心10 min分离出乏血小板血浆(PPP),以PPP将PRP中的血小板浓度调节至30×107/mL。参照文献方法[9]以PPP调零,PRP悬液在血小板聚集仪上以光学比浊法分别以ADP、瑞斯托霉素和胶原为诱导剂检测血小板聚集率。
取流出平板流动小室的血样10 μL加入PE标记的抗CD-62P抗体1 μL,37℃温育15 min后加生理盐水0.5 mL,在流式细胞仪上检测CD-62P表达率。
5 统计学处理 不同实验组均重复三次以上,数据记录、统计后以均数±标准差表示,采用SPSS14.0软件对统计数据进行分析,不同组间比较采用配对的非参数Wilcoxon检验 ,P<0.05表示差异有统计学意义。
结 果
1 血小板在正常血管腔内的黏附 本研究中血液在高度为0.5~1.5 mm的微通道内流动,模拟血流剪切率为1 000~1 500 s-1,流体黏度接近于1,此时可将管腔内流体行为视为经典的不可压缩牛顿流体[10]。当使用0.5 mm硅胶垫片,剪切率为1 000 s-1,根据泊肃叶公式推算液体流速为1.2 mL/min。实验过程中,无论模拟病理血管或是正常血管,在I型胶原包被的管腔表面8~12 min均可达到接近最大血小板黏附覆盖面积。考虑到用血量的限制,将黏附终止时间设置为10 min。由图3A计算得出,在不加入任何黏附抑制剂或抗血小板药物条件下,血小板在胶原表面可达到57.6±8.2%的黏附覆盖率;当加入足量抗黏附抑制剂SZ2单抗(20 μg/mL)时,血小板黏附被明显抑制6.1±2.9%;而加入同等剂量的SZ-39单抗,血小板黏附率为54.8±10.1%。SZ-39组与空白对照组相比差异无统计学意义,而与SZ-2组之间差异显著(P<0.01),(图3B),统计数据见图4。
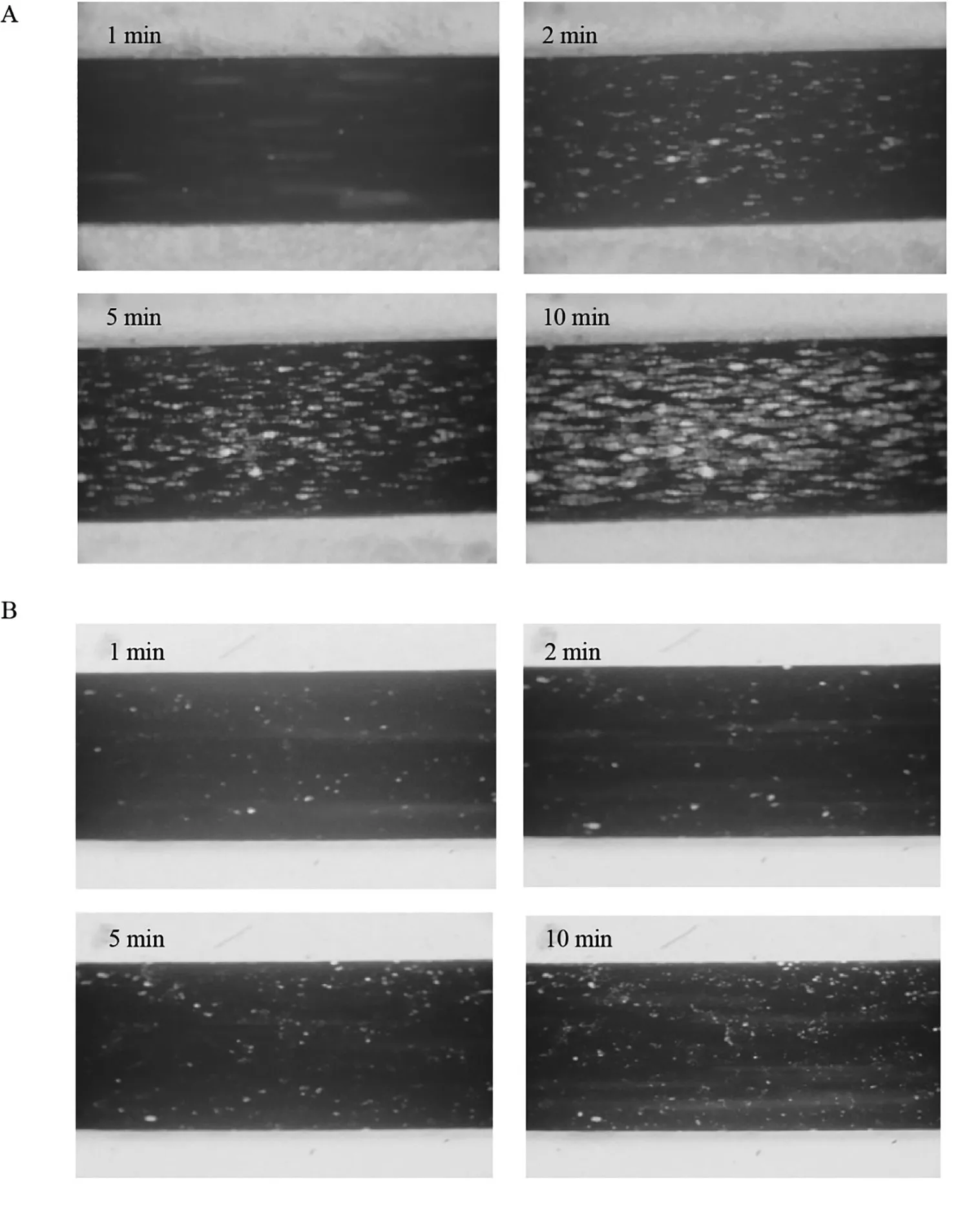
图3 流动状态下血小板在平板流动小室管腔表面的黏附
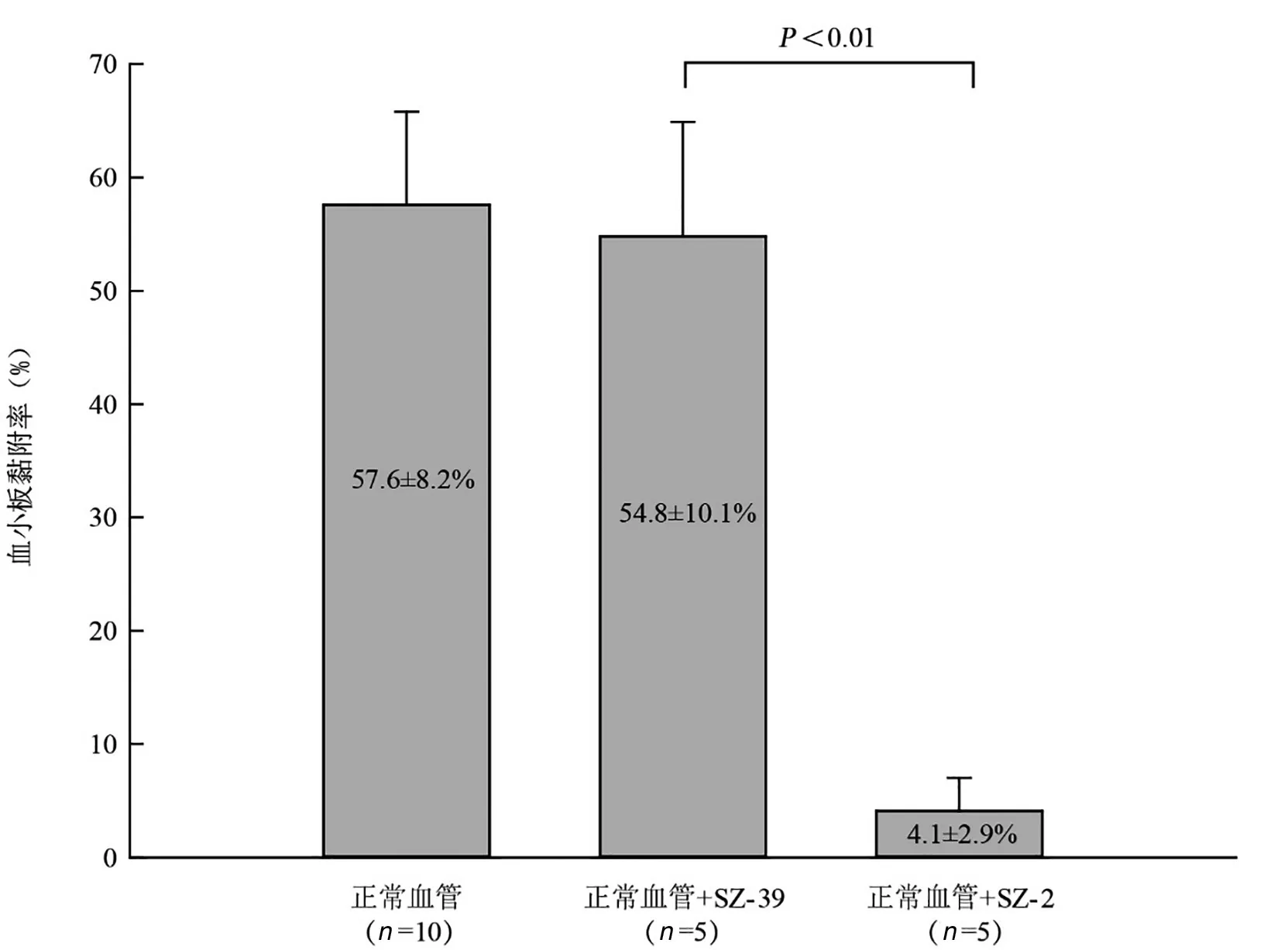
图4 血液样本中加入不同单克隆抗体后的血小板黏附率
2 血小板在病理血管条件下的黏附 使用图1B中的硅胶垫片,模拟血管内存在粥样斑块导致局部管腔狭窄时的血流状态,在同样加入SZ2单抗(20 μg/mL)条件下,虽然整个血管腔的血小板黏附率未见显著差异,但在管腔狭窄处两侧明显可见有顺血流方向分布的片状血小板黏附(图5)。

图5 模拟局部管腔狭窄时血小板的黏附(加入20 μg/mL SZ2)
使用图1B中的硅胶垫片,研究血管分支部位的血小板黏附情况,血管分支处的血小板明显呈大片状黏附、并相互聚集成团,大量标记荧光的血小板层叠后在图像中显示为过曝光白色区域(图6)。

图6 模拟血管分支部位血小板的黏附(未加黏附抑制剂)
3 流经平板小室的血小板聚集和活化检测 血小板由恒流泵推注流经平板小室,小室内包被的胶原属于活体内血管破损处暴露的基质成分之一。血小板表面膜糖蛋白GPIb通过血浆中VWF分子的介导与胶原相互作用,从而产生向内传导的信号促使血小板活化。活化血小板可出现聚集功能的改变以及膜表面CD-62P的表达。
研究结果显示,血小板流经模拟正常血管的平板小室后,ADP诱导聚集率未有显著改变;而流经模拟狭窄血管的平板小室后,ADP诱导聚集率增高,CD-62P的表达也呈现同样改变,显示狭窄血管所产生的湍流对血小板有一定的激活作用。研究中使用针对血小板GPIb的单抗SZ2作为黏附抑制剂,由于SZ2的作用,瑞斯托霉素和胶原诱导的血小板聚集被明显抑制(表1),但SZ-2对于血管狭窄所导致的CD-62P表达增高没有抑制作用。
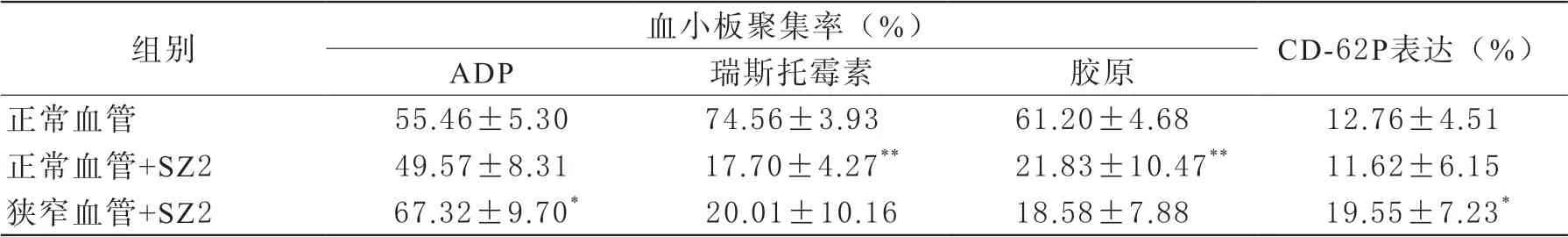
表1 血小板流经平板小室后的聚集活性和CD62P表达水平
讨 论
血栓栓塞性疾病是当前危害人类健康,导致病死率最高的原因之一,如心肌梗死,脑血栓形成,深静脉血栓形成,肺栓塞等。此外,血栓形成是许多疾病发病机制中涉及的一种重要病理过程,如动脉粥样斑块形成、肾小球肾炎、糖尿病小血管病变、妊娠高血压综合征等[1]。所有这些生理、病理性血栓的形成都始于血小板在血管壁的黏附。因此,检测血小板在血管壁上的黏附对于研究血小板功能、研制抗血栓药物等都有重要价值[11]。
有研究者尝试使用椎板黏度计模拟血流条件下的血小板黏附,但该装置无法进行表面黏附基质的包被,也不能进行实时观测;其后有研究者使用毛细玻璃管或平板小室,以及在平板小室基础上推出的BioFlux系统。毛细管和BioFlux系统对液体流动状态的模拟较为真实,但其管腔表面无法包被内皮细胞[10]。相较之下,平板流动小室原理简单,易于在显微镜下实时观测并且能在管腔内包被各种基质(包括胶原、VWF分子、内皮细胞等),是较为理想的研究血小板黏附的工具[12-13]。然而传统的平板流动小室仍然存在缺陷,一是为了便于使用倒置显微镜观察黏附结果,其采用聚乙烯培养皿为下层板,以真空负压将上下层平板及硅胶垫片贴合在一起,但在实际使用中,当血液流速增大、血流侧向剪切力接近动脉压力时,真空负压已无法将上下层紧密贴合最终导致血流渗漏。本研究中用具备一定厚度的有机玻璃板为下层板,以螺栓将整个装置紧合,同时在下层平板中开孔以便显微镜物镜贴近载玻片进行观测。这一改进既保证了检测装置的密闭,同时也不影响显微镜观测记录影像,实际使用效果良好,目前已申请专利。
研究中设计的平板流动小室由上层平板、硅胶垫片及下层板上的载玻片围成密闭的管腔,管腔高度取决于硅胶垫片厚度,管腔的形状和宽度取决于硅胶垫片中刻画出的通道。本研究利用硅胶垫片易于加工的特性,在常规平直通道以外,还设计了带有管腔内部有狭窄、有血管分支以及有静脉瓣膜的通道,用以模拟机体内存在血管粥样斑块、血流紊乱、瓣膜缺损等病理血管状态。根据流体动力学原理,在血管狭窄或分支处,血流处于湍流状态[14];而在湍流状态下施加于血小板的侧向剪切力大于稳流状态且方向复杂,血小板极易发生活化进而触发“外向内”信号传导通路,使血小板发生黏附和聚集[15]。本研究中的黏附实验显示,与平直血管相比,血管狭窄口前后的血小板黏附明显多于管腔其他部位;而在血管分支处,除可见片状血小板黏附,还可见多层血小板聚集,已呈现血小板血栓的形态。流经病理血管管腔的血液分离出的PRP,ADP诱导聚集增强且CD62P表达增多,显示其与正常对照相比具有更高的易栓倾向。由于粥样斑块形成等病理血管状态在易栓人群中普遍存在,因此,单纯以抗血小板黏附为靶向的抗血栓治疗难以获得理想的疗效,在临床实践中必须与抗血小板活化、抗血小板聚集药物联用。
研究中设计改良的平板流动小室可使用显微镜附带的CCD相机实时记录血小板黏附状态,对于研究血小板功能、血小板与血管内皮细胞,血小板与内皮下基质的相互作用、抗血栓药物的药效等都可以作为一种便捷易用的检测装置。我们使用该装置检测了多例健康供血者血小板的黏附,以及加入抗血小板抗体SZ-2后血小板黏附功能的改变,这些试验取得了较为满意的结果。在此基础上加以人机工学方面的改进,该装置有望成为检验血栓状态、监测抗血栓药物疗效的仪器在临床获得应用。
利益冲突所有作者均声明不存在利益冲突

