改性磁性材料对亚甲基蓝的吸附特性研究
彭传云,张少文,张星星,吴春来,冯勇,赵丹,赵联朝
(洛阳理工学院 环境工程与化学学院,河南 洛阳 471023)
吸附法是常见的复杂体系分离方法,常用于去除污水中的有毒有害污染物,相比生化处理和高级氧化技术,具有操作简单、成本低、安全高效等优势.当前,污染控制与治理技术已经成为影响经济社会发展的重要因素,其中水体中有机染料的吸附处理技术一直受到广泛关注[1-4].传统吸附材料与被吸附物质不易分离、难再生,存在二次污染风险,用于水处理的成本较高[5],近年来发展的Fe3O4磁性材料作为吸附介质可借助于外磁场作用较易实现与被吸附物质分离,方便重复使用;且通过对其进行表面修饰能显著改善吸附性能,提高可再生性,已逐渐成为近年的研究热点[6-7].例如聚吡咯修饰Fe3O4用于吸附合成纺织染料活性蓝,最大吸附量达到112.36 mg/g,用甲醇洗脱即可再生使用[8].GO/Fe3O4磁性复合材料和季铵盐修饰Fe3O4磁性材料均能实现对水中有机染料的有效富集[9].
壳聚糖作为一种来源丰富、成本低、无毒、可生物降解的天然高分子聚合物,与常见的Fe3O4磁性材料复合形成多功能复合材料,对有机染料[10]、抗生素[11]、重金属[12]有良好的吸附效果.但是,Fe3O4在空气中极易被氧化成γ-Fe2O3,还易发生团聚,限制了其在吸附领域的应用.在Fe3O4颗粒表面包覆SiO2,Al2O3,TiO2等材料,将能有效地弥补以上不足[13],其中SiO2能阻止颗粒团聚,具有良好的生物兼容性、亲水性,同时其表面的Si-OH有较高的反应活性,易于修饰改性.
本研究以共沉淀法制备Fe3O4磁性材料,用溶胶-凝胶法制得壳聚糖@SiO2包覆Fe3O4复合材料,以此提高磁性材料对亚甲基蓝的吸附效果.这种新型复合材料具有较高的比表面积、外磁场响应能力和重复利用性,在污水处理和生物分离等领域将具有广泛的应用前景.本文测定所制备磁性材料的吸附性能,研究不同吸附条件下,磁性复合材料对亚甲基蓝的吸附效果,并对吸附亚甲基蓝的吸附机理进行探讨.
1 实验部分
1.1 仪器与试剂
UV-1800pc型紫外可见分光光度计(济南来宝医疗器械有限公司);CHA-S型水浴恒温振荡器(常州国华电器有限公司);Vector 22型傅里叶变换红外光谱仪(德国Bruker公司);DX-2000型X射线粉末衍射仪(丹东方园仪器有限公司);ASAP 2020型N2吸附-脱附仪(美国Micromeritics Instruments公司);PPMS-VSM 型振动样品磁强计(美国Quantum公司).
FeCl3·6H2O,FeCl2·4H2O(天津市大茂化学试剂厂);壳聚糖(生化试剂)、氨水、冰醋酸和无水乙醇(国药集团化学试剂有限公司);正硅酸乙酯(天津市光复精细化工研究所);亚甲基蓝(天津红岩试剂厂),实验用水为实验室自制去离子水.
1.2 样品的制备
1.2.1Fe3O4磁性材料的制备
分别称取3.50 g FeCl3·6H2O和5.00 g FeCl2·4H2O置于洁净的三颈烧瓶中,加入20 mL去离子水,剧烈搅拌下水浴加热,升温至40 ℃,缓慢滴加10 mL浓氨水,在60 ℃下反应1 h,生成黑色沉淀,产物用去离子水洗至中性,再用无水乙醇洗涤5~8次,并进行磁分离,即制得Fe3O4磁性材料.其反应原理见图1.
1.2.2改性Fe3O4磁性材料的制备
称取0.25 g壳聚糖溶解于25 mL冰醋酸(3%,质量分数)中,室温下搅拌2 h,加入1 mL硅酸乙酯,继续反应2 h,然后分别加入60 mL无水乙醇和去离子水(V乙醇/V水=1/1)和自制Fe3O4材料,用6 mol/L的氨水调节反应体系pH为8~9,于40 ℃下继续搅拌4 h,所得产物用无水乙醇洗涤至中性,在70 ℃下干燥后即制得改性Fe3O4磁性材料(图2).
1.3 改性Fe3O4磁性材料表征
采用傅里叶红外光谱仪(FT-IR)对Fe3O4,改性Fe3O4磁性材料的化学键进行表征;通过X射线衍射分析仪(XRD)测定Fe3O4,改性Fe3O4磁性材料的晶体结构;采用SSA-4220微型仪器进行N2吸附-脱附等温线(77 K)研究,分析改性Fe3O4磁性材料的比表面积(BET);用振动样品磁强计(VSM)测定改性Fe3O4磁性材料的磁滞线(B-H).
1.4 吸附实验
1.4.1亚甲基蓝标准曲线的绘制
准确称取 50 mg的亚甲基蓝试剂,将其溶解,配制成100 mg/L的亚甲基蓝标准溶液,分别移取一定体积标准溶液至25 mL容量瓶,用去离子水定容,配制质量浓度分别为0.5,1.0,2.0,4.0,6.0,8.0,10.0 mg/L的亚甲基蓝标准溶液.以去离子水做空白,用紫外可见分光光度计测定吸收波长λmax= 664 nm处的吸光度,以质量浓度为横坐标作图,通过线性回归线得到标准曲线y=0.202 3x-0.017(R2=0.999 8).
1.4.2亚甲基蓝溶液的吸附实验
采用静态实验分析法,取25 mg吸附剂加入到20 mL 15 mg/L亚甲基蓝溶液中,调节pH=8.0,在20 ℃下震荡吸附30 min后,用磁铁进行磁分离,取上清液,用紫外分光光度计测定波长在664 nm时上清液的吸光度,由(1)式计算吸附剂对亚甲基蓝的去除率η(%).
(1)
式中:co表示亚甲基蓝在吸附前的质量浓度,mg/L;ce表示亚甲基蓝达到吸附平衡时的质量浓度,mg/L.
2 结果与讨论
2.1 改性Fe3O4磁性材料表征
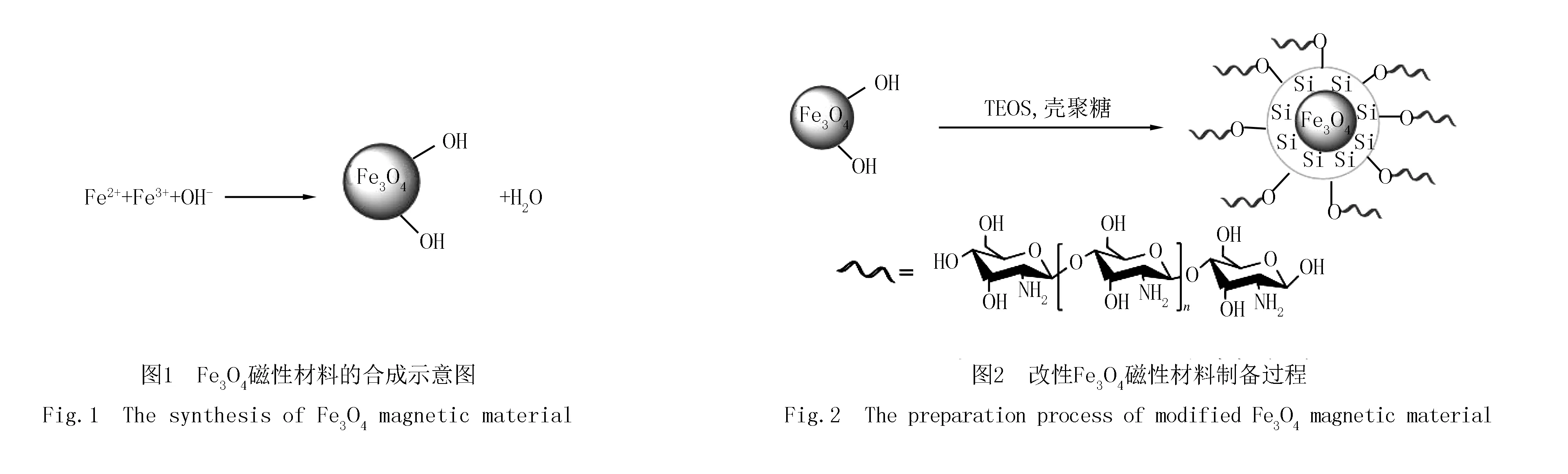
Fe3O4和改性Fe3O4磁性材料的红外光谱分析结果如图3中(a)所示,在549 cm-1处出现明显的Fe-O特征吸收峰;经过改性后,在2 914 cm-1和2 863 cm-1处的吸收峰是非对称和对称的-CH2的伸缩振动峰,1 614 cm-1和1 424 cm-1处对应的是N-H弯曲振动和C-N伸缩振动特征峰,表明壳聚糖成功修饰到材料表面;同时在1 062 cm-1处的吸收峰为Si-O-Si的反对称伸缩振动峰,表明在Fe3O4磁性材料中引入SiO2.
Fe3O4和改性Fe3O4磁性材料的XRD谱图如图3(b)所示,两种材料均在衍射角2θ为30.14°,35.54°,43.14°,53.58°,57.1°,62.7°,74.2°处出现了不同强弱的衍射峰,分别对应Fe3O4立方相的(220),(311),(400),(422),(511),(440),(533)晶面.对比之后可以发现,修饰前后,各衍射峰的峰位基本没有发生变化,改性Fe3O4并没有改变Fe3O4粒子的尖晶石结构.
利用N2吸附-脱附等温吸附表征改性Fe3O4磁性材料的比表面积和孔径分布,结果如图3(c)所示,按照IUPAC物理吸附等温线分类,该曲线符合Ⅳ型吸附脱附等温线(图3(c插图)),表明制备材料存在介孔结构.孔径分布图(图3(c))表明材料并没有形成较为集中的孔径分布,平均孔径为1.93 nm,主要分布在1.5~5.5 nm之间,材料的比表面积为131.73 m2/g.表明材料具有较大的比表面积,有利于吸附作用.
在室温下用振动样品磁强计测试了改性Fe3O4磁性材料的磁学性能,所得磁滞曲线.如图3(d)所示,改性Fe3O4粒子的饱和磁化强度为85.84 emu/g,与文献报道的SiO2包覆铁氧体磁性复合材料饱和磁化强度26 emu/g[14]及 Fe3O4@C磁性复合材料饱和磁化强度为18.45 emu/g[15]相比,磁性强度大,表明制备的改性Fe3O4磁性材料具有很好的磁性;所制备磁性材料的磁滞回线通过原点,且以原点为中心对称,表明无剩磁现象,矫顽力为0.磁滞和零矫顽力结果说明改性Fe3O4为超顺磁性[16],即在外磁场作用下,磁性材料可以快速地分离.震荡吸附前后对比显示,常温常压下,通过外加磁场作用,吸附剂能够被快速有效地吸引,使亚甲基蓝溶液变澄清.
图3(e)是改性Fe3O4热失重曲线,在200 ℃以下所失去的质量约为3%,主要是材料表面吸附的水.200~700 ℃失去的质量约为11%,应为壳聚糖的分解.图3(f)是Fe3O4及改性Fe3O4TEM图,改性Fe3O4磁性材料为核壳结构,其中颜色较深的为Fe3O4纳米颗粒,外层颜色较浅的是壳聚糖复合SiO2层.
2.2 改性磁性材料的吸附特性

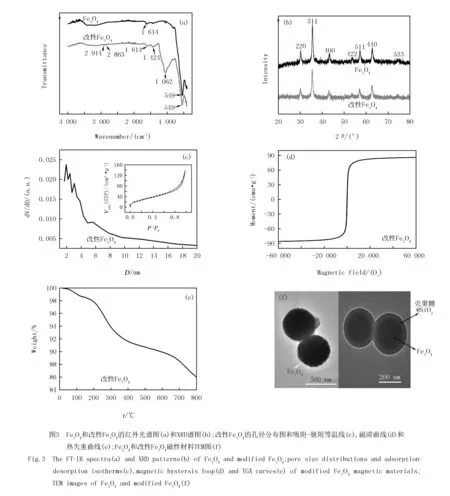
比较Fe3O4和改性Fe3O4材料对亚甲基蓝吸附效果(图4),壳聚糖、SiO2分子的引入明显提升Fe3O4对亚甲基蓝的吸附作用,壳聚糖分子结构中的羟基、氨基等基团有助于和亚甲基蓝分子间的相互作用[17].
2.2.1pH值
实验探究了pH= 6~11条件下,改性Fe3O4磁性材料对亚甲基蓝的吸附效果.如图5(a)所示,吸附剂对亚甲基蓝的去除率η在pH为6~8时逐步增大;当pH=8时,η达到最大值为94.53%.产生这种变化的原因可能是亚甲基蓝为偶氮有机阳离子型染料,在pH值较小时,溶液显酸性,过剩的氢离子与亚甲基蓝阳离子之间会产生竞争吸附,从而导致吸附剂对亚甲基蓝的去除效果较差;随后,当pH≥8时,吸附剂表面的含氧基团不断电离,并带有更多的负电荷,为吸附亚甲基蓝提供了众多的带电吸附位点,增加了吸附剂与亚甲基蓝阳离子的静电引力,使得亚甲基蓝的去除率趋于吸附平衡,因此将亚甲基蓝溶液的pH值控制在8最合适.
2.2.2吸附时间
实验探究了吸附时间在1~120 min的条件下,改性Fe3O4磁性材料对亚甲基蓝的吸附效果.如图5(b)所示,在最初10 min内,吸附剂的去除率η从65.56%迅速增加到89.39%;当吸附时间从10 min增加到30 min时,η增加到92.95%,增速减慢;当吸附时间继续增加到120 min时,η在92.95%左右波动.这是因为在吸附初期,亚甲基蓝质量浓度梯度大,扩散速率快,壳聚糖表面氨基、羟基等活性集团数量充足,表面活性空位多,故η增幅大[17];到30 min时吸附趋于饱和,随着吸附时间的延长,吸附剂表面活性空位逐渐被消耗逐步而减少,同时,亚甲基蓝的吸附使吸附剂表面显示一定的正电性,由于同种电荷相互排斥,亚甲基蓝不易被吸附.综合考虑最佳吸附时间为30 min.
2.2.3温度
实验探究了吸附温度在20~60 ℃的条件下,改性Fe3O4磁性材料对亚甲基蓝的吸附效果.如图5(c)所示,保持其他条件不变,当吸附温度从20 ℃上升到60 ℃时,η逐渐降低,在20 ℃时,η最高为92.70%.说明升高温度并不利于吸附剂对亚甲基蓝的去除,吸附过程为放热过程.
2.2.4吸附剂用量
实验探究了吸附剂用量在1~100 mg的条件下,改性Fe3O4磁性材料对亚甲基蓝的吸附效果.如图5(d)所示,当改性Fe3O4磁性材料的用量从1 mg增加到25 mg时,η急剧增大,从18.26%增加到94.53%;当吸附剂用量从25 mg增加到100 mg时,η的增幅相对缓慢,最高可达98.73%.当亚甲基蓝的初始质量浓度一定时,去除率的变化主要由吸附剂表面吸附活性位点决定,当吸附剂用量较少时,较少的吸附位点导致去除效果较低,即单位质量吸附剂所包围的亚甲基蓝分子越多,吸附剂与亚甲基蓝分子越易结合;随后吸附剂用量不小于25 mg时,吸附剂提供足够的吸附活性位点,亚甲基蓝几乎被完全吸附,去除效果趋于吸附平衡,因此加入吸附剂最佳用量为25 mg.
2.2.5染料初始质量浓度
实验探究了染料初始质量浓度在5~35 mg/L的条件下,改性Fe3O4磁性材料对亚甲基蓝的吸附效果.如图5(e)所示,当亚甲基蓝初始质量浓度为5 mg/L时,改性Fe3O4磁性材料对亚甲基蓝的η稳定在92.81%;随着亚甲基蓝初始质量浓度从5 mg/L增加到15 mg/L时,改性Fe3O4磁性材料对亚甲基蓝的η稳定在92.23%以上;当亚甲基蓝初始质量浓度大于15 mg/L时,η急剧下降.说明在亚甲基蓝初始质量浓度较低时,亚甲基蓝的质量浓度与吸附剂表面的有效吸附活性位点的比率较低,亚甲基蓝质量浓度不限制吸附行为;当初始质量浓度在一定范围增加时,亚甲基蓝的质量浓度与吸附剂表面的有效吸附活性位点的比率增加,同时增加了传质的推动力,减少了吸附的阻力,增加了吸附活性位点与亚甲基蓝的接触面积,使吸附率变化很小,处于吸附平衡状态;随着初始质量浓度的增大,亚甲基蓝对数量一定的活性位点的竞争更加激烈,一定量的吸附剂只能提供一定量的活性位点用来吸附,导致吸附率急剧下降.因此亚甲基蓝的初始质量浓度控制在15 mg/L较为合适.
2.2.6吸附动力学研究
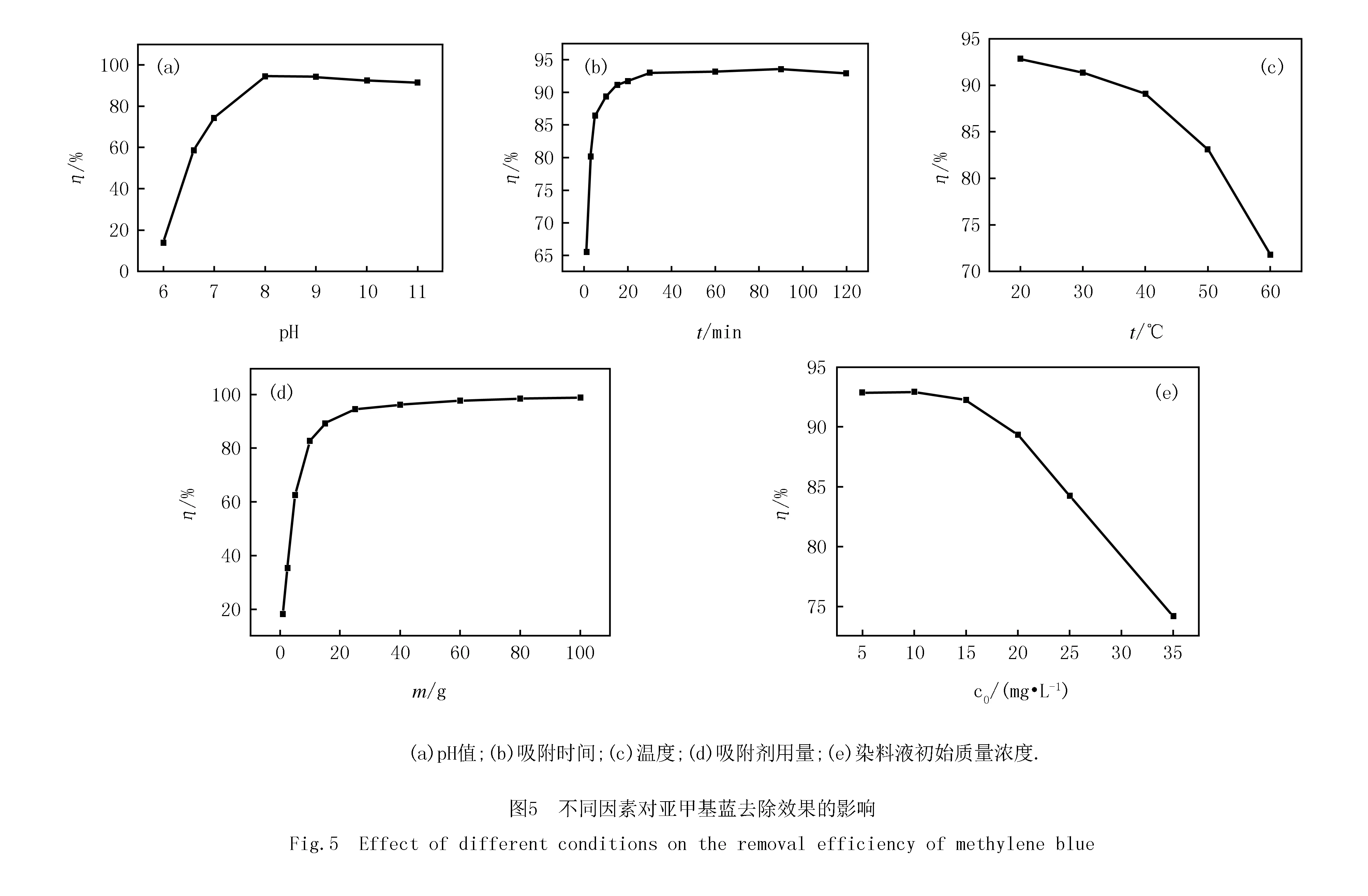
吸附动力学在分析吸附过程扮演着重要的角色,能够形象地描述吸附剂与吸附质发生的表面吸附和化学反应的控制机理.为了研究改性Fe3O4磁性材料去除亚甲基蓝的动力学特征,本文采用准一级动力学模型和准二级动力学模型对实验数据进行拟合,并用相关系数R2作为评价标准.
准一级、准二级动力学线性表达方程分别为(2)和(3)式:
ln(qe-qt)=ln(qe-k1t),
(2)
(3)
式中,qe为平衡时的吸附量,mg/g;qt为吸附t时的吸附量, mg/g;k1为准一级动力学常数,1/min;k2为准二级动力学常数,g/(mg·min);t为吸附时间,min.
图6是改性Fe3O4磁性材料吸附亚甲基蓝经吸附动力学拟合曲线,通过对吸附数据进行动力学模型拟合之后得到的参数k1,k2,qe及R2列于表1.从拟合结果来看,采用准一级动力学方程线性拟合得到的平衡吸附容量qe,cal(0.329)与实际测的真实值qe,exp(7.562)相差很大,而采用准二级动力学方程线性拟合得到的平衡吸附容量qe,cal(7.547)十分接近实测结果.另外亚甲基蓝溶液所对应的准一级吸附速率方程的相关系数R2为0.497 2低于准二级吸附速率方程的相关系数R2=1.由此判断,吸附剂对亚甲基蓝溶液的吸附过程符合准二级动力学模型,同时表明该吸附过程可能受化学吸附速率控制[18].

表1 吸附剂对亚甲基蓝的吸附动力学参数表
2.2.7吸附热力学研究
吸附等温线是描述吸附质与吸附剂之间的相互关系.常用Langmuir等温吸附模型和Freundlich等温吸附模型研究液固间平衡吸附的机制,并对吸附平衡的数据进行拟合和分析.Langmuir等温吸附模型主要是假设吸附过程为单分子层吸附.Freundlich模型是吸附等温经验式,吸附过程比较复杂,其假设是非均相的多分子层吸附.本文以Langmuir等温吸附模型和 Freundlich等温吸附模型拟合实验数据.
Langmuir 等温线性表达方程和Freundlich 等温线性表达方程分别见(4)式和(5)式:
(4)
(5)
式中,qe为平衡吸附量,mg/g;qm为最大吸附量,mg/g;ce为平衡时染料的质量浓度,mg/L;KL为Langmuir吸附常数,L/mg;KF为Freundlich 吸附常数,L/mg;n为Freundlich指数.
图7是改性Fe3O4磁性材料对亚甲基蓝的吸附等温拟合图,通过拟合直线的斜率和截距,可以求出KL,qm,1/n,KF和R2等参数,列于表2.从拟合结果可以看出,Freundlich模型的线性相关系数R2相比于Langmuir 模型的R2更接近1,表明吸附剂对亚甲基蓝的吸附过程符合Freundlich等温吸附,该吸附属于吸附剂不均匀表面的多层吸附[19].KF随着温度的升高而减小,进一步说明温度升高不利于吸附进行,该吸附是个放热过程[20].
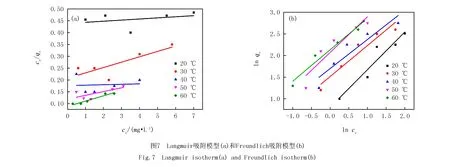
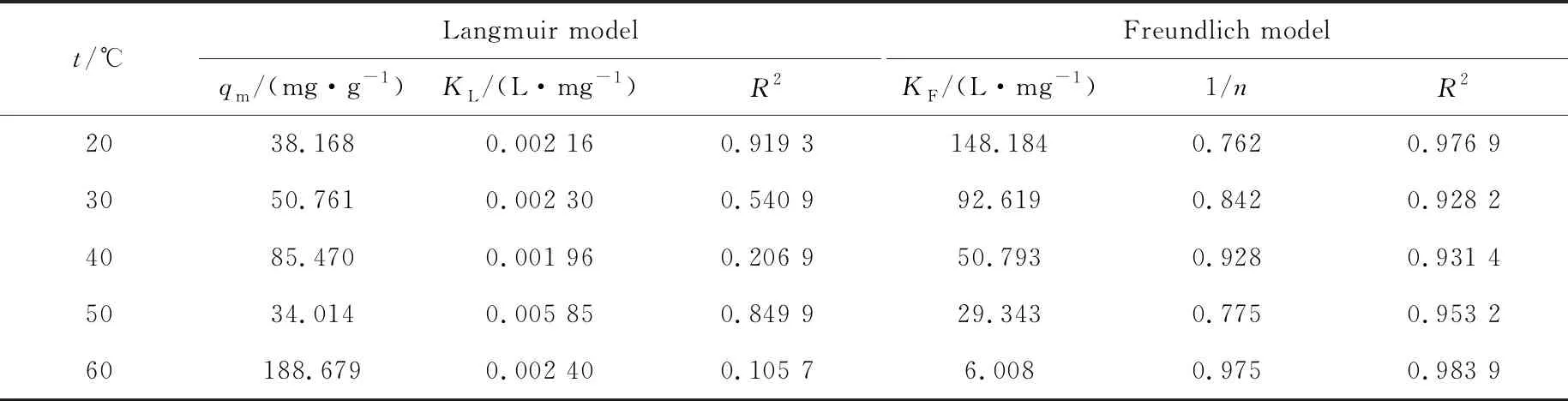
表2 Langmuir与Freundlich吸附模型的参数表
通过研究吸附热力学参数来研究吸附过程所能达到的程度,吸附过程的热力学参数主要包括自由能(ΔG)、焓(ΔH)和熵(ΔS)等.这些热力学参数可由(6~8)式计算得到[21]:
(6)
(7)
ΔG=-RTlnKd,
(8)
式中,qe为平衡吸附量,mg/g;ce为溶液平衡质量浓度,g/L;Kd为平衡分配系数常数,L/g;T是绝对温度,K,R是理想气体常数.
热力学相关参数计算结果如表3所示,ΔG<0,表明改性Fe3O4磁性材料吸附亚甲基蓝的过程是自发进行;ΔS=-48.12(J·mol-1·K-1),表明在吸附过程中,体系熵值减少,即改性Fe3O4吸附亚甲基蓝的过程中,整个水溶液体系的混乱度减少[22];ΔH=-14.22(kJ·mol-1),吸附过程放出热量,升高温度不利于吸附,与实验结果符合.以上结果表明,该材料对亚甲基蓝的吸附是自发进行的,同时伴随体系能量的降低.

表3 吸附热力学参数
2.3 吸附材料的重复利用
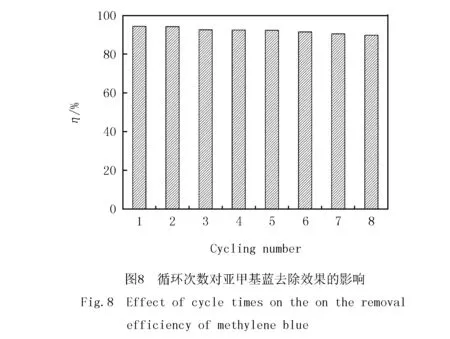
实验取 25 mg材料进行重复性实验,用20 mL初始质量浓度15 mg/L的亚甲基蓝溶液为吸附对象,按1.4.2节实验步骤重复吸附实验8次.以0.1 mol/L的NaOH为解析剂,改性Fe3O4对亚甲基蓝去除率的变化如图8.通过8次吸附实验,吸附剂对亚甲基蓝的去除率由94.53%变为89.76%,数值略有下降.改性Fe3O4材料具有较好的吸附能力和良好的重复性.
3 结 论
将壳聚糖和SiO2功能化修饰在Fe3O4磁性材料的表面,成功合成了改性Fe3O4磁性材料.采用了FT-IR,XRD,BET和VSM表征手段对磁性复合材料进行表征,探讨了不同吸附条件对亚甲基蓝吸附过程的影响,并进一步对吸附过程进行动力学和热力学的研究.结果表明,经过改性,Fe3O4磁性材料对亚甲基蓝有较好的去除效果,当磁性材料的投加量为25 mg,pH为8,吸附时间为30 min,吸附温度为20 ℃时,对亚甲基蓝的去除效果最佳,去除率为94.53%.该吸附过程可能是化学吸附及不均匀表面的多层吸附;吸附过程是自发放热过程,且体系的混乱度减少;具有较好的吸附能力和良好的重复性.

