利拉鲁肽联合德谷胰岛素对2型糖尿病患者血糖波动的影响
姚明言,张靖,王杰,李志红△,尹飞
血糖波动(glycemic variability,GV)的幅度增大和时间增加均会导致糖尿病患者低血糖和高血糖发生风险增高,是糖尿病并发症的独立危险因素[1]。国内外专家共识[2]指出血糖监测“核心指标”为GV及葡萄糖目标范围内时间(time in range,TIR),其联合评估在临床研究中具有重要意义。利拉鲁肽是长效胰高糖素样肽1 受体激动剂(glucagon-like peptide 1 receptor agonists,GLP-1RAs),具有减少血糖波动、降低低血糖的风险、保护胰岛β 细胞等功能[3]。本研究应用利拉鲁肽联合德谷胰岛素治疗2型糖尿病患者,以扫描式葡萄糖监测(flash glucose monitoring,FGM)获取动态葡萄糖图谱(ambulatory glucose profile,AGP),并测量基线和研究终点时血清氧化应激水平,比较利拉鲁肽与德谷胰岛素短期联合与每日多次胰岛素注射(multiple daily insulin injections,MDI)治疗2型糖尿病患者的效果。
1 对象与方法
1.1 研究对象 研究首先纳入2021年2—6月于保定市第一中心医院内分泌科住院的2 型糖尿病患者共75 例。纳入标准:(1)符合1999年世界卫生组织(WHO)关于2型糖尿病的诊断标准[5]。(2)年龄>20岁。(3)应用二甲双胍(1 500 mg/d)和多次皮下胰岛素注射(基础胰岛素+速效胰岛素类似物或预混胰岛素)治疗至少1个月,未使用任何其他降糖药物。(4)糖化血红蛋白(HbA1c)6.5%~9.0%。(5)体质量指数(BMI)24~35 kg/m2。排除标准:(1)不能或不愿意应用FGM。(2)严重急性或慢性糖尿病并发症。(3)空腹C肽<0.17 nmol/L。(4)严重感染。(5)肾功能异常(男性血清肌酐水平≥133µmol/L或女性血清肌酐水平≥124µmol/L)。(6)严重肝功能异常。(7)严重心血管疾病。(8)孕期或哺乳期妇女。(9)对利拉鲁肽过敏或有禁忌证。本研究所有患者均签署伦理知情同意书。
1.2 方法
1.2.1 样本量的设置 应用PASS 15软件计算研究所需样本量。根据文献[4]报道,德谷胰岛素/利拉鲁肽注射液治疗平均血糖波动幅度(mean amplitude of glycemic excursions,MAGE)为下降1.3 mmol/L,TIR 升高35%。采用非等效性检验,按照1∶1分配的原则,取双侧α=0.05,β=0.20计算需样本量50例(每组25例),考虑到10%的脱落率,将样本量设置为56 例(每组28 例)。最终52 例患者符合入组标准,按照随机数字表法将其分为试验组和对照组,每组26例。
1.2.2 治疗方法 所有患者住院期间均接受糖尿病饮食、运动指导以及14 d 的FGM。空腹血糖(FPG)控制目标为4.4~6.1 mmol/L,餐后2 h 血糖控制目标为5.0~8.0 mmol/L。试验组及对照组均在睡前皮下注射德谷胰岛素(诺和达,丹麦诺和诺德公司),起始剂量0.15 U/kg,如FPG 未达标,则每日睡前德谷胰岛素增加2~4 U。试验组入院第2 天早餐前皮下注射利拉鲁肽(诺和力,丹麦诺和诺德公司)0.6 mg,如无呕吐或恶心等不耐受,每3 d 增加1 次剂量,从最初的0.6 mg/d 增加到1.2 mg/d,直至1.8 mg/d。对照组三餐前注射门冬胰岛素(诺和锐,丹麦诺和诺德公司),起始总量0.3 U/(kg·d),早、中、晚餐按照1∶1∶1分配,如对照组餐后血糖未达标,则相应餐前门冬胰岛素增加2~4 U直至血糖达标。如出现低血糖,则胰岛素减少2~4 U。轻度低血糖定义为有低血糖症状,测量血糖值<3.9 mmol/L,能自行处理。如出现中枢神经系统症状、不能自行处理的低血糖定义为严重低血糖。
1.2.3 观察指标 FGM 系统受试者应至少每8 h 扫描1 次,以每日7 次为佳(三餐餐前、三餐餐后2 h 及睡前),系统每15 min自动记录葡萄糖数据。14 d后下载葡萄糖监测数据,并应用软件(E-Follow up software)生成AGP报告。血糖统计包含以下指标:MAGE、日间血糖平均绝对差(mean of daily differences,MODD)、标准差(standard deviation,SD)、变异系数(coefficient of variation,CV)、四分位数间距(inter-quartile range,IQR)、预估糖化血红蛋白(estimated HbA1c,eHbA1c)、TIR(3.9~10.0 mmol/L)、葡萄糖高于目标范围(>10.0 mmol/L)时间(time above range,TAR)和葡萄糖低于目标范围(<3.9 mmol/L)时间(time below range,TBR)。在研究开始和结束时由同一护士用同一台仪器测量患者体质量,计算BMI。收集患者性别、年龄、糖尿病病程、糖尿病家族史。应用脂酶法检测总胆固醇(TC)、三酰甘油(TG),高压液相色谱法检测HbA1c,液态酶法检测血清糖化白蛋白(glycated albumin,GA),化学发光免疫法检测空腹C肽、微量白蛋白尿,酶联免疫吸附试验(ELISA)检测8 异前列腺素F2α(8-iso-PGF2α)、8-羟基脱氧鸟苷(8-OHdG)和1,5-脱水葡糖醇(1,5-AG)、C反应蛋白水平。
1.2.4 研究终点 主要研究终点为治疗14 d 后GV 参数和TIR 与基线相比的变化。次要研究终点为低血糖情况、氧化应激水平和体质量较基线改变情况。
1.3 统计学方法 应用SPSS 22.0软件进行数据分析。使用Kolmogorov-Smirnov 正态性检验分析变量的分布。正态分布的连续变量以±s表示,采用独立样本t检验或配对t检验。非正态分布连续变量以M(P25,P75)表示,采用Mann-WhitneyU检验。分类变量以例或例(%)描述,采用χ2检验、Fisher’s精确概率法或Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
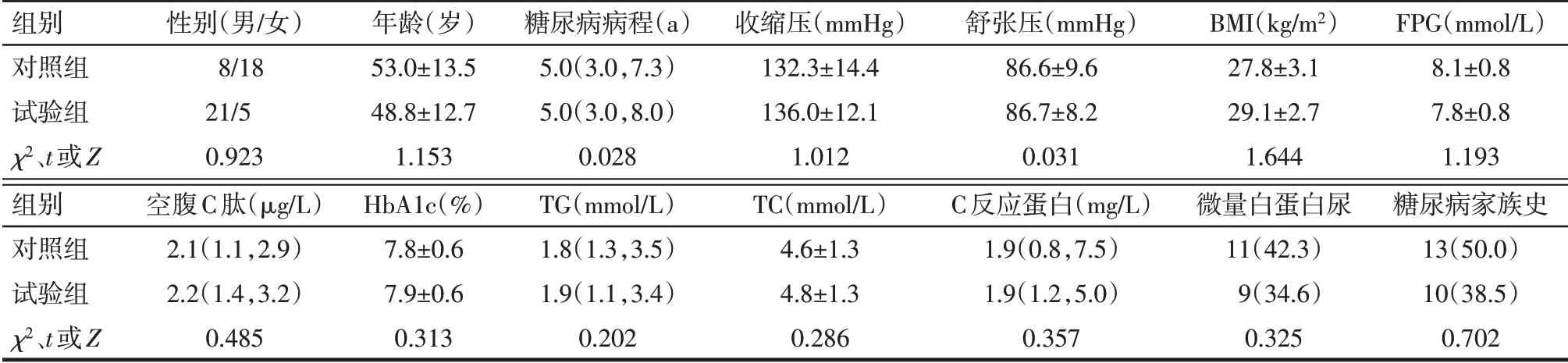
2.1 2 组患者的基线特征 2 组性别、年龄、糖尿病病程、血压、BMI、FPG、空腹C 肽、HbA1c、TG、TC、C反应蛋白、微量白蛋白尿、糖尿病家族史比较差异均无统计学意义(P>0.05),见表1。
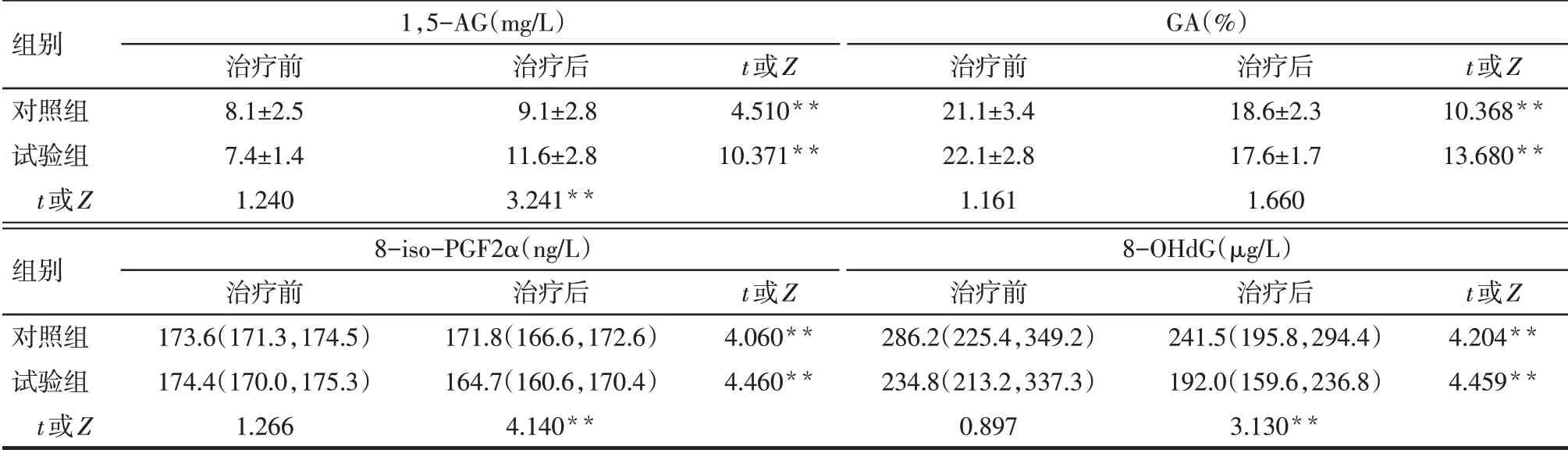
2.2 2 组血糖波动参数变化 治疗后试验组MAGE、eHbA1c 明显低于对照组,差异有统计学意义(P<0.05),见图1。治疗后对照组与试验组TIR均较治疗前明显延长(t分别为6.356 和9.424,P<0.05),TAR 明显缩短(t分别为5.676 和9.411,P<0.05),对照组与试验组治疗后TIR、TAR比较差异无统计学意义(t分别为1.403 和1.640,P>0.05);试验组治疗后TBR 明显低于对照组(t=2.604,P<0.05),见图2。治疗后2组血清1,5-AG均明显升高,GA均明显降低,试验组1,5-AG 升高(4.3±2.1vs1.1±1.2,t=6.795,P<0.01)及GA 降低(4.5±1.7vs2.6±1.3,t=4.695,P<0.01)较对照组更显著,差异有统计学意义(P<0.01),见表2。
Tab.1 Comparison of baseline characteristics between the two groups of patients表1 2组患者的基线资料比较 (n=26)
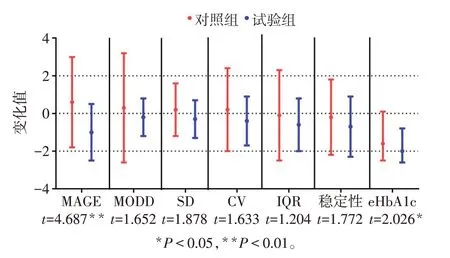
Fig.1 Changes of glycemic variability parameters in the two groups图1 2组血糖波动参数变化
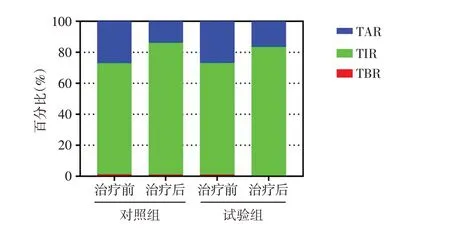
Fig.2 Time percentages of different glucose intervals in the two groups图2 2组不同葡萄糖区间时间百分比
Tab.2 Changes of GA and 1,5-AG levels before and after treatment in the two groups表2 2组治疗前后GA和1,5-AG变化 (n=26)
2.3 2 组氧化应激标志物变化 2 组治疗前氧化应激标志物8-iso-PGF2α、8-OHdG差异无统计学意义(P>0.05)。治疗后2 组8-iso-PGF2α 和8-OHdG 水平均降低,试验组8-iso-PGF2α 和8-OHdG 水平低于对照组(P<0.01),见表2。
2.4 2组体质量和胰岛素剂量的变化 治疗前2组体质量差异无统计学意义(P>0.05)。治疗后试验组体质量稳定下降,对照组无明显改变,2组治疗前后差值差异有统计学意义(P<0.01)。试验组与对照组相比,治疗前后每日胰岛素用量的差异有统计学意义(P<0.01),见表3。
Tab.3 Changes of body weight and medication dose in the two groups of patients表3 2组患者体质量和用药剂量的变化(n=26,±s)
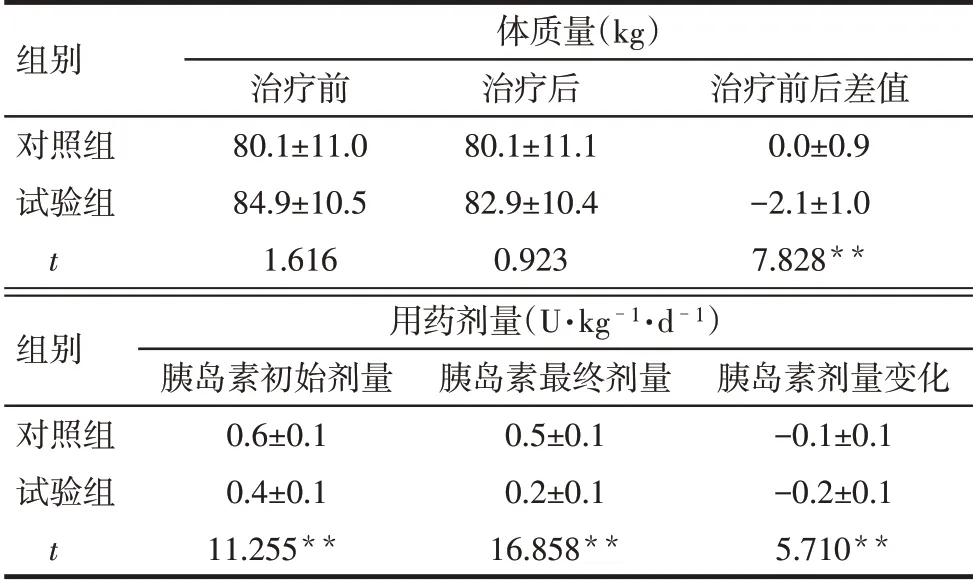
Tab.3 Changes of body weight and medication dose in the two groups of patients表3 2组患者体质量和用药剂量的变化(n=26,±s)
**P<0.01。
组别对照组试验组t体质量(kg)治疗前80.1±11.0 84.9±10.5 1.616治疗后80.1±11.1 82.9±10.4 0.923治疗前后差值0.0±0.9-2.1±1.0 7.828**组别对照组试验组t用药剂量(U·kg-1·d-1)胰岛素初始剂量0.6±0.1 0.4±0.1 11.255**胰岛素最终剂量0.5±0.1 0.2±0.1 16.858**胰岛素剂量变化-0.1±0.1-0.2±0.1 5.710**
2.5 安全性 试验组中4 例(15.4%)在应用利拉鲁肽0.6 mg/d 后出现了短暂的轻度食欲下降,7 例(26.9%)应用利拉鲁肽1.2 mg/d后出现恶心,未继续增加剂量。应用利拉鲁肽1.8 mg/d后,1例(3.8%)出现呕吐,1 例(3.8%)出现腹泻,但恢复到1.2 mg/d 后症状有所改善。9例(34.6%)应用利拉鲁肽1.2 mg/d,17 例(65.4%)应用利拉鲁肽1.8 mg/d。利拉鲁肽的平均剂量为1.6 mg/d。试验组有1 例(4.0%)发生2次轻度餐前低血糖,对照组有4 例(15.3%)发生9 次轻度餐前低血糖,2 组均无严重低血糖及夜间低血糖记录。
3 讨论
本研究显示2型糖尿病患者采用利拉鲁肽联合德谷胰岛素或每日多次胰岛素注射的治疗方案均有利于血糖控制,在降低血糖波动、低血糖率、体质量与减轻氧化应激方面,利拉鲁肽与德谷胰岛素联合治疗能使患者获益更大。
GV 与氧化应激、炎症和内皮功能障碍相关[6],参与糖尿病大血管和微血管并发症发生发展。既往研究发现,TIR 与平均血糖、高血糖指数及GV 密切相关[7]。本研究结果显示,2组治疗后TIR与TAR均有显著改善,2组均实现了良好的血糖控制,其中试验组MAGE 降低更显著,在降低GV 方面更具优势,这与Lane 等[8]研究结果一致。1,5-AG 是广泛存在且化学性质相对稳定的单糖,当血糖超过肾糖阈时,尿1,5-AG 增多,血1,5-AG 水平下降。有研究证实,1,5-AG与1~2周内血糖水平呈反比,能反映短期内GV,且与GV的相关性强于HBA1c和果糖胺[9]。本研究同时检测了1,5-AG 和GA,治疗后试验组血清1,5-AG升高及GA降低更明显,提示利拉鲁肽联合德谷胰岛素治疗可更好地控制GV。同时,试验组TBR 明显低于MDI 组,提示利拉鲁肽与德谷胰岛素的联合应用减少了低血糖的发生,具有更好的安全性。
氧化应激参与糖尿病及其并发症的发生发展。8-iso-PGF2α 是近年发现的异前列腺素类代谢产物,结构性质稳定,敏感度和特异度强,被认为是评价机体氧化应激损伤的理想生物学指标[10]。8-OHdG 是一种DNA 损伤的氧化应激生物标志物,其水平升高有助于2型糖尿病的早期诊断和疗效的监测[11]。本研究结果表明,治疗后,与对照组相比,试验组8-iso-PGF2α 和8-OHdG 降低更明显,提示利拉鲁肽与德谷胰岛素短期联合应用有改善氧化应激的作用。
GLP-1RA的减重机制包括促进饱腹感、降低食欲和减少脂肪合成等[12]。其可通过减重及减少氧化应激而降低心血管风险,独立于降血糖作用[13]。本研究试验组体质量下降(2.1±1.0)kg,与有关文献报道的利拉鲁肽减轻体质量的结论一致[14]。研究证实,德谷胰岛素-利拉鲁肽复方制剂临床应用获益包括降低HbA1c、体质量及防止低血糖等风险[15],但该药物尚未在我国上市。一项日本的临床研究将接受MDI的2型糖尿病患者改用利司那肽和基础胰岛素联合治疗,结果显示患者的满意度得到提高,同时血糖控制良好[16]。本研究应用利拉鲁肽与德谷胰岛素联合治疗方案,与每日多次胰岛素注射相比,该方案简便易行,患者容易接受,进而可提高依从性,降低治疗中断概率,且该联合应用方案有助于降低低血糖风险,改善血糖波动和氧化应激水平,从而有利于防止糖尿病并发症的发生和发展。
本研究尚有不足之处,由于本研究是单中心研究,受试来自住院患者,存在选择偏倚。其次,本研究样本量较估算值增加了12%,完成研究样本量较估计值增加了4%,但由于样本量仍相对较小,可能存在统计功效不足的缺点。笔者后续将增加样本量、延长随访时间开展进一步研究。
综上所述,在2型糖尿病患者中,利拉鲁肽与德谷胰岛素的短期联合应用能获得良好的血糖控制,同时在改善血糖波动、低血糖发生率、氧化应激水平、体质量等方面优于每日多次胰岛素注射。

