miR20a自噬炎症小体在子宫内膜异位组织中表达及意义
吕冰峰 秦锦龙
1.江苏省张家港市第二人民医院(215600);2.同济大学附属上海市第四人民医院
子宫内膜异位症(EMs)机制尚未清楚,经血逆流学说为目前EMs发病主流学说,但最新研究表明EMs是一个复杂的慢性疾病,经血逆流很可能只是EMs的诱因,后续复杂的基因、免疫与环境因素间相互作用在EMs进程中发挥重要作用。微小核糖核酸(RNA))能特异性识别并结合到mRNA的3’非翻译区,在参与靶基因表达后进行负调控。miR20a为该家族成员[1],与细胞免疫联系紧密,对EMs患者的自身免疫炎症性疾病具有调节作用[2];miRNA可调节一些炎性因子表达以控制炎症,并在某些炎症小体的相关信号通路中发挥调控作用[3]。炎症小体是免疫系统重要部分,具有促进人体形成天然免疫力,对细菌、病毒等有特异性识别作用[4]。研究表明,细胞自噬是对病原微生物引起的炎症反应进行的精准调控,避免过度炎症反应对人体造成的伤害,构建成自噬-炎症小体通路[5]。miRNA能够从转录后水平对基因表达进行负调控,但不会导致基因消除。miR20a可精细调节自噬-炎症小体信号通路,对治疗EMs非常重要[6]。因此,本研究探讨miR20a-自噬-炎症小体通路在EMs发病中的作用机制。
1 资料与方法
1.1 一般资料
回顾性收集2019年1月-2020年12月就诊于本院妇产科的EMs患者住院病历,选择子宫内膜组织60例为EMs异位组,年龄(30.4±5.1)岁(24~46岁);年龄相匹配非ENs女性正常子宫内膜组织60例为对照组,年龄(31.5±6.2)岁(24~48岁)。纳入标准:①经病理确诊Ems;②年龄25~48岁;③月经周期正常,处于卵泡期。排除标准:①拒绝参与本项研究;②并发心脏病,高血脂等代谢异常的疾病;③并发严重的感染性和炎症性等疾病;④并发器官功能障碍;⑤盆腔炎性肿瘤,多囊卵巢综合征;⑥妊娠和哺乳期。纳入者均自愿签署协议书,研究获得院伦理委员会批准。
1.2 方法
1.2.1组织收集与细胞转染腹腔镜检查或手术刮宫治疗取得两组样本120份,-55℃储存。37℃ 5% CO2培养,DMEM含100U/ml青霉素+100mg/ml链霉素+10%胎牛血清。将EMs细胞以104细胞/孔密度接种到6孔板中,细胞融合度达60%时进行细胞转染,转染前24h将正常血清更换为无双抗100ml/L胎牛血清的DMEM培养液。将异位组织处理后分为EMs异位细胞(EMs组,正常培养),脂多糖(LPS)诱导的EMs异位细胞(诱导组,加入LPS 10μg/ml),LPS诱导及mi20a转染的EMs异位细胞(转染组,加入LPS 10μg/ml和miR20a-inhibitor慢病毒转染)。24h后行后续实验。
1.2.2内膜组织中miR20a表达实时荧光定量法检测组织中miR20a表达:采用 Trizol RNA 分离试剂(美国生命技术公司),用TRIzol试剂盒(武汉艾迪抗生物科技有限公司)提取总RNA,以5μl细胞中总RNA为模板,用TaqMan 逆转录试剂盒(北京百奥莱博科技有限公司)在安誉AGS8830-8实时荧光定量 PCR 仪(济南千司生物技术有限公司)行逆转录合成 cDNA。实验用引物在武汉金开瑞生物工程有限公司合成,上游和下游引物序列分别为:miR-20a:5'-CTCAGTTCCTACGCTTCGCA-3',5'-GTCGAGGTCAGTGAACAGCA-3';U6:5'-GCTTCGGCAGCACATATACTAAAAT-3',5'-CGCTTCACGAATTTGCGTGTCAT-3';实时荧光定量PCR,总反应体系30 μl,含有5 μl引物对、5μl cDNA、10μl Power SYBR Green Master Mix试剂(美国应用生物系统公司),反应条件:95℃11s;55℃、34s;71℃、1min,45个循环。使用U6小核(snRNA)作为对照分析,以及量化循环法进行相对量化和计算。每个样本重复4次。
1.2.3血清炎性指标水平收集研究对象血清标本,酶联免疫吸附法检测血清中白介素-6(IL-6)、C反应蛋白(CRP)、肿瘤坏死因子(TNF-α)、白介素-1β(IL-1β)指标,江苏美正生物科技有限公司生产试剂盒,酶标仪 550nm处测定吸光度计算浓度。
1.2.4细胞ASC、Caspase-1、Beclin-1表达水平分别提取异位组织细胞内总蛋白,Western blotting法检测蛋白浓度,行电泳后转至 PVDF 膜,然后取出 PVDF 膜,完成后再次加入4.5%脱脂牛奶封闭后,添加ASC、Caspase-1、Beclin-1和相应一抗(1:1000) 5 ℃过夜,再用 HRP 标记的山羊抗兔 IgG(1:5000)室温孵2h,清洗 PVDF 膜后加入显色液,曝光显影,软件计算灰度值为蛋白表达量。
1.3 观察指标
不同组织中miR20a,血清IL-6、CRP、TNF-α、IL-1β炎症因子表达差异,EMs异位组中EMs组、诱导组、转染组组织细胞中ASC、Caspase-1、Beclin-1蛋白相对表达量。
1.4 统计学处理
2 结果
2.1 内膜组织中miR20a表达
PCR 法检测显示,EMs异位组miR20a的表达水平(2.46±0.32)高于对照组(1.08±0.22)(t=14.345,P=0.003)。
2.2 血清炎症因子水平
血清IL-6、CRP、TNF-α、IL-1β水平EMs异位组均高于对照组,且在EMs组、诱导组、转染组中依次升高(P<0.05)。见表1。
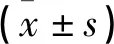
表1 各组血清中炎症因子水平比较
2.3 异位组织细胞中炎症小体和自噬蛋白的相对表达水平
Western blotting法检测结果显示,EMs组、诱导组、转染组细胞中ASC、Caspase-1、LC3、Beclin-1蛋白相对表达量均依次增加(P<0.05)。表2。

表2 各组组织细胞炎症小体和自噬蛋白相对表达水平比较(灰度值,
3 讨论
多项研究显示[7],miRNA可与靶基因mRNA进行碱基配对来阻碍翻译过程,具有一定的时序性和功能特异性,在很多炎症疾病、肿瘤疾病中发挥着至关重要作用[8]。miRNA是一个可以调控基因表达作用的重要因子。miR20a是miRNA家族成员,可抑制或降解相应靶细胞参与细胞的增殖和分化,还可以调控炎症因子等生理过程。胡鸿泽等[9]研究表明,miRNA可能参与了子宫内膜症的发生进展过程。多项研究表明[10],miRNA对炎症小体起着负调控作用,其转录后活性丧失导致无法执行其翻译功能,从而导致大量炎症小体产生。EMs患者炎症小体异常增多,导致病情更加严重[11]。炎症小体可导致炎性因子白介素1-β的释放,使人体天然免疫系统的一个关键组成部分。在分子生物学水平层面上,炎症小体不仅可参与人体免疫调节,而且参与细胞自噬过程[12]。范为民[13]研究表明,自噬和炎症小体在功能上联系非常密切,与机体内的新陈代谢和稳定性维持直接联系,严格调节炎症因子和病原体的清除。自噬常常会识别并吞灭炎症小体的各个组成部分,从而抑制其激活。miR20a、炎症小体、自噬3者间相互具有调控作用,miR20a对EMs治疗起着重要作用。miR20a-自噬-炎症小体通路广泛参与各种生理和病理过程,是目前生物医学领域研究热点。
本研究发现,EMs异位组织中miR20a表达水平高于正常内膜组织,表明miR20a表达在EMs异位细胞中异常增高,可能是导致EMs病情的原因之一。分析认为:miR20a异常表达激活炎症小体通路蛋白,使机体内环境失调继而病情恶化。炎性指标IL-6可促进子宫内膜细胞发育成熟、异常增长,导致EMs患者产生炎症,子宫内膜相应遭到损伤;TNF-α在组织中过量表达会损害子宫内膜,促进子宫内膜炎症发展;IL-1β可以促进子宫内膜细胞增殖分化,与核因子受体激活剂起着协同作用,诱导更多的核基因表达导致病情加重。本文EMs异位组血清IL-6、CRP、TNF-α、IL-1β水平均高于对照组,提示EMs异位者炎症因子水平异常升高可能参与了EMs的发生;对EMs异位组不同诱导情况发现,EMs组、诱导组、转染组IL-6、CRP、TNF-α、IL-1β依次升高,表明miR20a参与了EMs病情发展,可促进炎症因子增加,在炎症反应中发挥作用。EMs组、诱导组、转染组异位组织细胞中ASC、Caspase-1、LC3、Beclin-1蛋白相对表达量依次增加,表明过表达miR20a促进了自噬蛋白和炎症小体的表达量增加,提示miR20a可能是通过调控细胞自噬-炎症小体通路体现其抗炎作用。
综上所述,miR20a的表达可促进自噬-炎症小体信号通路的激活,促进EMs患者炎症因子增加,减轻子宫内膜细胞损伤,增强EMs细胞活性,从而发挥对子宫内膜细胞的修护作用。提示miR20a可作为EMs诊断及预后的生物学标志物,miR20a-自噬-炎症小体通路也为治疗EMs提供新思路。

