原发性干燥综合征继发免疫性血小板减少的临床特征
周美菊 袁放
干燥综合征(Sjogren's syndrome,SS)是一种以泪腺、唾液腺等外分泌腺分泌减少为特点的慢性自身免疫性疾病,以口干、眼干为主要表现,并可累及血液、肺、肾、肝等重要系统[1]。临床上SS分为原发性干燥综合征(primary Sjogren's syndrome,pSS)和继发性干燥综合征(secondary Sjogren's syndrome,sSS)。流行病学调查显示,全球SS患病率为0.05%~1%,是最常见的结缔组织病[2]。
免疫性血小板减少(immune thrombocytopenia,ITP)也是一种自身免疫性疾病,其特征是自身免疫介导的血小板破坏和血小板生成障碍,致使外周血中血小板计数<100×109/L,根据其病因及发病机制,可分为原发性ITP和继发性ITP[3]。原发性ITP是一种获得性自身免疫性、出血性疾病,以无明确病因的孤立性外周血小板减少为主要特点;继发性ITP通常与其他自身免疫性疾病,特别是系统性红斑狼疮相关[4]。但是继发性ITP在其他自身免疫性疾病,如pSS中的发病率及临床特征、预后等研究甚少,目前对pSS继发ITP的临床特征仍然了解有限。因此,笔者通过对125例pSS患者进行回顾性分析,以明确pSS患者继发ITP的临床特征,旨在提高临床上对此类患者的认识及诊治水平。
1 对象和方法
1.1 对象 选取2018年8月至2020年10月浙江医院风湿免疫科收治住院的pSS患者125例,其中男11例,女 114 例,年龄 17~88(52.9±13.8)岁,病程 0.1~30 年,中位病程2(0.7,5)年。根据病程中是否发生ITP,分为继发ITP组27例与未继发ITP组98例。继发ITP组中出现血小板减少相关性紫癜1例,无内脏出血病例;其中完成骨髓穿刺检查20例,经血液科医师会诊7例。未继发ITP组中出现血小板减少4例,其中可能与药物使用有关2例,血小板减少原因不明2例,均未能诊断ITP。纳入标准:所有患者均符合2002年美国风湿病学会的分类标准[5]。排除标准:合并其他自身免疫性疾病、肿瘤、感染、肝病、sSS的患者。ITP的诊断主要为排他性诊断,符合2011年美国血液病学会指南[6],具体诊断标准如下:(1)2次以上血常规提示血小板计数<100×109/L,且外周血涂片镜检血细胞形态无异常;(2)皮肤淤点、淤斑,伴或不伴有黏膜出血甚至脏器出血等临床表现;(3)脾脏不肿大;(4)排除其他原因继发的血小板减少。当未发现引起血小板减少的其他可能病因时,推定诊断为原发性ITP;对存在相关基础疾病的血小板减少患者,推定诊断为继发性ITP。本研究经本院医学伦理委员会批准(编号:2020101K),所有患者均签署知情同意书。
1.2 方法 采用欧洲风湿病防治联合会(Europe League Against Rheumatic,EULAR)干燥综合征疾病活动指数(EULAR Sjogren's syndrome disease activity index,ESSDAI)评估患者疾病活动度[7];采用 EULAR 干燥综合征患者报告指数(EULAR Sjogren's syndrome patient-reported index,ESSPRI)评估患者主观报告的症状[8];采用健康评估问卷指数(health assessment questionnaire,HAQ)评估患者日常生活能力[9];采用疲劳视觉模拟评分(fatigue visual analogue score,fVAS)评估患者疲劳症状,>1分者定义为有疲劳症状,≤1分者定义为无疲劳症状[10]。
淋巴结肿大定义为:超声或高分辨CT检查显示淋巴结长度>1 cm,或长短径之比缩小[11]。Schirmer试验由眼科医生实施,记录双眼中的最低值。
临床资料包括入院时的临床表现、实验室检查、影像学资料以及疾病评分等。有多次检验、检查的指标,选取入院后第一次检测结果。所有检验、检查结果均在入院72 h内完成评估。
1.3 统计学处理 采用SPSS 23.0统计软件。采用Kolmogorov-Smirnov方法对计量资料进行正态分布检验,正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料组间比较采用χ2检验。Pearson、Spearman和Kendall相关分析分别用于正态分布、非正态分布的计量资料以及计数资料的相关性分析。采用二元logistic回归分析pSS患者发生ITP的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床特征比较 与未继发ITP患者比较,继发ITP患者年龄更大,出现淋巴结肿大、疲劳者占比大,ESSDAI评分高,且Schirmer试验值更低,较少出现关节炎(均P<0.05)。两组患者病程及女性、眼干、口干、猖獗龋齿、腮腺炎、间质性肺炎、肾小管酸中毒、蛋白尿、神经系统损害者占比的比较差异均无统计学意义(均 P>0.05),见表1。
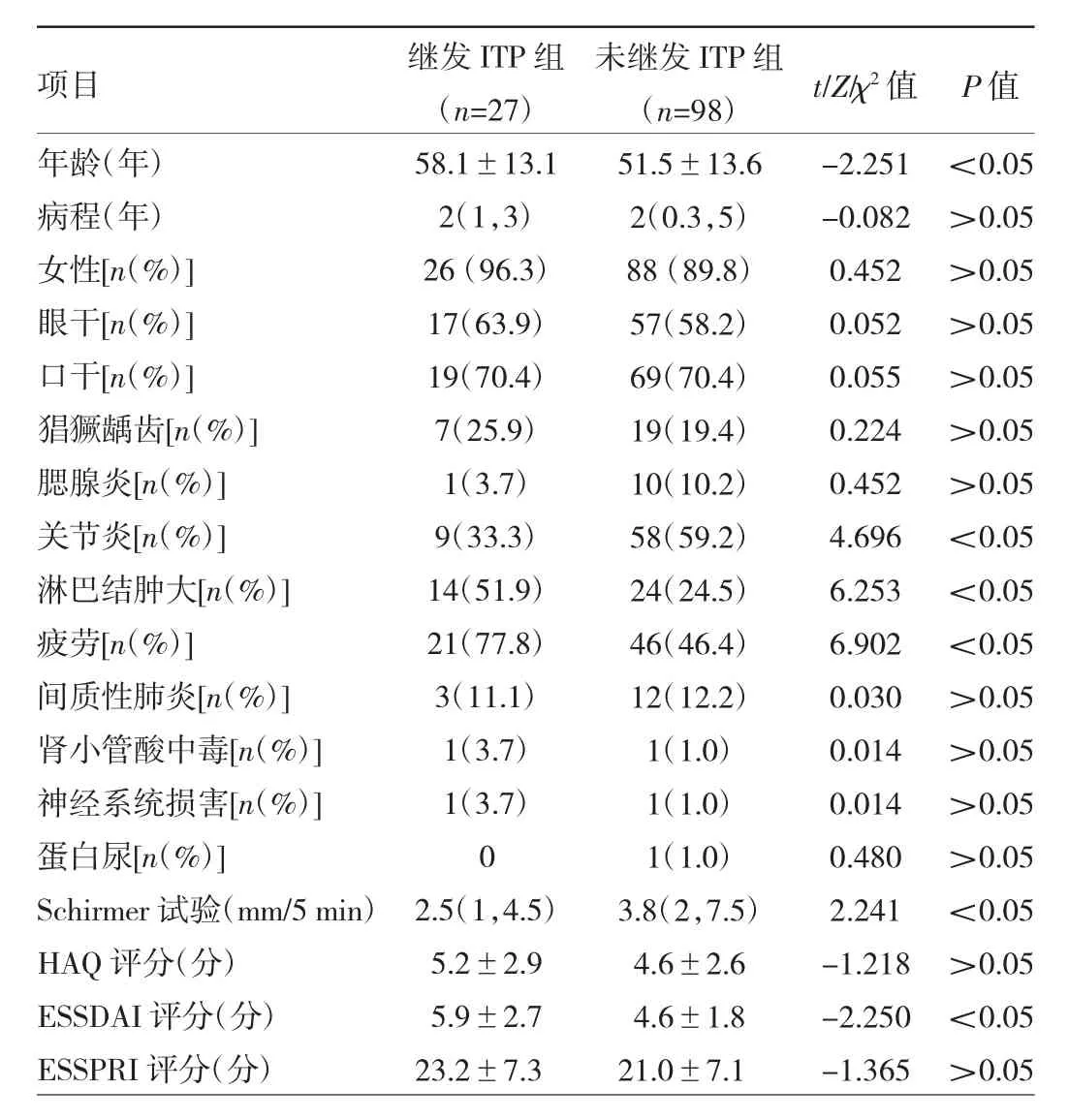
表1 两组患者临床特征比较
2.2 两组患者血清学指标的比较 与未继发ITP组患者比较,继发ITP组患者白细胞、血红蛋白、补体3水平更低,白细胞减少者占比、免疫球蛋白G水平更高(均P<0.05),而血沉、C-反应蛋白、免疫球蛋白 A、免疫球蛋白M、抗SSA抗体、抗RO52抗体、抗SSB抗体、类风湿因子等指标比较差异均无统计学意义(均P>0.05),见表2。

表2 两组患者血清学指标的比较
2.3 pSS患者临床表现及血清学指标与ITP的相关性分析 结果显示,白细胞下降(r=0.254)、免疫球蛋白G升高(r=0.207)、疲劳(r=0.255)、淋巴结肿大(r=0.245)与发生ITP均呈正相关(均P<0.05),而关节炎与发生ITP 呈负相关(r=-0.213,P<0.05)。年龄、性别、间质性肺炎、口干、眼干、免疫球蛋白A、免疫球蛋白M、血沉、C-反应蛋白、抗SSA抗体、抗RO52抗体、抗SSB抗体、类风湿因子等与ITP均无相关性(均P>0.05)。
2.4 pSS患者继发ITP的危险因素 结果发现,淋巴结肿大是pSS患者继发ITP的危险因素,而有关节炎的pSS患者发生ITP是无关节炎患者的0.265倍,见表3。
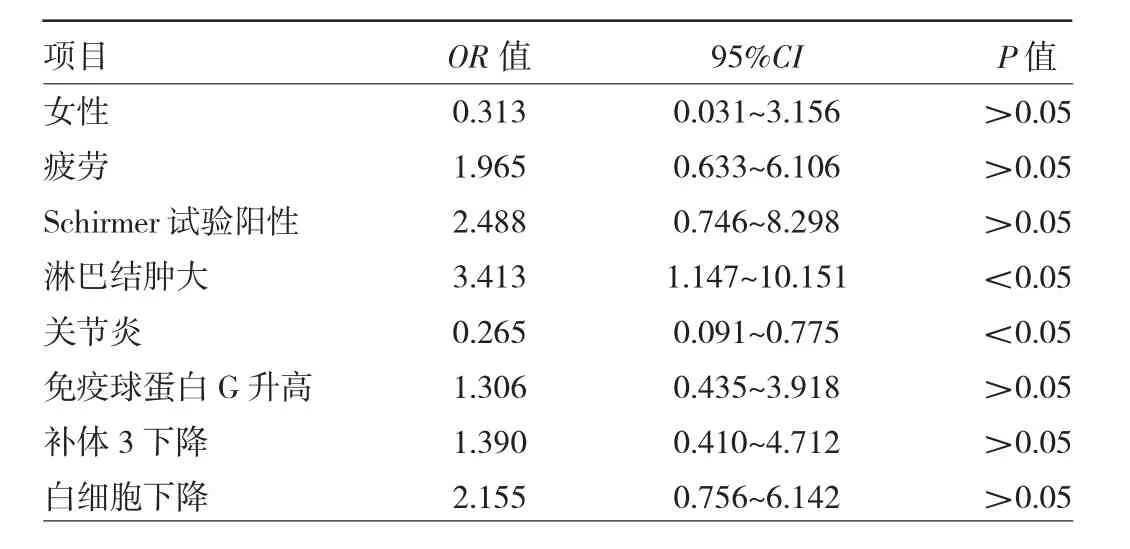
表3 pSS患者继发ITP相关因素的二元logistic回归
2.5 两组患者药物治疗情况的比较 继发ITP组中,使用糖皮质激素治疗者占48.1%,未继发ITP组中占8.2%,两组比较差异有统计学意义(P<0.01)。使用环磷酰胺、羟氯喹、环孢素、甲氨蝶呤、雷公藤多苷、他克莫司、艾拉莫德、白芍总苷、人免疫球蛋白等其他药物治疗者占比的差异均无统计学意义(均P>0.05),见表4。
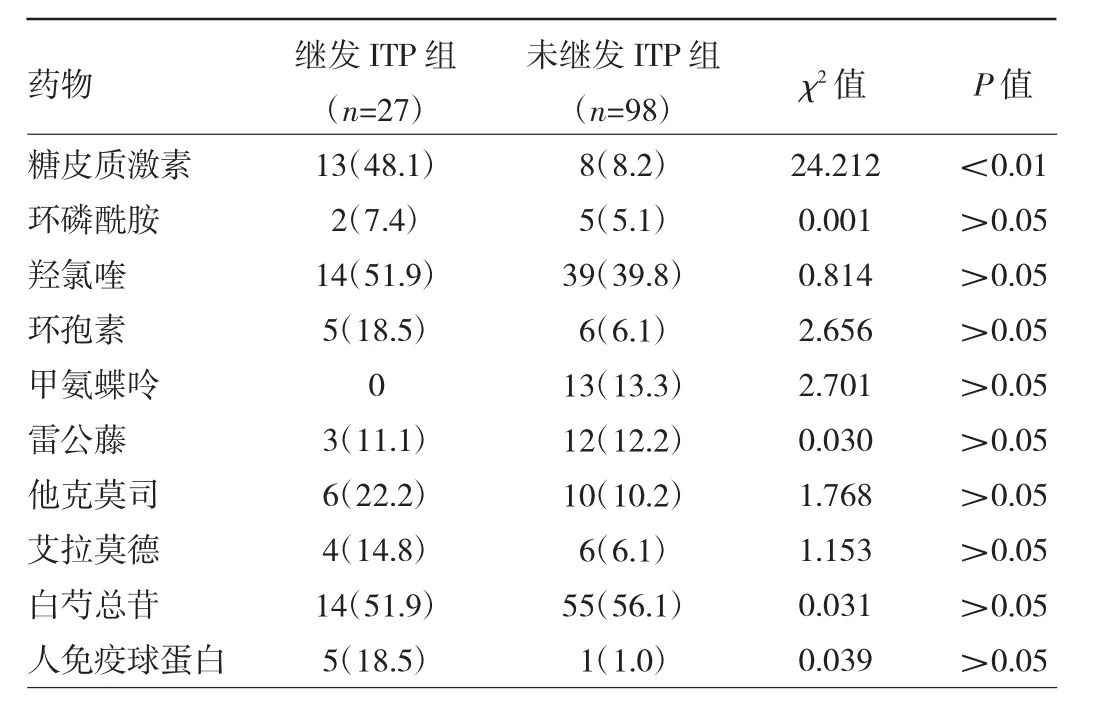
表4 两组患者药物治疗情况的比较[例(%)]
3 讨论
据既往报道,血小板减少存在于5%~15%的pSS患者中[12],但大多数比较轻微,临床上不常引起重视,大多被认为是无意义的轻微实验室检验异常[13],且在pSS患者中,血小板减少可与全血细胞减少同时存在,也可孤立存在,但危及生命的严重血小板减少却不常见[14]。
pSS继发血小板减少相关的研究在国内外并不少,但大多数研究者并未将血小板减少按照病因区分开来进行研究。而pSS患者继发血小板减少原因众多,可能为继发性ITP、血栓性血小板减少、抗磷脂综合征、药物不良反应、血液疾病、自身免疫性溶血、原因不明的血小板减少等[12,15]。pSS继发ITP的研究目前较少,临床上对pSS继发ITP认识有限。因此,笔者将pSS患者继发血小板减少按照病因,将继发ITP的pSS患者单独列出进行统计分析、研究,探讨pSS患者继发ITP的总体发生率、临床表现及免疫学特征。
本研究 125例 pSS患者中,ITP的发生率为21.6%,而未发现血栓性血小板减少、自身免疫性溶血、血液肿瘤、抗磷脂综合征等并发疾病,这表明,ITP在pSS患者中并非少见。Dai等[12]分析了291例pSS患者,发现12.03%患者发生ITP,而本研究中pSS患者的ITP发生率较之偏高,可能是因为:(1)本文中有部分血小板减少的患者未行骨髓穿刺检查,而是经血液科医师会诊初步诊断为ITP;(2)存在地域因素;(3)本文的数据来源于住院的pSS患者,相对病情较重,腺体外并发症多。
本研究发现,pSS患者诊断ITP时相对年龄较大,这与总体人群中ITP发生时年龄较高有一致性[6]。而Dai等[12]研究则发现,与未继发ITP的pSS患者相比,继发ITP组的平均年龄较小(P<0.05)。这说明,年龄在pSS患者中发生ITP的过程中起一定影响。
此外,本研究发现继发ITP组患者更多地出现淋巴结肿大、疲劳、免疫球蛋白G水平升高、补体3水平下降等表现,且疾病活动度较高,眼干更明显。干眼症、血小板减少、淋巴结肿大、疲劳、免疫球蛋白G水平升高作为pSS患者疾病活动度ESSDAI评分中的客观及主观项目,ITP组的患者疾病活动度更高是可预测的。但在pSS患者中,继发ITP组的关节炎发生率较低,关节炎与ITP的发生呈负相关,且二元logistic回归分析提示,伴有关节炎的pSS患者发生ITP的风险是无关节炎pSS患者发生ITP的0.265倍,这与Dai等[12]研究有相似之处。或许炎症性关节炎在血小板减少的发病机制中发挥正向作用,但此项特点仍需进一步大样本研究得以证实。
本研究发现,继发ITP患者血红蛋白水平较低、更容易出现白细胞减少,这与Puloria等[16]提出的观点有相似之处:pSS患者发生ITP,通常可伴贫血、白细胞减少,孤立性ITP在pSS中并不常见。或许,与未继发ITP患者相比,继发ITP患者并不仅仅只影响外周血小板计数,他们的造血系统是否也有区别,这需要进一步探索。
继发ITP组患者使用糖皮质激素占比高。对于pSS继发ITP的患者,糖皮质激素治疗是基础[17],对于糖皮质激素难治性严重血小板减少者或合并全血细胞减少者,可选择使用人免疫球蛋白临时诱导性缓解[18],但由于本研究125例pSS患者中使用人免疫球蛋白的例数较少,尚未对此进行深入的统计分析。此外,还可选择小剂量利妥昔单抗治疗,用药1~2周后,血小板开始逐渐上升[19-20]。
自身免疫性疾病可继发ITP,但引起血小板减少的机制尚不明确。Puloria等[16]认为,pSS继发ITP或许与自身体液免疫机制有关,因为自身产生的抗血小板抗体、抗血小板膜糖蛋白抗体等能与细胞膜结合,导致血小板破坏。在1950年,血液学研究员William Harrington给自己注射了ITP患者的血浆,致使他的血小板急剧下降,这也支持了自身抗体在病理生理学中的作用[21]。
而Hu等[22]发现,pSS继发ITP患者血清中的P-选择素抗体较高,可能在发病机制中起一定作用。另外,Chen等[23]指出,严重血小板减少的pSS患者B细胞的FcγRⅡb表达明显下降,而经大剂量激素治疗后,记忆B细胞的FcγRⅡb表达上调,血小板计数增加。这提示,或许体液免疫在pSS患者继发ITP的发病机制中起重要作用,但具体仍需深入研究。
综上所述,pSS患者典型的症状为口干、眼干,但腺体外系统损害在该疾病的过程中也不少见。pSS患者继发ITP在临床上并非罕见,但相关研究并不多。本文初步描述了pSS患者继发ITP的临床特征,可能为进一步的临床工作及实验开辟了道路。

