干扰素-γ消除肿瘤相关成纤维细胞介导非小细胞肺癌细胞辐射抵抗的实验研究
韩若臻 项林敏 邱恩毅 董事 翁欣然 胡呈呈 陈恩乐
肺癌位居恶性肿瘤相关死亡率第一位,其中非小细胞肺癌占肺癌总数约80%[1-2]。放疗已成为治疗肺癌的重要手段之一,但部分患者对放疗抵抗,甚至出现放疗后肿瘤进展[3]。肿瘤基质对肿瘤细胞发生、发展和治疗抵抗起到支持作用,而肿瘤基质中肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)为肿瘤组织中主要成分之一 ,后者对肿瘤细胞起到保护作用,诱导肿瘤细胞产生对治疗抵抗,同时促进肿瘤发生转移[4-5]。此外,电离辐射可诱导CD8+T细胞浸润于肿瘤组织中,而肿瘤微环境中CD8+T细胞丰度与肿瘤患者预后呈正相关[6]。CD8+T细胞能在杀伤肿瘤细胞的同时释放干扰素-γ,干扰素-γ通过作用于CAFs来减少谷胱甘肽(glutathione,GSH)和半胱氨酸释放,进而消除其介导的化疗耐药作用[7]。但干扰素-γ能否通过这一途径来消除CAFs对辐射后肿瘤细胞的保护作用,对此,本研究观察了干扰素-γ消除CAFs介导的非小细胞肺癌细胞辐射抵抗的效果,现报道如下。
1 材料和方法
1.1 材料 人肺腺癌细胞系A549、人肺鳞癌细胞系H460购自中科院上海细胞库。DMEM全培养基、10%FBS、青霉素、链霉素购自美国Thermo Fisher公司。细胞蛋白抽提试剂盒和聚丙烯酰胺凝胶电泳(SDSPAGE)快速制备试剂盒、人FAP-PE流式抗体购自美国Bio-Rad公司。CCK-8试剂盒、半胱氨酸标准品、胱氨酸标准品、GSH检测试剂盒、GSH合成酶抑制剂(丁硫氨酸-亚砜亚胺,BSO)购自上海碧云天生物技术有限公司。Transwell小室购自美国Corning公司。流式抗体 CD105-APC、CD44-APC、EPCAM-FITC、Annexin-V-FITC、PI、CD45-APC 购自美国 eBioscience公司。DNA损伤修复蛋白γH2AX、胱氨酸转运蛋白xCT抗体、信号传导及转录激活蛋白1(STAT1)抗体、辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自英国Abcam公司。7-氟苯呋咱-4-硫酸铵盐(SBD-F)购自美国Sigma公司;高效液相色谱检测涉及的三氯乙酸、EDTA-2Na、磷酸盐、醋酸钠、冰醋酸、氯化钠、氢氧化钠和四硼酸钠十水合物试剂均购自上海阿拉丁生化科技股份有限公司。高效液相色谱仪(AA9800)购自美国兰博公司。
1.2 方法
1.2.1 CAFs提取及鉴定 CAFs从2020年12月至2021年6月温州市中心医院胸外科行根治性切除的15例肺癌患者的组织标本中提取,其中肺腺癌11例,肺鳞癌4例;患者术前均无放化疗治疗史。具体方法:术中冷冻切片证实为非小细胞肺癌后,切取1 cm×0.5 cm肿瘤组织置于DMEM全培养基中,1 h内转移至实验室超净台,用PBS液冲洗标本5遍,将标本剪成约0.3 cm×0.3 cm大小的组织块,置于T25培养瓶中,加入2 ml DMEM全培养基,置于培养箱中,6~12 h后再加入2 ml培养基。培养过程中,可见CAFs贴壁于标本周围,7~10 d内长满。将第3~6代CAFs用于后续实验。取0.5×106个细胞接种于无菌载玻片中,细胞完全贴壁后去除培养基,PBS洗2次,加入4%多聚甲醛,24 h后提取载玻片进行HE染色及免疫组化染色,平滑肌肌动蛋白(smooth muscle actin,SMA)为CAFs特异性蛋白之一,若细胞质染色呈褐色表示阳性;将消化后的CAFs采用流式细胞术检测,进行流式抗体(CD105、CD44、FAP、CD45、EPCAM、CD24)染色及鉴定,以确定是否为CAFs细胞。
1.2.2 细胞培养 A549、H460、CAFs细胞培养于DMEM全培养基中,该培养基含10%FBS、100 U/ml青霉素和100 μg/ml链霉素。细胞在37℃ 、5% CO2培养箱中培养,0.25%胰酶消化后按1∶3比例传代,传代间隔时间为2~3 d。
1.2.3 细胞辐射 分别将10×106个的A549和H460细胞置于含15 ml DMEM全培养基的15 ml离心管中。将离心管置于瓦里安(23EX)直线加速器中辐射,辐射剂量为10 Gy,共3 min。辐射结束后,离心管重新置于冰上并转运回实验室。
1.3 CAFs与辐射后肿瘤细胞共培养
1.3.1 Transwell法 在24孔Transwell体系中,辐射后的肿瘤细胞与 CAFs铺板数目比例为1∶2,0.2×106个肿瘤细胞铺板于下室(无CAFs组),0.4×106个CAFs细胞铺板于上室(CAFs组),共培养36 h。
1.3.2 CAFs细胞上清培养法 3×106个CAFs铺板于10 cm细胞培养皿中,48 h后收集上清液于15 ml离心管,2 500 r/min离心5 min,上清液经0.22 μm过滤器过滤。取0.2×106个辐射后肿瘤细胞铺板于24孔板,12 h后吸弃细胞培养基,加入CAFs细胞上清液500 μl,36 h消化细胞并通过流式细胞仪检测细胞凋亡;CAFs完全贴壁后,在细胞培养基中加入干扰素-γ(终浓度为5 ng/ml)或者BSO(终浓度为 0.1 mmol/L),作用8 h后,更换培养基并收集48 h后CAFs细胞上清液,用于后续共培养及上清液相关指标检测实验。
1.4 肿瘤细胞凋亡检测 分别收集Transwell体系中各辐射后A549和H460细胞于1.5 ml EP管中,离心后吸除上清液,250 μl Annexin-V buffer重悬肿瘤细胞。往细胞悬液中加入Annexin-V流式抗体和碘化丙啶(PI)各 0.25 μl,室温避光孵育 15 min;孵育结束后,2 500 r/min 离心 5 min,150 μl Annexin-V buffer重悬细胞,上机检测Annexin-V和PI。Annexin-V阳性代表细胞早期凋亡,Annexin-V和PI双阳代表细胞晚期凋亡,两种比例之和表示细胞凋亡占比。
1.5 肿瘤细胞活性检测 采用CCK-8法。0.2×106个辐射后肿瘤细胞铺板于96孔板中,各实验孔分别加入100 μl DMEM全培养基和CAFs细胞上清液培养基,36 h后吸除培养基,往各孔中加入100 μl CCK-8检测液,1 h后酶标仪测定450 nm处吸光度(A)值,以未辐射细胞作为对照组,检测细胞活力,细胞活力(%)=[A(实验)-A(空白)]/[A(对照)-A(空白)]×100,其中A(空白)为CCK-8溶液的吸光度,A(对照)为CCK-8溶液和无处理细胞的吸光度,A(实验)为CCK-8溶液和CAFs细胞上清液培养基处理细胞的吸光度。
1.6 辐射后的肿瘤细胞γH2AX、xCT、STAT1蛋白表达情况检测 采用Western blot法。获得细胞沉淀后,加入细胞裂解液,4℃、12 000 r/min,离心 5 min,收集蛋白。采用BCA蛋白定量法检测蛋白浓度并调节蛋白浓度为 1 μg/μl。取 20 μl蛋白液进行凝胶电泳(SDSPAGE)和转膜。将分离的蛋白转移至PVDF膜上,使用5%脱脂牛奶封闭,加入鼠抗人一抗,4℃过夜。加入HRP标记的羊抗鼠二抗,室温孵育2 h后。以GAPDH作为内参照,采用化学发光法将蛋白条带曝光到胶片上,测定 γH2AX、xCT、STAT1 蛋白表达情况。
1.7 CAFs细胞上清液中GSH、半胱氨酸、胱氨酸水平检测 采用高效液相色谱法将标准品溶液及CAFs细胞上清液经PBS稀释后,用三(2-羧乙基)膦盐酸盐还原,用三氯乙酸溶液进行蛋白沉淀,再用7-氟苯呋咱-4-硫酸铵盐进行衍生化反应。实验中色谱条件:柱温29℃,流动相为甲醇,流速为0.8 ml/min,激发波长385 nm,发射波长515 nm。以标准品的位置及面积作为参照,计算GSH、半胱氨酸、胱氨酸水平。
1.8 统计学处理 采用GraphPad Prism 6.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 CAFs的鉴定 流式细胞术检测可见,CAFs为一群呈现 CD24、CD45、EPCAM阴性表达的细胞,而CD105、CD44、FAP 阳性表达,见图1a、b(插页)。HE染色可见,CAFs呈纺锤形或星形的扁平细胞(图1c,插页)。免疫组化可见CAFs中SMA呈阳性表达(图1d,插页)。
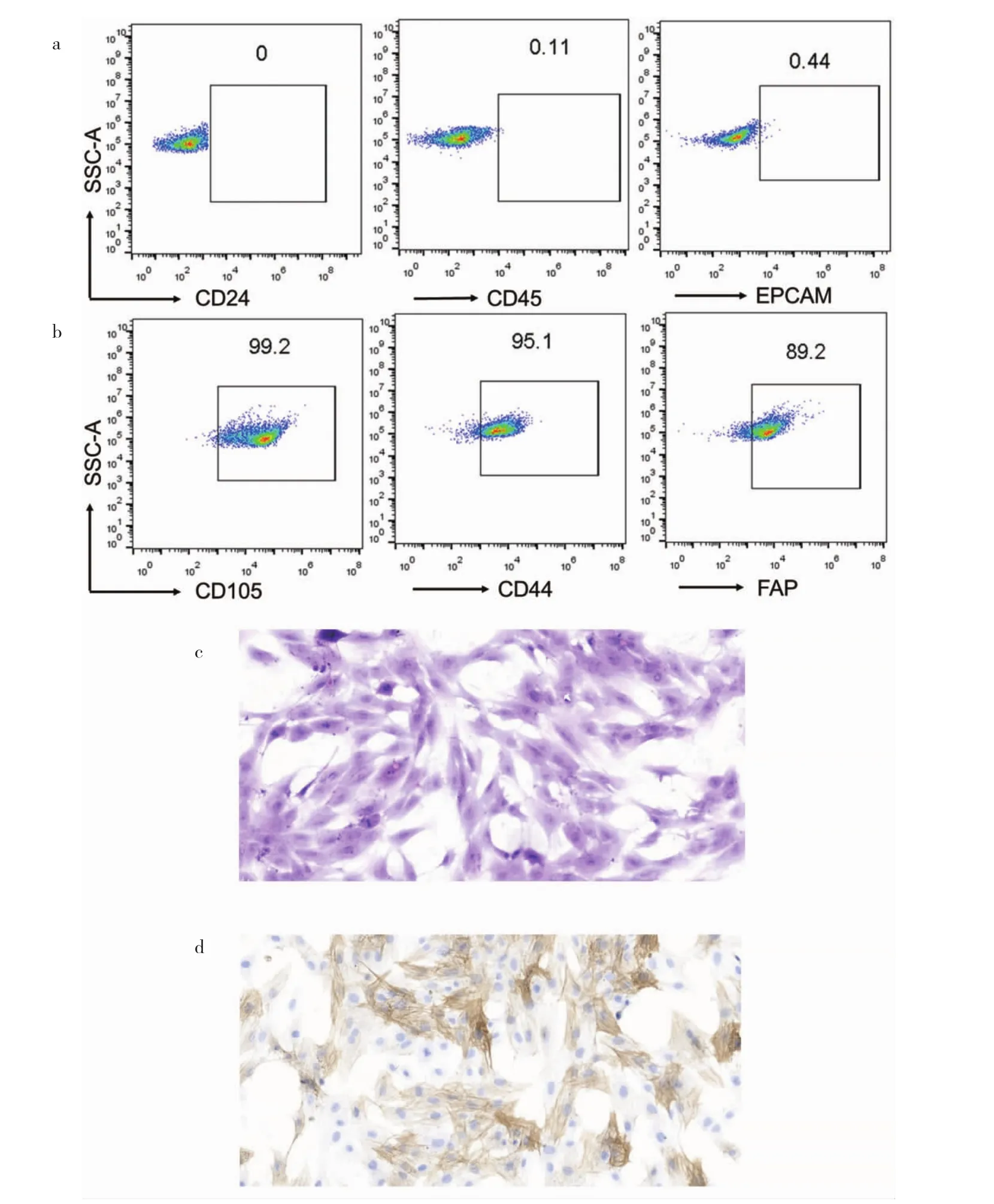
图1 CAFs细胞的鉴定(a:流式细胞术检测CAFs中CD24、CD45和EPCAM表达阴性;b:流式细胞术检测CAFs中CD105、CD44和FAP表达阳性;c:观察CAFs细胞形态,HE染色,×100;d:CAFs细胞SMA呈阳性表达,免疫组化染色,×100)
2.2 CAFs细胞上清液对辐射后肺癌细胞凋亡及细胞活性的影响 流式细胞术检测发现,A549细胞在CAFs组的细胞凋亡占比为(59.7±3.3)%,无 CAFs组为(38.3±3.6)%;H460细胞在 CAFs组的细胞凋亡占比为(58.2±5.5)%,无 CAFs组为(29.8±3.9)%。CCK-8检测发现,A549细胞活性CAFs细胞上清液培养基为(38.1±2.1)%,DMEM 全培养基为(59.1±2.4)%;H460细胞活性CAFs细胞上清液培养基为(37.8±2.3)%,DMEM全培养基为(58.6±4.6)%。见图2。

图2 CAFs细胞上清液对辐射后肺癌细胞凋亡及细胞活性的影响(a:流式细胞术检测Transwell体系中辐射后的A549细胞凋亡占比;b:CCK-8检测CAFs细胞上清液培养基和DMEM全培养基中辐射后的A549细胞活性,**P<0.01;c:流式细胞术检测Transwell体系中辐射后的H460细胞凋亡占比;d:CCK-8检测CAFs细胞上清液培养基和DMEM全培养基中辐射后的H460 细胞活性,**P<0.01)
2.3 干扰素-γ对CAFs细胞上清液GSH、半胱氨酸、胱氨酸水平及非小细胞肺癌细胞活性的影响 高效液相色谱检测发现,加入干扰素-γ的CAFs细胞上清液中 GSH水平为(41.3±10.2)μmol/L,加入BSO为(39.1±9.6)μmol/L,加入 DMEM 全培养基(对照组)为(78.2±10.6)μmol/L,干扰素-γ和 BSO均明显降低CAFs细胞上清液中的GSH水平(均P<0.05)。在干扰素-γ作用后,CAFs细胞上清液中半胱氨酸水平为(47.8±4.8)μmol/L,明显低于对照组的(86.9±8.7)μmol/L(P<0.01),而胱氨酸水平为(133.0±10.8)μmol/L,明显高于对照组的(73.7±5.2)μmol/L(P<0.01)。CCK-8检测表明,干扰素-γ和BSO两者均降低了辐射后肿瘤细胞活性,与对照组比较差异有统计学意义(P<0.01)。见图3。

图3 干扰素-γ对CAFs细胞上清液GSH水平及非小细胞肺癌细胞活性影响(a:干扰素-γ和BSO对CAFs上清液GSH水平的影响;b:BSO对辐射后A549和H460细胞活性的影响;c:干扰素-γ对辐射后A549和H460细胞活性的影响;d:干扰素-γ对CAFs细胞上清液中半胱氨酸水平的影响;e:干扰素-γ对CAFs细胞上清液中胱氨酸水平的影响)
2.4 干扰素-γ对 CAFs细胞内 γH2AX、xCT、STAT1蛋白表达的影响 Western blot检测结果表明,CAFs细胞上清液培养后使辐射后的A549细胞和H460细胞的γH2AX表达减少,而干扰素-γ作用后γH2AX表达增加。CAFs细胞内STAT1获得激活并使其成为p-STAT1,后者可进入细胞核来实现其生物学功能。干扰素-γ作用CAFs后,细胞内胱氨酸转运蛋白xCT表达减少,后者位于细胞膜上并发挥将细胞外胱氨酸转运入细胞内的作用。见图4。
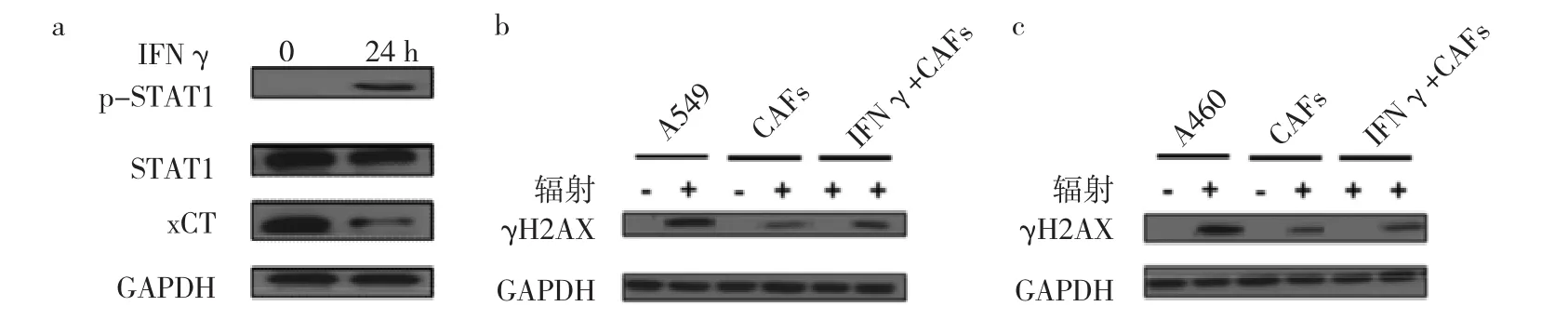
图4 干扰素-γ对CAFs细胞内γH2AX、xCT、STAT1蛋白表达影响的电泳图(a:干扰素-γ处理后CAFs细胞内xCT、STAT1、p-STAT1蛋白相对表达;b:干扰素-γ处理的CAFs细胞上清液对辐射后A549细胞内γH2AX蛋白表达影响;c:干扰素-γ处理的CAFs细胞上清液对辐射后H460细胞内γH2AX蛋白表达影响)
3 讨论
肺癌位居肿瘤相关死亡率第一位,5年生存率仅为15%[1-2]。非小细胞肺癌在肺癌中占比为85%,放疗已成为非小细胞肺癌治疗的重要手段之一,但是部分患者呈现对放疗的抵抗及放疗后肿瘤进展,导致患者预后不佳[3]。研究表明,作为肿瘤基质主要细胞CAFs对肿瘤发生、发展起到支持作用,诱导肿瘤细胞对放疗发生抵抗[5]。因此,本研究先成功分离和鉴定非小细胞肺癌组织中CAFs,再通过Transwell和CAFs细胞上清液培养两种方法实现CAFs与辐射后的肺腺癌细胞A549和肺鳞癌细胞H460共培养,继而确认CAFs诱导非小细胞肺癌对辐射抵抗。该两种非直接接触共培养方式的结果说明,CAFs通过释放某种物质来介导非小细胞肺癌细胞对辐射的抵抗,进而提高肿瘤细胞活性及减少细胞凋亡。
放疗通过射线作用在肿瘤组织中形成羟自由基和超氧阴离子等活性氧(reactive oxygen species,ROS),后者通过氧化蛋白质、脂质和DNA进而损伤细胞以达到治疗目的[8]。GSH是一种由谷氨酸、半胱氨酸及甘氨酸组成的γ-酰胺键和巯基的三肽,是抗氧化应激的主要还原剂[9]。研究表明,肿瘤细胞内GSH能抵消ROS的作用,从而维持肿瘤细胞的生存,增加对细胞损伤的耐受,继而诱导肿瘤细胞侵袭及转移[10]。基于此,笔者通过高效液相色谱检测CAFs细胞上清液GSH水平,结果表明CAFs细胞上清液的GSH水平显著性高于肿瘤细胞上清液,笔者推测CAFs通过释放GSH来实现对辐射后肺癌细胞的保护。为了进一步说明来自于CAFs的GSH实现该效应,笔者在CAFs的细胞体系中加入BSO,结果表明,BSO降低CAFs细胞上清液中GSH水平并使辐射后的肿瘤细胞活性低于对照组。同样,梁延杰等[11]利用肺癌小鼠模型开展相关研究,其通过降低肺癌细胞中的GSH水平来增加肿瘤细胞对辐射的敏感性,进而抑制肿瘤组织生长。
化疗、放疗和肿瘤靶向治疗的疗效与肿瘤微环境干扰素水平及CD8+T细胞数量呈正相关,后者杀伤肿瘤细胞时会释放干扰素-γ[12-13]。Wang等[7]研究表明,干扰素-γ通过作用于CAFs以减少其GSH的释放,进而提高卵巢癌细胞对顺铂的敏感性。顺铂通过损伤肿瘤细胞DNA来实现治疗,而射线辐射同样具有破坏肿瘤细胞DNA的作用。基于此,笔者推测干扰素-γ具有与放疗协同作用来控制肿瘤的生长。在用干扰素-γ对CAFs处理后,结果发现干扰素-γ同样能减少CAFs细胞上清液GSH水平,同时发现辐射后肺癌细胞活性低于干扰素-γ对照组。干扰素-γ属于Ⅱ类细胞因子受体家族的成员,其细胞膜受体为IFNGR,几乎在所有细胞类型中均以中等水平表达(成熟红细胞除外),与受体结合后通过JAK/STAT信号途径发挥生物学功能,在JAK的催化下,STAT发生磷酸化形成p-STAT,继而形成p-STAT二聚体,并转移至细胞核内发挥生物学功能[14],后者与xCT的特定启动子区域结合后,快速抑制成纤维细胞xCT基因转录[7]。本研究中Western blot检测同样证明,经干扰素-γ处理后的CAFs呈现xCT蛋白表达下降,后者是糖蛋白相关氨基酸转运蛋白家族的成员,表达于细胞膜上,为胱氨酸转运蛋白[15],xCT蛋白表达下降减少了胱氨酸用于合成半胱氨酸及GSH,进而消除了CAFs介导的肺癌细胞对辐射抵抗。在干扰素-γ处理组中辐射后肿瘤细胞内的γH2AX蛋白表达下调,该蛋白表达水平反映DNA损伤程度[16],进一步验证了干扰素-γ消除CAFs介导的非小细胞肺癌细胞对辐射抵抗。
综上所述,研究者用源于非小细胞肺癌临床标本的CAFs来开展研究,证明了该细胞通过释放GSH来诱导非小细胞肺癌对辐射的抵抗。同时,干扰素-γ下调CAFs的胱氨酸转运蛋白xCT表达并使GSH释放减少,进而逆转非小细胞肺癌对辐射的抵抗。电离辐射诱导CD8+T免疫细胞在肿瘤组织中丰度[6],干扰素-γ可来自于该细胞,研究能够为放疗结合免疫治疗用于非小细胞肺癌治疗提供依据。

