乳腺MRI背景实质强化与乳腺癌分子分型的相关性
茅依玲,汪登斌,王丽君,陈艳,何江波
乳腺癌是一种生物学特征高度异质性的恶性肿瘤,乳腺癌的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、 人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)及细胞增殖抗原标记物Ki-67(antigen identified by monoclonal antibody Ki-67,Ki-67)4种免疫组化指标是指导乳腺癌治疗及预测预后的重要因素。根据乳腺成像报告和数据系统(BI-RADS),乳腺磁共振成像(MRI)应常规报告背景实质强化(background parenchymal enhancement,BPE)。BPE是指给予对比剂后正常乳腺实质的增强。目前,国内外学者探究了BPE水平在乳腺癌风险预测、保乳术后切缘评估、新辅助治疗疗效以及高危人群疗效评估等方面的预测价值[3-7]。然而,利用BPE水平预测乳腺癌分子分型的研究尚少,且结论不一致。本研究旨在探讨乳腺磁共振BPE与乳腺癌分子分型的相关性,进而探究BPE对乳腺癌分子分型的预测价值。
材料与方法
1.临床资料
搜集所有2016年10月-2020年6月本院行乳腺手术或空心针穿刺病例,排除MRI图像质量差、无免疫组化指标、未知绝经状态及MRI检查前12个月内使用激素替代或抗激素治疗的病例。共搜集符合要求的浸润性导管癌80例。患者年龄范围27~85岁,平均年龄56.2±12.8岁。
2.MRI检查技术
采用德国Siemens Verio Dot3.0T MRI扫描仪,乳腺检查专用相控阵线圈采集数据。患者取俯卧位,将双乳自然悬垂于线圈内,对双侧乳腺进行MRI平扫及动态增强扫描。扫描序列与参数:扩散加权成像(DWI)采用单次激发 Resolve序列,重复时间(repetition time,TR)/回波时间(echo time,TE)为5100 ms/88 ms;翻转角180°。T2WI抑脂序列(T2WI-FS),TR/TE为3500 ms/54 ms。三维-扰相梯度回波(3D-FLASH)序列,TR/TE为4.47 ms/1.74 ms。动态增强扫描采用Madred公司生产的MRI自动高压注射器,对比剂为钆喷替酸葡甲胺注射液(Gd-DTPA),0.10 mmol/kg体重,流率3.0 mL/s,并用20 mL生理盐水冲管;分别于注药前、注药后55 s、110 s、165 s、220 s、275 s扫描,每期扫描时间55 s,K0时间为35 s。
3.图像分析
由2名接受过亚专科培训且超过7年乳腺诊断经验的放射科医师对图像进行分级,如果意见不一致时,通过协商确定。参照美国放射学会乳腺摄影报告和数据系统(breast imaging reporting and data system,BI-RADS)2013版标准[8],在增强后第2期减影图像据乳腺正常实质强化程度,将乳腺BPE分为a轻微;b轻度;c中度;d显著4类。当患侧乳房的BPE因肿块过大或弥漫强化等原因难以准确判断时,本研究采用对侧乳腺MRI BPE代替患病侧乳房BPE,这是鉴于两个乳房之间的对称性,健康的对侧乳房可以被认为与肿瘤发生前的同侧乳房相当[9]。
4.乳腺癌分子分型标准
所有病例均空心针穿刺或手术病理证实,并行免疫组化检查。阳性结果染色呈棕黄色或棕褐色颗粒,阴性细胞无着色,以阳性细胞比例的平均值定义该肿瘤的阳性细胞百分比。ER、PR和Ki-67阳性部位在细胞核,HER-2阳性部位在细胞膜。ER和PR表达判定标准[10]:当≥1%的肿瘤细胞核呈现不同程度的着色时,即为阳性;当<1%的肿瘤细胞核呈现不同程度的着色或完全无着色,即为阴性。Ki-67的评分体系根据2011年St.Gallen早期乳腺癌国际专家达成的共识[11],将14%作为Ki-67阳性指数高低的界限值。当Ki-67阳性细胞数<14%时为低表达,>14%为高表达[11,12]。HER-2表达判定标准[13]:(-):无染色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;(+):>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;():>10%的浸润癌细胞呈现不完整和(或)弱至中等强度的细胞膜染色或≤10%的浸润癌细胞呈现强而完整的细胞膜染色;():>10%的浸润癌细胞呈现强而完整的细胞膜染色。对于()的病例,行Fisher检测,有扩增者为阳性组,无扩增者为阴性组。将 (-)、(+)、()无扩增定义为阴性组,将()扩增、()定义为阳性组。
据患者免疫组化报告中ER、PR、HER2及Ki-67的表达情况,按照2013年 St.Gallen国际乳腺癌会议制定的共识[14],将乳腺癌分为4个亚型。Luminal A型:ER和(或)PR阳性,HER2阴性,Ki-67低表达;Luminal B型:ER和(或)PR阳性,HER2阴性,Ki-67高表达或ER和(或)PR阳性,HER2阳性;HER2过表达型:HER2阳性,ER、PR阴性;三阴型:HER2阴性,ER、PR阴性。
5.统计学分析
采用SPSS 20.0统计分析软件,BPE与乳腺癌患者年龄及绝经状态间的差异采用Spearman相关性检验。BPE在不同乳腺癌分子分型间的差异采用卡方检验,当1/5以上理论频数<5或有一个理论频数<1时,采用Fish结果,否则采用Pearson卡方值。P<0.05为差异有统计学意义。
结 果
1.临床特征及分子分型结果
本组病例共80例(表1),均为浸润性导管癌,年龄27~85岁,平均年龄56.2±12.8岁,<45岁15例,45~55岁27例,>55岁38例;其中绝经前38例,绝经后42例;分子分型结果为Luminal A 23例,占23/80,Luminal B 30例,占30/80,Her2过表达17例,占17/80,三阴性10例,占10/80;其中ER阳性53例,占53/80,PR阳性43例,占43/80,HER2阳性30例,占30/80;Ki67高表达48例,占48/80。

表1 年 龄、月经状态、分子分型及免疫组化指标
2.BPE与年龄及绝经状态的相关性分析
BPE与年龄呈负相关,R=-0.258,P=0.021。d型BPE以<55岁患者最多,占8/11,>55岁患者中a型BPE比例最多,占29/38;BPE与绝经状态呈负相关,R=-0.284,P=0.011,d型BPE患者中多数为未绝经的患者,占8/11,而a型BPE多为绝经患者,占13/16(表2)。

表2 BPE与年龄及月经状态相关性分析
3.BPE水平在不同乳腺癌分子分型间的差异性分析
23例Luminal A型患者a型BPE最多,占9/23;三阴性患者中c、d型BPE最多,占5/10;Her2过表达患者中以d型BPE最少,占1/17。但经卡方检验分析,BPE水平在不同分子分型之间差异无统计学意义,P=0.392。BPE水平与ER、PR、HER2、Ki-67与间差异无统计学意义,P值分别为0.259、0.067、0.138、0.869(表3)。
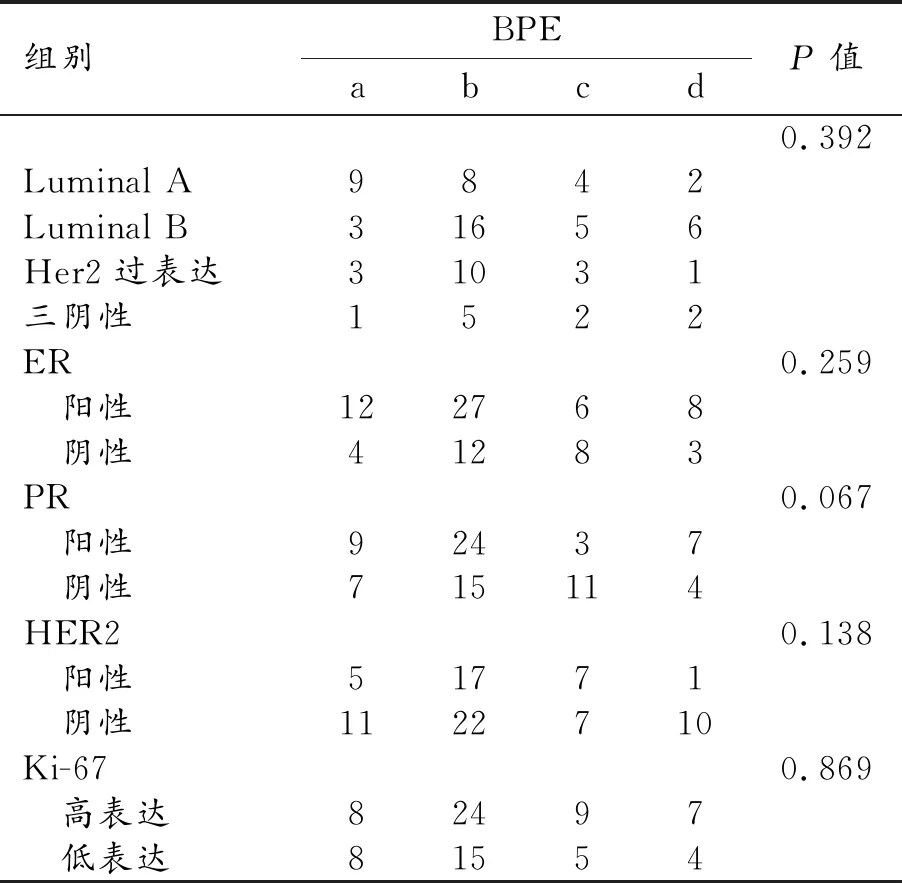
表3 BPE水平在不同乳腺癌分子分型间的差异性分析
讨 论
国际癌症研究机构(IARC)2020年全球最新癌症数据表明[15]2020年乳腺癌新发人数达226万,成为全球第一大癌症;而中国女性乳腺癌新发病例数约42万,位居中国女性癌症新发病例首位。由于乳腺癌具有高度异质性,相同组织病理学类型和分期的肿瘤可能具有不同的预后和治疗反应,而肿瘤的分子分型是影响患者预后及治疗反应的重要因素。MRI因无创、无辐射和优良的软组织空间分辨力等优势,成为乳腺癌术前诊断、分期、术后随访及治疗反应评估的首选影像学手段。学者[16]认为MRI影像组学特征与分子标记物的表达具有相关性。乳腺成像报告和数据系统(BI-RADS)指出乳腺磁共振成像(MRI)应常规报告BPE,BPE也被认为是乳腺癌的一个危险因素[14],但BPE是否能预测乳腺癌分子分型结论不一。
笔者通过对80例浸润性乳腺癌患者的研究观察到Luminal A型患者中a型BPE最多;三阴性患者中BPE呈c、d型者最多;Her2过表达患者中以d型BPE最少。尤超等[17]通过定量分析4种分子分型乳腺癌的BPE从低到高排序:TNBC,HER2阳性亚型,Luminal B型,Luminal A型;有学者提出[18]在Luminal B肿瘤中轻度强化BPE比其他BPE 类型更普遍,在三阴性乳腺癌中显著强化的BPE比其他类型BPE更常见,而在其他乳腺癌亚型的BPE分布中并不存在如此显著差异。有学者[19]通过90例患者研究表明当BPE为b型时,乳腺癌分子分型为 HR+的概率增加。这与笔者的研究结果均存在差异,笔者认为存在差异的原因,一方面,本研究采用定性方法测定BPE,不可避免存在一定主观影响,但既往国外开展的BPE定性研究发现不同阅片者通过专业的MRI阅片培训,对BPE定性判读的一致性可达到基本一致(Kappa>0.61)[2];另外不同研究者间样本数量不同、分子亚型分配不均也是导致结果存在差异的原因。
本研究笔者通过统计学分析得出BPE在不同分子分型(Luminal A、Luminal B、Her2过表达、三阴性)差异无统计学意义,暂不能认为BPE具有预测乳腺癌分子分型的价值。我们的结论与李俊[20]结论相仿,BPE与ER、PR、HER2表达均无明显相关性。但也有文献认为BPE可作为一种预后标志物,与分子亚型之间可能存在相关性,特别是在区分Luminal A型和Luminal B型方面,并且与无复发生存期可能存在关系[8,21,22]。因此,BPE与乳腺癌分子分型的相关性仍有待进一步研究。
本研究结果显示BPE与年龄负相关,与患者绝经与否差异有统计学意义。绝经前和<55岁患者,BPE均显著高于绝经后和>55岁患者,二者差异有统计学意义。绝经前女性体内雌激素和孕激素随月经周期规律变化。BPE是给予对比剂后正常乳腺实质的增强,由于乳腺纤维腺体组织对激素非常敏感,因此,BPE与妇女的激素活性状态有关,孕酮有丝分裂活性诱导纤维腺体组织增殖,并可增强雌激素作用;雌激素可引起血管舒张,并可通过其类似组胺的作用增加血管通透性,加速上皮细胞增殖,这两种激素作用的结合导致BPE的升高[8]。绝经前女性体内雌孕激素水平高于绝经后,故绝经前女性的BPE相对更显著。随着年龄增长,体内雌、孕激素水平逐渐降低,尤其绝经后,上皮细胞增殖过程静止,乳腺腺叶组织退化,BPE逐渐降低。
本研究仍存在一定不足。一方面,本研究样本量较少,仍需进一步扩大样本量;另一方面,BPE受月经状态影响,但本组部分未绝经患者未在月经周期第2周进行检查。
综上所述,BPE与年龄呈负相关,随着年龄增长BPE呈逐渐降低趋势;绝经患者BPE普遍低于未绝经患者。BPE与乳腺癌分子分型(Luminal A、Luminal B、Her2过表达、三阴性及ER、PR、HER2、Ki-67)差异无统计学意义,暂不能认为BPE具有预测乳腺癌分子分型的价值。未来,可通过增加样本量,BPE定量研究进一步探讨BPE与乳腺癌分子分型的相关性。

