规范化营养干预下食管癌患者放化疗营养状况分析*
余嘉文,程 进,姚文娟,胡智刚,张洪波,钱立庭△
(1.安徽医科大学附属安庆第一人民医院/安徽省安庆市第一人民医院肿瘤科 246052;2.中国科学技术大学附属第一医院放疗科,合肥 230001)
食管癌是我国高发恶性肿瘤,2019年中国国家癌症中心统计数据,食管癌发病率和病死率在男性均为第5位,在女性中分别为第9位和第6位[1]。食管癌营养不良发病率居所有肿瘤第1位[2]。2020年《食管癌患者营养治疗指南》,推荐对于放化疗前评估为患者主观整体营养评估量表(patientgenerated subjective global assessment,PG-SGA)≥9分的重度营养不良的患者先行营养干预1~2周,待营养状况好转后,再行抗肿瘤治疗[3]。然而,临床实际中,1~2周的营养干预,营养状况可能达不到预期的改善,继续营养干预又可能会延迟甚至错失抗肿瘤治疗时机。本研究以中、重度营养不良食管癌患者为研究对象,探讨不同临床病理特征的食管癌患者,在规范化营养干预下接受放化疗期间及之后的营养状况保持情况、放化疗近期疗效及相关不良反应;为合并营养不良的食管癌患者制订个体化营养方案和掌控合适的治疗时机等方面提供临床参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年11月至2021年2月,安徽医科大学附属安庆第一人民医院收治的食管癌患者48例,其中男30例,女18例;年龄43~96岁,中位年龄75岁;东部癌症协作组(eastern cooperative oncology group,ECOG)体力状态评分1分33例,2分15例;美国癌症联合会(american joint committee on cancer,AJCC)2002第六版肿瘤临床TMN分期为Ⅱ~Ⅲ期39例,Ⅳ期9例;同步放化疗或序贯放化疗27例,单纯放疗21例。全组患者PG-SGA评分4~15分,中位评分为9分。根据《中国肿瘤营养治疗指南》(2015版)营养不良严重程度诊断标准,PG-SGA评分为4~<9分(中度营养不良)的患者23例,9分及以上(重度营养不良)的患者25例。入组标准:(1)经胃镜病理证实的食管癌患者;(2)具有根治性放射治疗指征,但存在手术禁忌证或拒绝手术;(3)严重进食梗阻需姑息放疗的患者;(4)年龄大于18岁;(5)有明确的影像学或内镜评价指标;(6)无严重贫血、重要脏器功能损伤、严重消化道出血、潜在消化道穿孔;(7)营养风险筛查2002(nutrition risk screening 2002,NRS2002)评分大于或等于3分,PG-SGA评分大于或等于4分,ECOG体力状况评分小于或等于2分;(8)预计生存期大于3个月;(9)患者知情同意。
1.2 方法
1.2.1营养干预措施
遵循《中国肿瘤营养治疗指南》推荐的营养不良三级诊断[4]和五阶梯治疗[5]方案:(1)选择营养教育,并依次向上晋级选择口服营养补充、完全肠内营养,部分肠外营养、全肠外营养。(2)肠内营养通路,选择空肠营养管。(3)能量供给25~30 kcal·kg-1·d-1,其中蛋白质按照1.5 g·kg-1·d-1补充。(4)当下一阶梯不能满足60%能量需求3~5 d,选择上一阶梯治疗。(5)PG-SGA 4~<9分患者,人工营养同时抗肿瘤治疗。PG-SGA ≥9分,先行营养干预,能耐受90%~100%能量供给,即启动抗肿瘤治疗。
1.2.2抗肿瘤治疗方法
根据病情个体化采用放疗、同步放化疗和(或)序贯放化疗。根据2002(AJCC)第六版分期系统,临床Ⅱ~Ⅲ期给予肿瘤靶区剂量(dose of tumor,DT)50~60 Gy/25~30 f根治性放化疗及序贯化疗,颈段食管癌DT 60~66 Gy/30~33 f。Ⅳ期患者予以姑息性放疗或放化疗,DT 50~54 Gy/25~27 f。放疗技术采用调强放射治疗,靶区范围包括原发病灶和阳性淋巴结±高危淋巴结引流区,高危淋巴结预防照射DT 50~54 Gy/25~27 f。化疗方案采用铂类,氟尿嘧啶类,雷替曲塞,紫杉类等为基础的单药或联合化疗。
1.2.3观察指标及评价方法
定期监测血常规、淋巴细胞计数、白蛋白,每周进行体重测定。观察并记录恶心、呕吐、腹泻、食管炎、肺炎等不良反应。每月进行PG-SGA评分、血红蛋白、淋巴细胞计数、白蛋白、体重指数等营养指标评价并记录,至少记录4个月。根据营养评分(PG-SGA分值)保持和恢复情况分为4个等级:从营养干预第1天开始记录,与初始评分比较,1个月内恢复至治疗前初始水平且连续3个月评分不增加为保持较好;1~<2个月恢复至初始水平且连续3个月不增加为保持稍好;2~3个月恢复至初始水平且连续3个月不增加为保持一般;>3个月恢复至治疗前水平或任意期间不能连续保持3个月不增加为保持较差。于放疗结束时及结束后1个月分别进行1次疗效评价。评估方法包括颈、胸、腹部CT、上消化道钡餐和(或)胃镜等。评价标准为实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1。
1.3 统计学处理
数据采用SPSS17.0统计软件进行统计分析。率的比较采用χ2检验,若频数小于5,采用Fisher确切概率法。等级资料比较采用秩和检验。相关性分析采用Spearman相关性检验。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 营养复合指标PG-SGA评价
抗肿瘤治疗过程中,48例患者经规范营养干预,其中31例(64.58%)患者营养状保持评定为较好;9例(18.75%)保持评定稍好;4例(8.33%)保持一般;4例(8.33%)保持较差。不同的初始营养状态、性别、治疗方式、ECOG评分患者的营养状况保持比较,差异无统计学意义(P>0.05)。然而,营养状况保持在75岁及以上的患者中明显优于75岁以下的患者(P=0.047);Ⅱ~Ⅲ期患者明显优于Ⅳ期患者(P=0.001),见表1。

表1 患者营养状况保持情况[n(%)]
2.2 肿瘤缓解率
48例患者,部分缓解37例(77.08%),稳定9例(18.75%),进展2例(4.17%)。不同的初始营养状况、年龄、性别、肿瘤分期、治疗方式、ECOG评分,肿瘤缓解率均未见统计学差异,见表2。
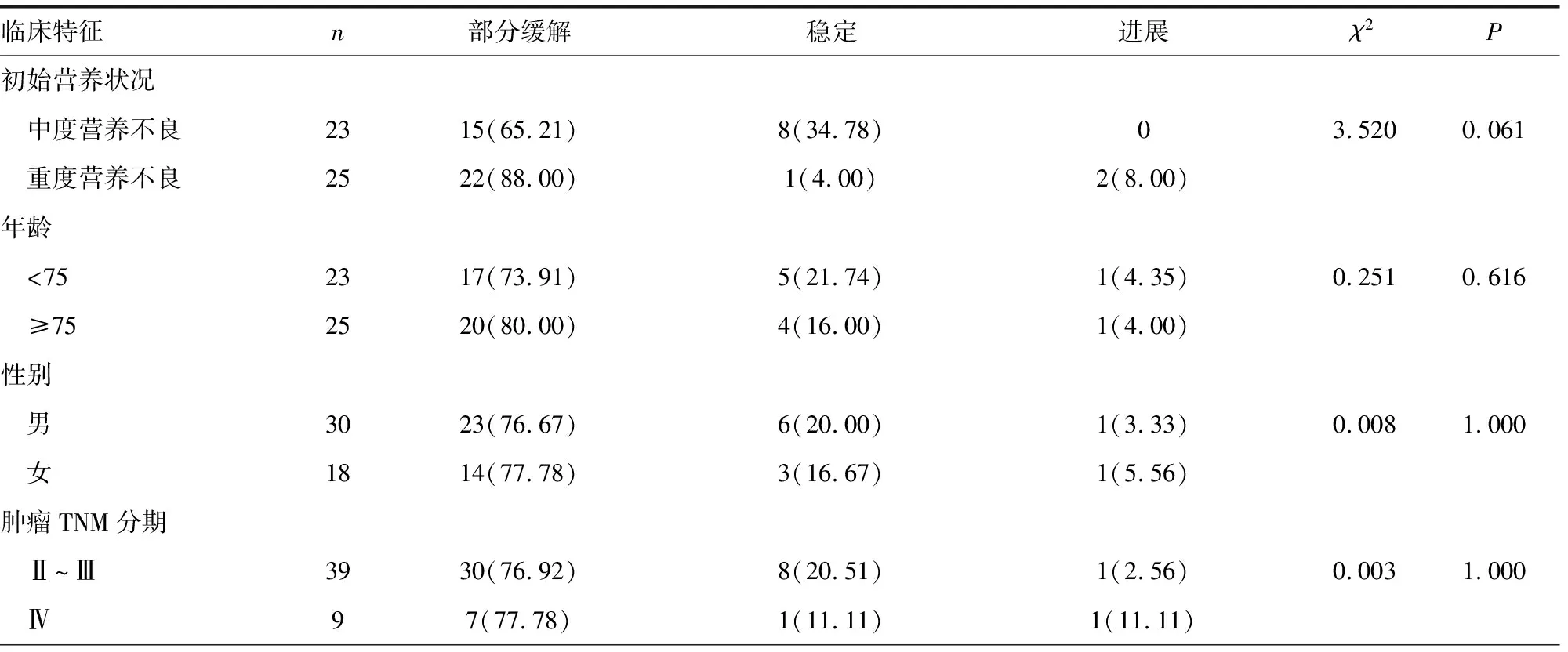
表2 患者肿瘤缓解情况[n(%)]
2.3 单个营养指标与PG-SGA相关性分析
体重指数与PG-SGA相关趋势最明显,随着PG-SGA评分改善,体重指数也相应改善。白蛋白分别在营养干预1个月和4月时与PG-SGA相关,淋巴细胞计数在第1个月时与PG-SGA相关。血红蛋白与PG-SGA无明显相关性,见表3。
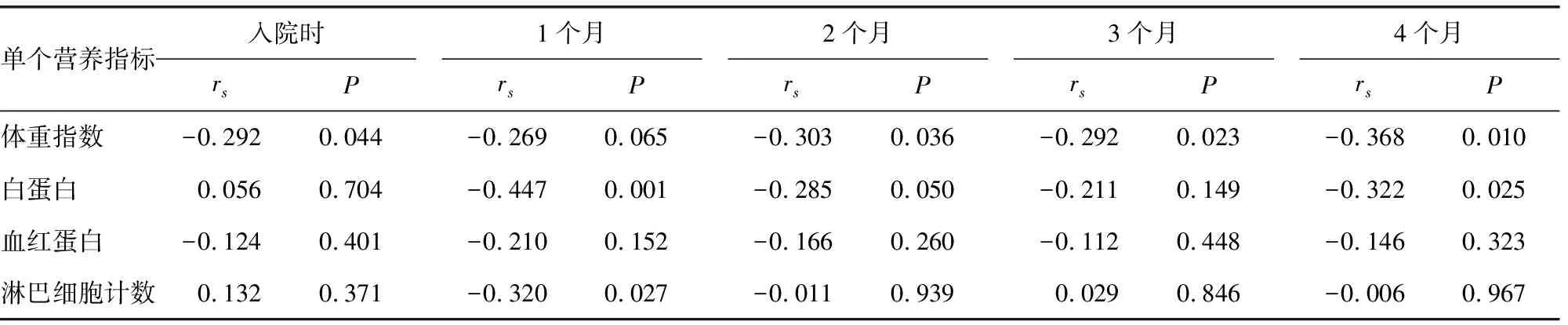
表3 单个营养指标与复合营养指标PG-SGA的相关性
2.4 不良反应
骨髓抑制、放射性食管炎和放射性肺炎为主要不良反应,Ⅲ级以上的不良反应发生率低,分别为3例(6.25%)、4例(8.33%)和1例(2.08%)。相对于初始中度营养不良患者,骨髓抑制在初始重度营养不良的患者中更多见(Z=-2.093,P=0.036)。年龄小于75岁的患者比年龄大于或等于75岁的患者放射性肺炎发生更多[60.87%(14/23)vs.32.00%(8/25),Z=-2.222,P=0.026]。主要不良反应,见表4。
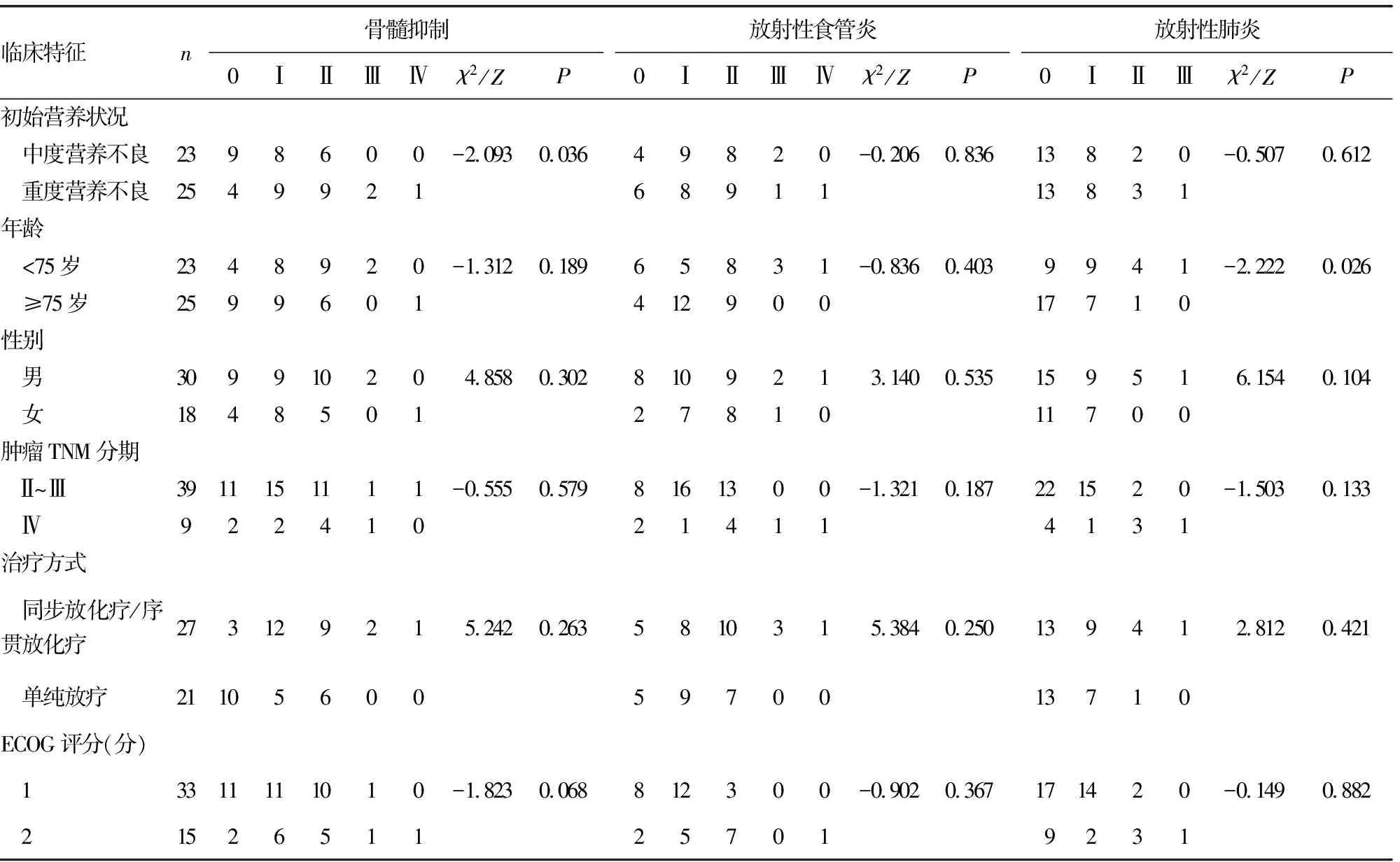
表4 主要不良反应(n)
3 讨 论
近年来多项研究均证实营养干预为食管癌患者带来明显益处[6-8]。正常机体70岁以后静息代谢率开始减少[9],但肿瘤患者整体上处于高代谢状态,静息能量消耗水平较基础能量消耗增高约10%[10]。《食管癌患者营养治疗指南》(2020版)对于食管癌患者日常能量需求,无确切的数据和准确的计算方法,常规推荐25~30 kcal·kg-1·d-1能量供给。国内一项关于消化道恶性肿瘤住院患者的能量消耗研究,纳入26例消化道肿瘤患者,其中包括11例食管癌;结果显示经人体代谢车测定静息代谢率计算每日能量消耗明显高于Harris-Bendict公式计算和30 kcal·kg-1·d-1估算的结果[11]。本研究入组老年患者比例较大,中位年龄75岁。经过规范化营养干预,64.58%的患者PG-SGA评分能在一个月内恢复,≥75岁的老年患者营养状况保持更优(Z=-1.990,P=0.047)。说明在抗肿瘤治疗期间给予25~30 kcal·kg-1·d-1能量,对于高龄(≥75岁)患者可行,而相对低龄(<75岁)的患者,可能不够。虽然本研究样本量较少,但已显示出高龄患者在规范化营养干预下进行抗肿瘤治疗,并不会比低龄患者加重原先的营养不良。
初始中度和重度营养不良的患者,营养状况的保持比较差异无统计学意义(Z=-0.388,P=0.698),近期肿瘤缓解率分别为65.21%和88.00%(χ2=3.520,P=0.061)。表明重度营养不良食管癌患者,放化疗期间进行规范营养干预,营养状况可以良好保持,近期疗效并不会减低。本研究中,肿瘤TNM分期Ⅳ期患者营养状况保持比Ⅱ~Ⅲ期患者差(Z=-3.230,P=0.001)。推测原因是Ⅳ期食管癌患者肿瘤负荷更大,能耗会更多,25~30 kcal·kg-1·d-1能量供给不足。由于本研究纳入的Ⅳ期患者仅为9例,探明原因应扩大样本量开展更加个体化的研究。
单个营养指标与PG-SGA相关性分析提示,体重指数相关趋势最明显,除第1个月时(rs=-0.269,P=0.065)处在有相关性统计学差异的边缘,其他时间点均呈明显相关性。淋巴细胞计数和白蛋白水平在接受抗肿瘤治疗后1个月时出现减低,与PG-SGA高评分明显相关(rs=-0.320、-0.447,P=0.027、0.001)。在第4个月时随着PG-SGA评分恢复和改善,白蛋白水平亦相应增高(rs=-0.322,P=0.025),这与国内外其他研究结果有所不同[12-14]。欧洲肠外肠内营养学会(european society for parenteraland enteral nutrition,ESPEN)指南建议,推荐肿瘤患者蛋白质需要量范围从最少1 g·kg-1·d-1到目标需要量1.2~2.0 g·kg-1·d-1[15]。本研究中蛋白质是按照1.5 g·kg-1·d-1补充,大概1个月时白蛋白低谷出现,免疫系统也处于相对抑制状态。因此,本课题组认为对于营养不良的患者,蛋白质补充量应根据耐受情况在1.5 g·kg-1·d-1基础之上进一步提高,特别是在接受放化疗的最初1个月内。
另一个困扰临床的难题是,重度营养不良的食管癌患者,在营养干预后何时启动抗肿瘤治疗合适?《食管癌营养治疗指南》(2020版),推荐先人工营养1~2周,待营养状况改善后,再启动抗肿瘤治疗。然而,实际工作中即使先给予营养治疗,营养状况也难以在1~2周明显改善。本研究在患者能够耐受90%~100%的能量供给,即启动抗肿瘤治疗,近期肿瘤缓解37例(77.08%),且主要Ⅲ级以上不良反应发生率均低于10%。这为何时介入抗肿瘤治疗,提供了有价值的参考。值得注意的是,重度营养不良患者骨髓抑制发生更多见(Z=-2.093,P=0.036),但多为Ⅰ~Ⅱ度,Ⅲ级以上骨髓抑制的比例较低,经处理后均安全渡过。放射性肺炎在小于75岁的患者发生率更高(Z=-2.222,P=0.026),分析考虑这可能与本研究中此类患者接受了更多的化疗和更高剂量的放疗有关,而并非与年龄因素本身有关。
累计第1、2、3个月PG-SGA评分恢复的患者共有44例,占91.67%。规范的营养干预能为90%以上的患者赢得3个月的营养状态保持期,从而为抗肿瘤治疗赢得时间窗。同时本研究结果,也提示在营养耐受充分的情况下,重度营养不良和老年患者,接受放化疗也是安全有效的。

