基于PI3K/Akt/NF-κB途径探究补肾活血方治疗子宫内膜异位症的作用机制研究*
马中岭,刘鑫,汪玉凤
(青海省人民医院产科,西宁 810007)
子宫内膜异位症(EMS)是一种临床常见的妇科疾病,因子宫内膜组织发生转移、侵袭,定植在宫腔以外部位造成,患者常有痛经、不孕、月经不调、盆腔包块等症状,该病发病率高,影响着全球范围内5%~10%的育龄妇女,严重威胁着女性身体健康和生活质量[1-2]。目前,西医学临床治疗主要采用药物和手术两种疗法,长期药物疗法可能加重肝肾功能损伤,而手术切除病灶后仍具有一定的复发率,临床疗效欠佳[3]。中医认为,肾虚血瘀、肾阳不足、瘀毒阻络是诱发EMS的主要原因,因此,对于EMS的治疗,应以补肾活血、祛瘀解毒法为主,研究表明,补肾活血方(BSHXR)联合西药对EMS术后的疗效确切,可提高治疗效果,改善患者生活质量,显著减轻患者的临床症状,降低EMS的复发率,然而BSHXR对EMS的治疗作用机制尚不清楚[4-5]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶 B(Akt)/核因子 κB(NF-κB)途径是一种密切参与到细胞生长繁殖、运动、代谢和免疫应答调节的信号通路,多在恶性肿瘤疾病中呈激活状态[6-7]。研究表明,EMS虽是良性妇科疾病,但其特点与恶性肿瘤的转移侵袭能力相似,同样,PI3K途径也与子宫内膜异位症的发病密切相关,该途径的激活可诱导血管内皮细胞生长,加速EMS的发展进程[8]。因此,本研究以PI3K/Akt/NF-κB途径为切入点,研究BSHXR对EMS大鼠的治疗作用及其作用机制。
1 材料和方法
1.1 实验动物 SPF级SD大鼠60只,健康未孕雌性,体质量(250±20)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。动物饲养于青海大学医学院动物实验中心标准动物房,饲养条件:室温(22±1)℃,湿度 50%±10%,每日定时换气,保持12 h∶12 h光暗照明,自由采食、饮水。
1.2 主要试剂与仪器 BSHXR由熟地黄6 g,枫香脂 10 g,人工麝香 10 g,蛴螬 10 g,土鳖虫 10 g,五灵脂 6 g,制何草乌 6 g,乳香 10 g,虻虫 10 g,当归 6 g组成,由本院药剂科制备成含生药量2 g/mL的水煎液;PI3K抑制剂LY294002(英国Abcam公司,货号:ab120243);肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)ELISA 检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-R2856c、E-EL-R0012c、E-EL-R0896c);RevertAidTMfirst Strand cDNA Synthesis Kit、SYBR Green Real-Time PCR Master Mixes(美国 Thermo scientific 公司,货号:K1621、K0252);血小板-内皮细胞黏附分子(CD31)、磷脂酰肌醇 3-激酶(PI3K)、磷酸化磷脂酰肌醇3-激酶(p-PI3K)、蛋白激酶 B(Akt)、磷酸化蛋白激酶 B(p-AKT)、核因子 κB(NF-κB)p65 兔单抗(美国CST 公司,货号:77699、17366、17366、4685、4060、8242);辣根过氧化物酶标记的山羊抗兔免疫球蛋白 G(IgG)(IgG-HRP)(上海碧云天生物技术有限公司,货号:A0208);双板垂直电泳仪(北京六一仪器厂,型号:DYCZ-24KS);显微镜(日本奥林巴斯,型号:IX53);多功能凝胶成像系统(Syngene,型号:G:BOX);7500型PCR仪(美国AppliedBiosystems公司);酶标仪(Thermo Fisher Scientific公司,型号:Multiskan MK3)。
1.3 实验方法
1.3.1 造模方法 参考文献方法建立EMS大鼠模型[9]:大鼠适应性喂养1周后,腹腔注射2.5%戊巴比妥钠溶液麻醉,固定、备皮、消毒,在下腹正中处打开腹腔,分离子宫,剪取右侧子宫角的部分组织并剥离子宫内膜,用活检穿孔器取2个面积为5 mm×5 mm的片段,移植于肠系膜动脉血管处,尽量远离切口。使用庆大霉素冲洗腹腔,逐层关腹,缝合切口。术后3 d内,大鼠腹腔注射0.1 mL庆大霉素防止感染。造模4周后,开腹观察大鼠移植物呈椭圆形或圆形的囊性结节,高度≥2 mm,并且表面有大量血管形成,与周围组织黏连紧密,表明造模成功,共成功造模50只大鼠。
1.3.2 分组与给药 将建模成功的EMS大鼠随机分为模型组、BSHXR高、中、低剂量组、LY294002组,每组10只,另取10只大鼠作为假手术组,仅开腹剪开子宫组织,随后缝合。造模4周后开始给药,按照人与大鼠体表面积折算等效剂量,中剂量为7.56 g/kg,高剂量为 15.12 g/kg,低剂量为 3.78 g/kg,BSHXR低、中、高剂量组大鼠按照上述剂量灌胃给药,假手术组和模型组大鼠灌胃等体积0.9%氯化钠溶液,LY294002组大鼠腹腔注射0.04g/kg的LY294002溶液,每日1次,连续28 d。
1.3.3 EMS大鼠异位子宫内膜病灶体积检测 末次给药后24 h,使用游标卡尺测量各组大鼠异位子宫内膜病灶的体积。处死大鼠后,腹主动脉取血,置于4℃冰箱中静置3 h,然后3 000 r/min,离心15 min(离心半径为12.5 cm),取上清液,用于ELISA试剂盒检测。剥离大鼠子宫,假手术组分离正常子宫内膜组织,其余各组大鼠分离异位子宫内膜组织,生理盐水清洗后取1 g用于实时荧光定量聚合酶链反应(RT-qPCR)及Western blot检测,其余组织放置于4%多聚甲醛溶液固定,用于苏木精-伊红(HE)和免疫组化染色。
1.3.4 HE染色观察异位子宫内膜灶组织病理变化 将大鼠子宫内膜组织在4%多聚甲醛溶液中固定48 h后,蒸馏水清洗,梯度乙醇脱水,石蜡包埋,作4 μm组织切片,二甲苯脱蜡30 min,梯度乙醇及蒸馏水中复水,HE染色,脱水、透明后中性树胶封片,光镜下观察大鼠异位子宫内膜组织病理变化。
1.3.5 ELISA法检测血清TNF-α、IL-1β和IL-6的水平 取各组大鼠血清,严格按照试剂盒说明书步骤检测 TNF-α、IL-1β、IL-6水平。
1.3.6 免疫组化检测异位子宫内膜组织CD31表达取1.3.3中制备的组织石蜡切片,组织切片首先进行烤片、脱蜡、复水,然后抗原修复、封闭,滴加稀释的CD31兔单抗(稀释比例为1∶100),放入湿盒中4℃过夜,次日滴加羊抗兔二抗37℃孵育30 min,磷酸盐缓冲液(PBS)冲洗后滴加DAB显色液,苏木精染细胞核,梯度乙醇脱水,中性树胶封片,每组切片于光镜下拍摄5个视野,通过Image J软件统计获得CD31阳性细胞比率并取平均值,LSD-t检验分析不同组间CD31阳性表达差异。
1.3.7 RT-qPCR检测异位子宫内膜组织VEGF及MMP-9 mRNA水平 取大鼠异位子宫内膜组织,加入Trizol裂解液提取总RNA,使用逆转录试剂盒合成cDNA作为荧光定量模版。引物序列见表1。反应条件为:95℃预变性5 min,95℃变性30 s、62℃退火30 s、72℃延伸30 s,共40个循环,最后72℃延伸10 min,4℃5 min终止反应,实验重复3次。采用2-ΔΔCT法计算目的基因mRNA相对表达水平。
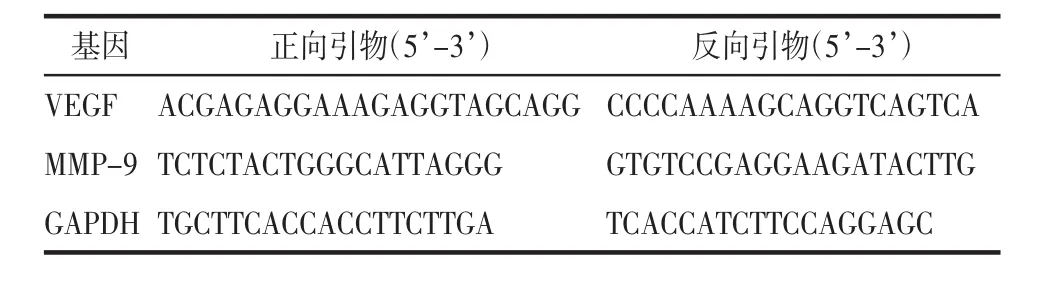
表1 引物序列Tab.1 Primer sequence
1.3.8 Western blot法检测异位子宫内膜组织PI3K/Akt/NF-κB通路蛋白表达水平 取大鼠异位子宫内膜组织,研磨匀浆后加入裂解液提取组织蛋白,测定蛋白浓度,蛋白中加入loading buffer,混匀后置于沸水中煮沸5 min使蛋白变性,然后进行SDSPAGE电泳,转膜、封闭后将聚偏二氟乙烯(PVDF)膜放入各一抗稀释液中,稀释比例均为1∶1 000,4℃过夜,次日以TBST清洗后加入羊抗兔二抗(1∶2 000)37℃孵育2 h,洗膜,滴加发光液,置凝胶成像仪显影。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参蛋白,采用Image J软件分析各蛋白对应的灰度值,计算蛋白的相对表达量,蛋白相对表达量=目的蛋白灰度值/GAPDH蛋白灰度值。
1.4 统计学分析 应用SPSS 25.0统计软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 BSHXR对EMS大鼠异位子宫内膜病灶体积的影响 结果显示,假手术组大鼠无异位的子宫内膜组织,模型组可见明显异位子宫内膜病灶形成。与模型组比较,BSHXR低、中、高剂量组大鼠及LY294002组大鼠异位子宫内膜病灶体积均减小,其中,BSHXR降低异位子宫内膜病灶体积的作用呈剂量依赖性,差异有统计学意义(P<0.05)。BSHXR高剂量组与LY294002组比较,差异无统计学意义(P>0.05)。见图1。

图1 BSHXR对EMS大鼠异位子宫内膜体积的影响Fig.1 Effect of BSHXR on the volume of ectopic endometrium in EMS rats
2.2 EMS大鼠异位子宫内膜组织病理学观察 HE染色显示,假手术组大鼠子宫内膜组织完整,上皮细胞排列整齐、有序,细胞核较小,腺体数量和形态正常。与假手术组比较,模型组大鼠异位子宫内膜组织腺上皮细胞和基质细胞密集,细胞核较大,胞浆丰富,腺腔完整。与模型组比较,BSHXR低、中、高剂量组及LY294002组腺上皮细胞胞核体积缩小、不规则,排列松散,形态逐渐变为单层柱状,内膜腺上皮层变薄。见图2。

图2 HE染色观察各组大鼠子宫内膜组织病理学变化(HE×400)Fig.2 The histopathological changes of endometrium of rats in each group(HE staining×400)
2.3 BSHXR 对 EMS大鼠血清 TNF-α、IL-1β、IL-6水平的影响 结果显示,模型组大鼠血清炎症因子TNF-α、IL-1β、IL-6 的水平显著高于假手术组,BSHXR低、中、高剂量组大鼠及LY294002组大鼠血清炎症因子TNF-α、IL-1β、IL-6的水平均低于模型组,BSHXR各剂量组之间呈剂量依赖性,差异有统计学意义(P<0.05)。BSHXR高剂量组炎症因子TNF-α、IL-1β、IL-6的水平与 LY294002组比较,差异无统计学意义(P>0.05)。见图3。

图3 各组大鼠血清炎症因子水平比较Fig.3 Comparison of serum inflammatory factors of rats in each group
2.4 BSHXR对EMS大鼠异位子宫内膜组织CD31表达水平的影响 与假手术组比较,模型组大鼠异位子宫内膜组织中CD31阳性细胞比例显著增加,与模型组比较,BSHXR低、中、高剂量组CD31阳性细胞比例呈剂量依赖性降低,差异有统计学意义(P<0.05)。BSHXR高剂量组CD31阳性细胞比例与LY294002组比较,差异无统计学意义(P>0.05)。见图4。

图4 各组大鼠异位子宫内膜组织CD31表达水平比较(IHC,×400)Fig.4 Comparison of CD31 expression in ectopic endometrium of rats in each group(IHC,×400)
2.5 BSHXR对EMS大鼠异位子宫内膜组织VEGF、MMP-9 mRNA水平的影响 结果显示,模型组大鼠异位子宫内膜组织VEGF、MMP-9 mRNA水平显著高于假手术组,BSHXR低、中、高剂量组VEGF、MMP-9 mRNA水平低于模型组,BSHXR各剂量组之间呈剂量依赖性,差异有统计学意义(P<0.05)。BSHXR高剂量组VEGF、MMP-9 mRNA水平与LY294002组比较,差异无统计学意义(P>0.05)。见图5。

图5 各组大鼠异位子宫内膜组织VEGF、MMP-9 mRNA水平比较Fig.5 Comparison of VEGF and MMP-9 mRNA levels in ectopic endometrium of rats in each group
2.6 BSHXR对EMS大鼠异位子宫内膜组织PI3K/Akt/NF-κB通路蛋白表达水平的影响 与假手术组比较,模型组大鼠PI3K、Akt磷酸化水平显著增加,胞核中NF-κB p65表达增加,胞质中NF-κB p65表达减少(P<0.05)。与模型组比较,BSHXR 低、中、高剂量组及LY294002组PI3K、Akt磷酸化水平降低,胞核中NF-κB p65表达降低,胞质中NF-κB p65表达增加,且BSHXR的作用呈剂量依赖性(P<0.05)。BSHXR高剂量组PI3K、Akt磷酸化水平和NF-κB p65表达与LY294002组比较,差异无统计学意义(P>0.05)。见图6。
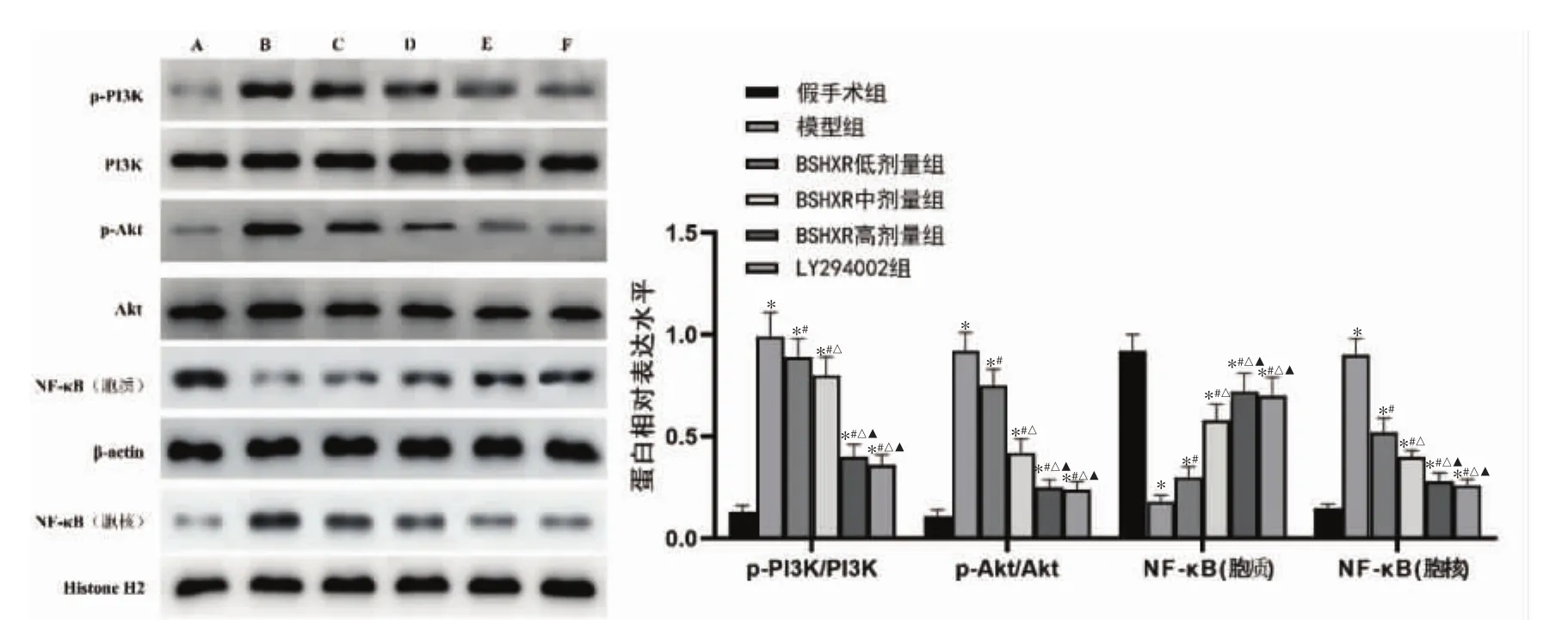
图6 各组大鼠异位子宫内膜组织PI3K/Akt/NF-κB通路蛋白表达水平比较Fig.6 Comparison of PI3K/Akt/NF-κB pathway protein expression levels in ectopic endometrial tissues of rats in each group
3 讨论
EMS属于临床常见的良性妇科疾病,生育期女性的发病率较高,该病症状易反复且顽固,包括痛经、性交疼痛、月经异常、不孕等,发病易累及盆腔器官甚至全身组织,不仅损害患者个人身体健康,给患者家庭及中国卫生系统也带来较大的经济负担[10-11]。EMS 属中医“癥瘕”“不孕”“月经不调”等范畴,血瘀和肾虚分别是EMS的关键病机和根本病机,血瘀和肾虚互为因果,相互影响,共同促进EMS的发生和发展[5]。已有多项研究表明,以补肾活血法治疗EMS可显著改善患者月经异常、经期腹痛等症状,降低雌激素水平,提高患者生活质量,但其具体作用机制尚不清楚[12-13]。本研究所用BSHXR由熟地黄、枫香脂、当归、制草乌、人工麝香、土鳖虫、蛴螬、五灵脂、虻虫、乳香等药材组成,具有温通补肾、活血化瘀之功效。本研究旨在通过EMS模型大鼠观察BSHXR对EMS的治疗作用,探究其作用机制。
本研究结果显示,模型组大鼠可见明显异位子宫内膜组织,病理切片显示该组大鼠异位子宫内膜组织上皮细胞排列相对整齐,细胞核增大,腺腔完整,表明造模成功。使用高、中、低剂量BSHXR治疗后,大鼠异位子宫内膜病灶体积均降低,且大鼠异位子宫内膜上皮细胞形态逐渐变为单层柱状,腺体数量和基质细胞的数量减少,表明BSHXR对EMS具有治疗作用,与既往研究结果一致[14]。研究表明,EMS的发生与腹腔免疫监视功能降低和炎症反应增加密切相关,改善机体炎症反应能够抑制异位子宫内膜病灶的生长[15]。TNF-α、IL-1β、IL-6 均是参与机体免疫应答、具有广泛免疫调节的促炎细胞因子,具有促进异位内膜及间质细胞的增殖、侵袭、转移及促进血管生成的作用,可导致盆腔局部组织黏连及纤维化,促使EMS异位子宫内膜病灶的形成[16-17]。本研究结果显示,模型组大鼠血清炎症因子TNF-α、IL-1β、IL-6水平显著升高,使用不同剂量BSHXR治疗后,大鼠血清中 TNF-α、IL-1β、IL-6水平均降低,表明BSHXR可减轻EMS大鼠炎症反应。
现代研究认为,EMS的发生发展均涉及细胞的黏附、侵袭和血管形成过程,因此,抑制细胞异常的黏附、侵袭和血管形成过程已成为预防EMS的关键[18]。MMPs和VEGF是异位子宫内膜在盆腔病变的关键因子,其中,MMP-9是基质金属蛋白酶家族中活性最强的一员,可降解细胞外基质成分,促进EMS的侵袭和血管形成过程,而EMS患者MMP-9基因的表达水平也往往呈异常增高的状态,该基因的水平可作为评估EMS严重程度的指标[19]。VEGF是一种强效特异性血管生成因子,可直接作用于内皮细胞而促进血管新生,加快在位子宫内膜异常转移及异位子宫内膜的增生[20]。CD31是内皮细胞特异性标志物,常用于反映血管生成情况[21]。本研究结果显示,模型组大鼠异位子宫内膜组织CD31阳性细胞比例升高,VEGF、MMP-9 mRNA水平亦显著升高,使用BSHXR低、中、高剂量治疗后,大鼠异位子宫内膜组织中CD31阳性细胞比例和VEGF、MMP-9 mRNA水平均降低,表明BSHXR治疗EMS的机制之一可能是抑制CD31、VEGF及MMP-9的表达,抑制EMS黏附、侵袭和血管形成过程。
PI3K/Akt/NF-κB信号通路是一种密切参与到细胞生长繁殖、运动、代谢和免疫应答调节的信号通路,几乎所有人类和动物肿瘤疾病中均发现了其被活化的现象[22]。PI3K是生长因子受体超家族信号传导途径的关键分子,可被生长因子、细胞因子和激素与受体酪氨酸激酶和G蛋白偶联受体结合而激活,激活后的PI3K可进一步活化下游的Akt,而PI3K/Akt通路的表达改变会影响IκB的表达水平,由于IκB是NF-κB的抑制性因子,因此当IκB被抑制后可促进NF-κB的活化,并进一步引起炎症因子释放[23-24]。研究表明,PI3K相关信号转导途径在EMS中发挥重要作用,抑制该信号通路的活化可改善大鼠EMS相关症状[25]。在本研究中,模型组大鼠PI3K、Akt磷酸化水平显著增加,NF-κB p65转移入核水平增加,使用BSHXR低、中、高剂量治疗后,大鼠异位子宫内膜中PI3K、Akt磷酸化水平降低,NF-κBp65入核减少。为了进一步探究BSHXR治疗EMS的作用机制,本研究同时使用了PI3K抑制剂LY294002。LY294002是PI3K的选择性抑制剂,可阻断该通路上部分基因和蛋白表达,有研究表明,LY294002可通过抑制PI3K通路对EMS动物产生治疗作用,抑制上皮间质细胞的活性,促进细胞凋亡[26-27]。与上述研究结果一致,本研究结果显示,LY294002对EMS大鼠的治疗作用与BSHXR高剂量组比较,差异无统计学意义(P>0.05),提示BSHXR对EMS的治疗作用可能是通过抑制PI3K/Akt/NF-κB信号通路活化产生的。
综上所述,BSHXR可抑制PI3K/Akt/NF-κB信号通路的活化,缩小异位子宫内膜病灶体积,改善异位子宫内膜病理学变化,抑制炎症反应及血管新生过程,下调VEGF和MMP-9的表达。本研究初步揭示了BSHXR治疗EMS的作用机制,但EMS是一种多因素疾病,病机复杂,其疗效及作用机制仍需进一步结合体外实验及临床研究加以阐明。

