羟基多壁碳纳米管分散固相萃取/气相色谱-串联质谱法测定党参中75种农药残留
杨志敏,常巧英,李 坚,许晓辉,薛华丽,朱仁愿
(1.兰州市食品药品检验检测研究院,食品中农药兽药残留监控重点实验室,甘肃 兰州 730050;2.中国农业大学食品科学与营养工程学院,北京 100083;3.甘肃农业大学 理学院,甘肃 兰州 730070;4.天津科技大学省部共建食品营养与安全国家重点实验室,天津 300457)
党参(Codonopsis radix)属桔梗科植物,是多年生草本植物党参属的根,为药食两用的道地药材,具有补中益气、生津止渴、健脾益肺之功效[1]。党参在种植、加工及储存过程中,需用化学农药抑制或防止病虫害,以保障其产量和质量,但农药的不规范使用不可避免地会导致残留的发生。近年来,农药残留问题已成为社会各方面关注的焦点。《中国药典》对中药材中农药残留限量做出规定的农药数量只涉及33 种,GB 2763-2021 《食品中农药最大残留限量》[2]也未针对党参中农药残留做出限量规定,只有较少农药在药用植物中有限量规定。因此,建立党参中农药多残留的分析方法具有重要意义。
目前,中药材中农药残留的检测方法主要有气相色谱法[3-6]、液相色谱法[7]、气相色谱-串联质谱法[8-12]、液相色谱-串联质谱法[13-17]、飞行时间质谱法[18-20]、拉曼光谱法[21]等,与之相关的前处理方法有固相萃取法、固相微萃取法、液液微萃取法、分散固相萃取法等[3-21]。其中,分散固相萃取法因操作简单、价格低廉等优点被广泛应用于食品、环境、中药材等领域。该方法利用净化剂吸附基质中的杂质达到净化目的。目前常用的净化剂有N-丙基乙二胺(PSA)硅烷化硅胶、十八烷基硅烷键合硅胶(C18)、石墨化碳(GCB)吸附剂,主要用于含水量高、基质简单的样品,对于复杂基质的样品有待探索使用新型吸附剂。碳纳米管(CNTs)是碳六元环构成的类石墨平面卷曲而成的纳米级中空管[22],因化学性质稳定、比表面积大、吸附力强、易于改性和修饰等特点,近年来在农药多残留的前处理检测技术中显示了优异的特性[23-24]。
党参中含有大量的色素、党参苷、脂类、多糖、生物碱等成分[25],而农药残留含量往往很低,有效去除杂质干扰是实现痕量分析准确性的关键因素。目前关于党参中农药残留的测定方法主要有气相色谱法[5-6]、气相色谱-串联质谱法[10]、液相色谱-串联质谱法[15-17]、飞行时间质谱法[20]等,其中质谱技术在农药多残留检测中优势突出。党参中农药残留前处理方法鲜见利用碳纳米管作为吸附材料的报道。本文以羟基多壁碳纳米管(MWCNTs-OH)为净化吸附剂,通过优化提取溶剂、提取体系、净化填料组合改进前处理方法,结合气相色谱-串联质谱(GC-MS/MS)技术建立了党参中农药多残留的测定方法,为中药材中农药多残留的检测提供技术支持。
1 实验部分
1.1 仪器与试剂
7890B-7000D 气相色谱-三重四极杆质谱联用仪(美国Agilent 公司);5810R 高速低温离心机(德国Eppendor公司);Milli-Q超纯水机(美国Millipore公司);VORTEX-2涡旋振荡器、KS40001控制型控温摇床、A11 基本型分析研磨机(德国IKA 公司);AUTO-EVA-60 全自动平行浓缩仪(睿科集团股份有限公司)。
无水硫酸镁、氯化钠、乙酸钠、柠檬酸钠(分析纯,国药集团化学试剂有限公司);PSA、C18、GCB(美国Agilent 公司);多壁碳纳米管(MWCNTs)和羟基多壁碳纳米管(MWCNTs-OH)(中国科学院成都有机化学有限公司)。75种农药标准品(纯度均≥95.0%,德国Dr.Ehrenstorfer 公司)。正己烷、乙腈、乙酸乙酯(色谱纯,德国Merck公司);丙酮(色谱纯,科密欧化学试剂有限公司);冰乙酸(西陇化工股份有限公司)。
1.2 标准溶液的配制
称取10 mg(精确至0.01 mg)标准品分别置于10 mL 容量瓶中,用丙酮稀释定容至刻度,于-18 ℃低温避光保存。准确移取一定体积的标准储备液,用乙酸乙酯稀释为0.4 mg/L 的混合标准工作液,于-18 ℃避光保存。
称取党参空白样品,按照“1.3”样品处理方法进行提取、净化、离心、浓缩、复溶和过膜后制备空白样品提取液,临用前吸取适量标准工作液,配制成质量浓度分别为5、10、25、50、100、200、300 μg/L的系列基质混合标准工作溶液。
1.3 样品前处理
将党参的干燥根置于高速粉碎机中粉碎至粉末状,过100 目筛,混匀,备用。准确称取2 g 样品(精确至1 mg)至50 mL 离心管中,加入5.0 mL 超纯水,涡旋,充分浸润样品,放置30 min。再加入10.0 mL 乙酸乙酯和一颗陶瓷均质子,涡旋混匀,300 r/min 振摇10 min,加入6.0 g无水硫酸镁、1.5 g乙酸钠,立即摇散混匀,300 r/min 振摇10 min,以4 ℃、3 900 r/min 离心5 min。取3.0 mL 上清液,置于预先装有净化材料的分散固相萃取净化管(无水MgSO4450 mg、PSA 100 mg、MWCNTs-OH 3 mg)中,涡旋使充分混匀,1 000 r/min 振荡10 min 使净化完全,4 ℃、3 900 r/min 离心5 min,取2.0 mL 净化液氮吹至近干,用1.0 mL乙酸乙酯复溶,过膜,待测。
1.4 色谱与质谱条件
HP-5MS UI毛细管色谱柱(30 m×0.25 mm,0.25 μm);程序升温:60 ℃,保持1 min,以40 ℃/min升温至170 ℃,再以10 ℃/min升温至310 ℃并保持3 min;载气为氦气(纯度99.999%);进样量1.0 μL;不分流进样;进样口温度:280 ℃;传输线温度:280 ℃;流速:0.9 mL/min。离子源:EI源;电子能量70 eV;离子源温度230 ℃;动态多反应监测(dMRM)扫描模式;溶剂延迟:2.5 min。75种农药的质谱参数见表1。
2 结果与讨论
2.1 质谱条件优化
对75 种农药的混合标准溶液在m/z50~500 范围内进行全扫描,使用NIST 标准库匹配检索,确定目标物的保留时间,并对其前级离子、产物离子及碰撞能量等质谱参数进行优化,利用软件自带的dMRM 模式进一步优化。该检测方法可简化分析流程,提高分析效率,适合农药多残留的分析。图1为优化条件下75种农药(0.1 mg/L)的总离子流图。
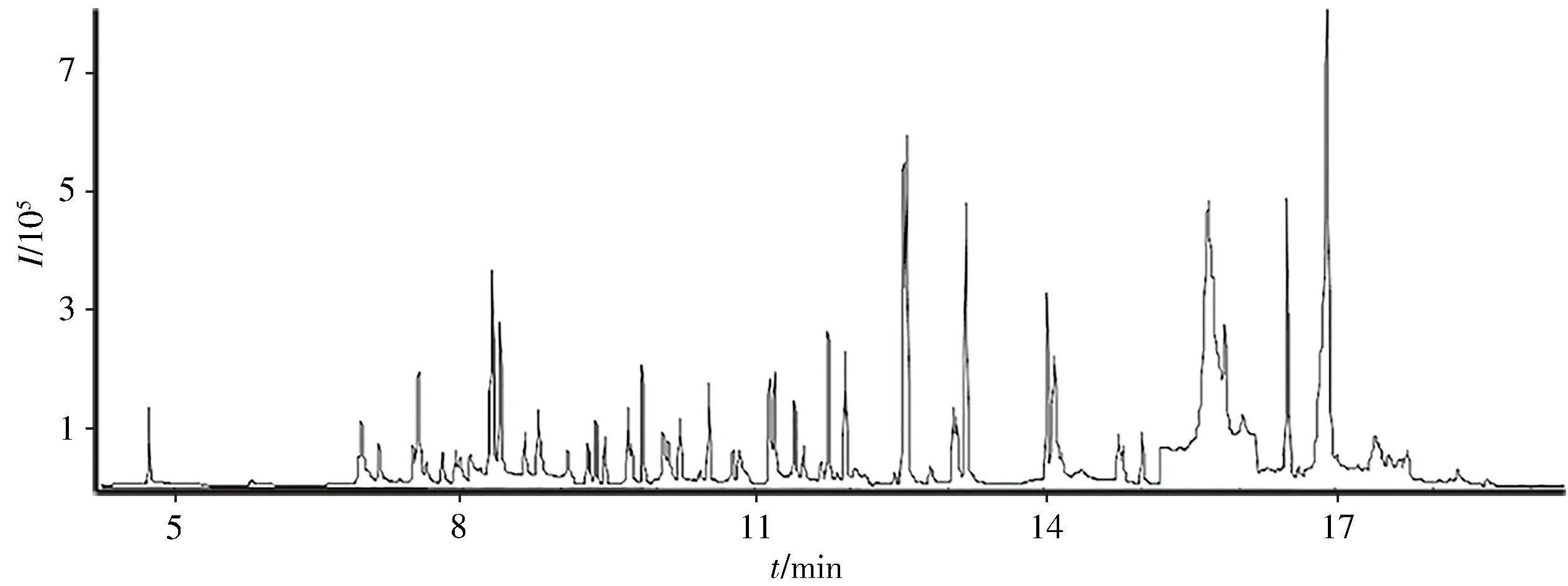
图1 75种农药(0.1 mg/L)在MRM模式下的总离子流图Fig.1 Total ion chromatogram of 75 pesticides in MRM mode(0.1 mg/L)
2.2 前处理条件优化
2.2.1 提取溶剂的选择由于目标农药种类多、极性差异大,因此筛选适合大多数农药的提取溶剂尤为重要。本实验分别对比了丙酮、乙酸乙酯、正己烷-丙酮(1∶1)、乙腈、1%乙酸乙腈作为溶剂提取75 种农药的回收率(图2)。结果表明,回收率在70%~120%范围内目标农药数量最多的提取溶剂为乙酸乙酯(72种农药),其次为乙腈(67种农药)。乙酰甲胺磷、乐果、硫环磷、甲基硫环磷和唑螨酯在乙酸乙酯中的回收率均在70%~120%范围,而在乙腈中的回收率低于70%或高于120%,尤其上述4种有机磷农药在乙酸乙酯中的回收率显著高于乙腈,这5种农药的极性均较强,回收率偏低可能与极性有关。因此,实验选择乙酸乙酯为提取溶剂。
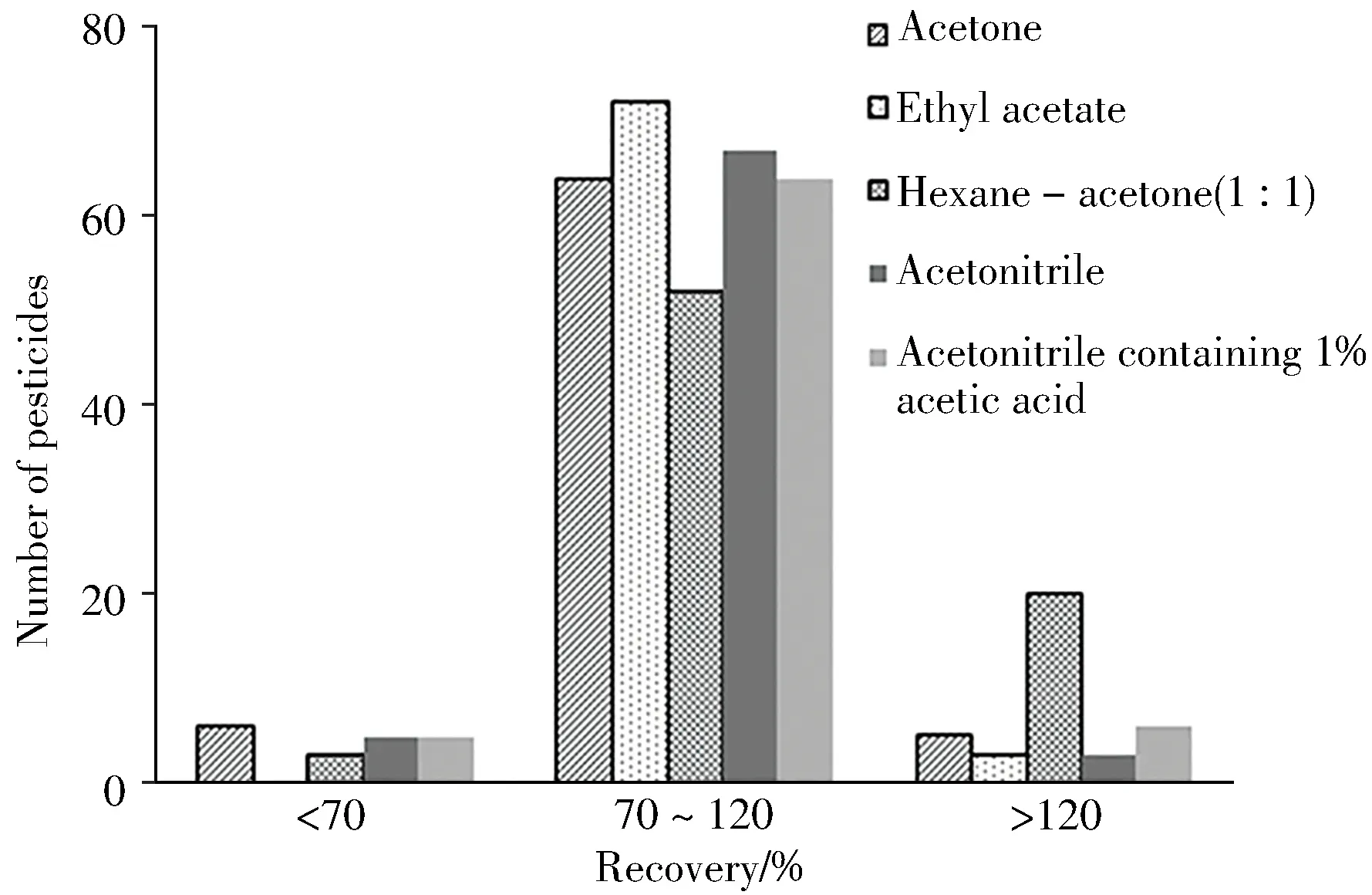
图2 提取溶剂对提取效果的影响Fig.2 Effects of different solvent on the extraction efficiency
2.2.2 提取体系的优化本实验涉及有机磷、有机氯、拟除虫菊酯类等多种农药,为防止提取过程中由于酸碱不稳定导致农药分解,需形成缓冲盐体系以减少农药的损失。考察了3 种提取体系(体系1:无水MgSO46.0 g + NaCl 1.5 g;体系2:无水MgSO46.0 g + NaAc 1.5 g;体系3:无水MgSO45.0g + NaCl 1.0 g + Na3C6H5O71.5 g)对75 种目标农药提取效果的影响(图3)。结果表明,第2 种提取体系的整体回收率最佳,且回收率在70%~120%范围内的农药数量最多,回收率低于70%或高于120%的农药较其它两种提取体系少。因此,实验以无水MgSO46.0 g + NaAc 1.5 g 为最佳提取体系。

图3 不同提取体系对提取效果的影响Fig.3 Effects of different solution system on the extraction efficiency
2.2.3 吸附剂种类的考察固定无水MgSO4450 mg 和PSA 100 mg,考察了不添加其它吸附剂和分别添加30 mg C18、GCB、MWCNTs、MWCNTs-OH 吸附剂5 种方案的净化效果,发现添加GCB 和MWCNTs-OH 两种方案的回收率在70%~120%范围内的农药数量最多,考虑到实验成本,选择无水MgSO4、PSA和MWCNTs-OH为净化吸附剂。
2.2.4 MWCNTs-OH 用量的选择固定无水MgSO4为450 mg,PSA 为100 mg,将3 mL 提取液分别加入净化管中,考察了MWCNTs-OH 不同用量(0、3、5、10、20、30、40 mg)对农药回收率的影响(见图4)。结果发现,MWCNTs-OH 用量为3 mg时,回收率在70%~120%的农药数量最多。因此,本实验以MgSO4450 mg+PSA 100 mg+MWCNTs-OH 3 mg为最佳净化剂组合。
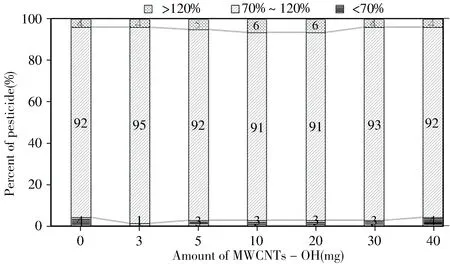
图4 MWCNTs-OH用量对净化效果的影响Fig.4 Effects of amount of MWCNTs-OH on the purification efficiency
2.3 方法学考察
2.3.1 线性关系、检出限及定量下限采用本方法对质量浓度分别为5、10、25、50、100、200、300 μg/L 的系列基质混合标准工作溶液进行测定,以各农药的质量浓度为横坐标(x,mg/L),对应的峰面积为纵坐标(y),绘制标准曲线。结果表明,75 种农药在5~300 μg/L 质量浓度范围内线性关系良好,相关系数(r2)均不低于0.996 1。以阴性样品加标处理后采用本方法进行检测,得到检出限(S/N= 3)为0.001~0.054 mg/kg,定量下限(S/N= 10)为0.002~0.178 mg/kg(见表1),符合多数农药残留的筛查要求。
2.3.2 准确度与精密度向阴性样品中分别添加0.025、0.05、0.20、0.50 mg/kg 4 个水平的混合标准溶液,每个水平重复4 次,采用本方法测定并计算各农药的平均加标回收率。75 种农药在党参中的平均回收率为69.7%~113%,相对标准偏差(RSD,n=4)为0.64%~6.7%(见表1),方法的准确度和精密度满足农药多残留分析的要求。
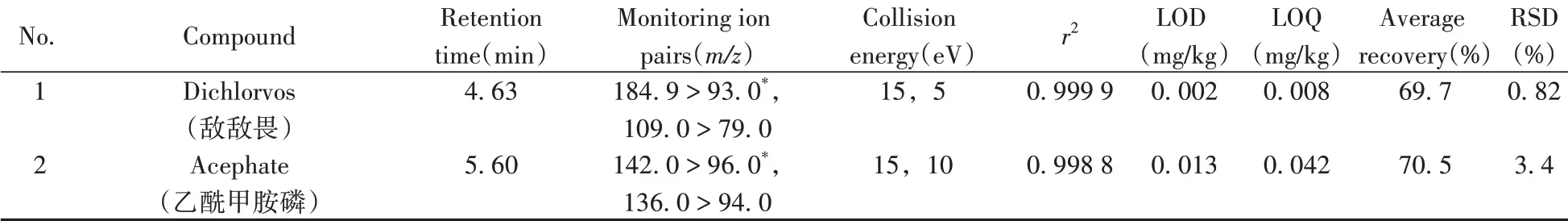
表1 75种农药的保留时间、MRM参数、相关系数、检出限、定量下限、平均加标回收率及相对标准偏差(n=4)Table 1 Retention times,MRM parameters,correlation coefficients,LODs,LOQs,average recoveries and RSDs(n=4)of 75 pesticides
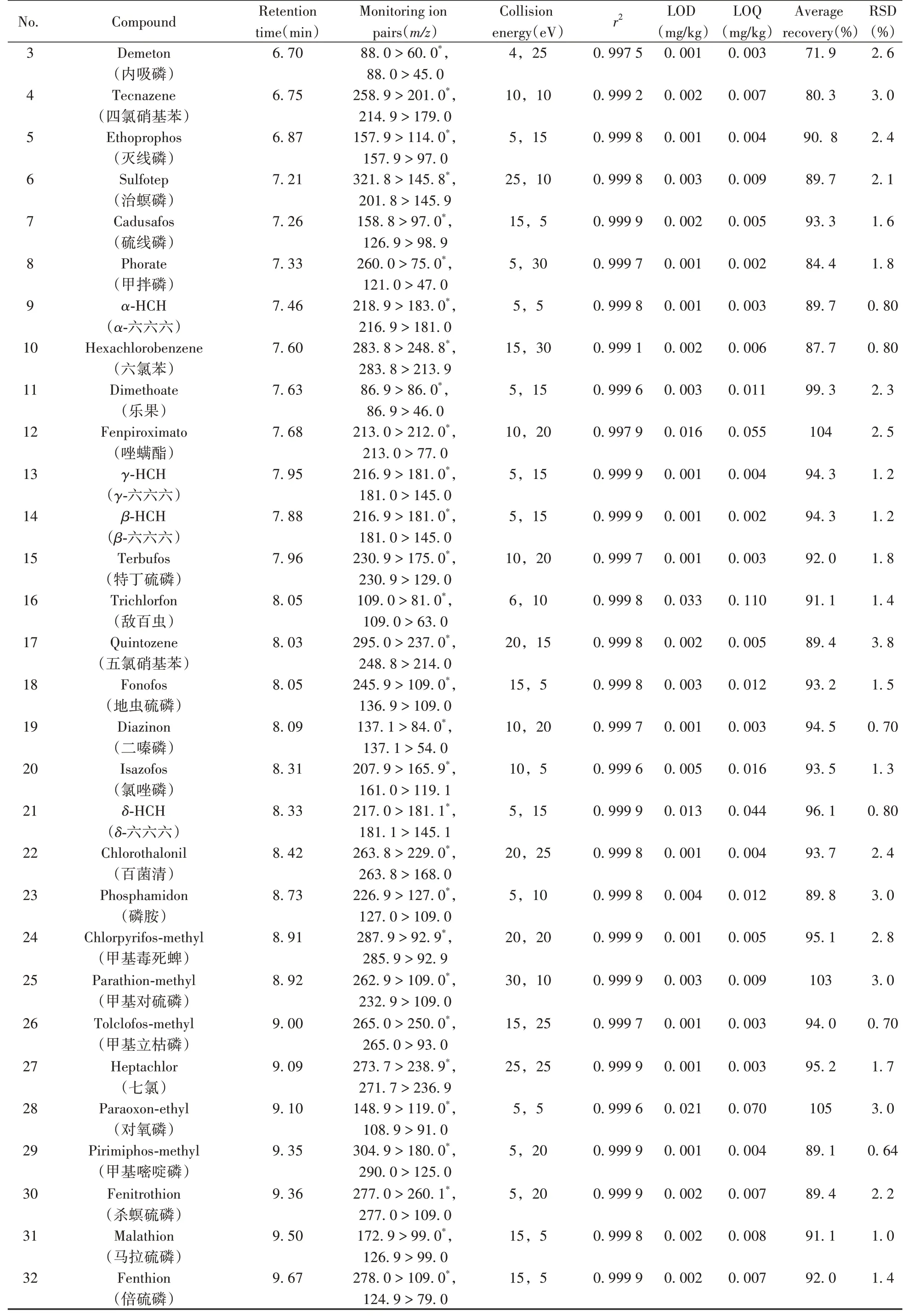
(续表1)
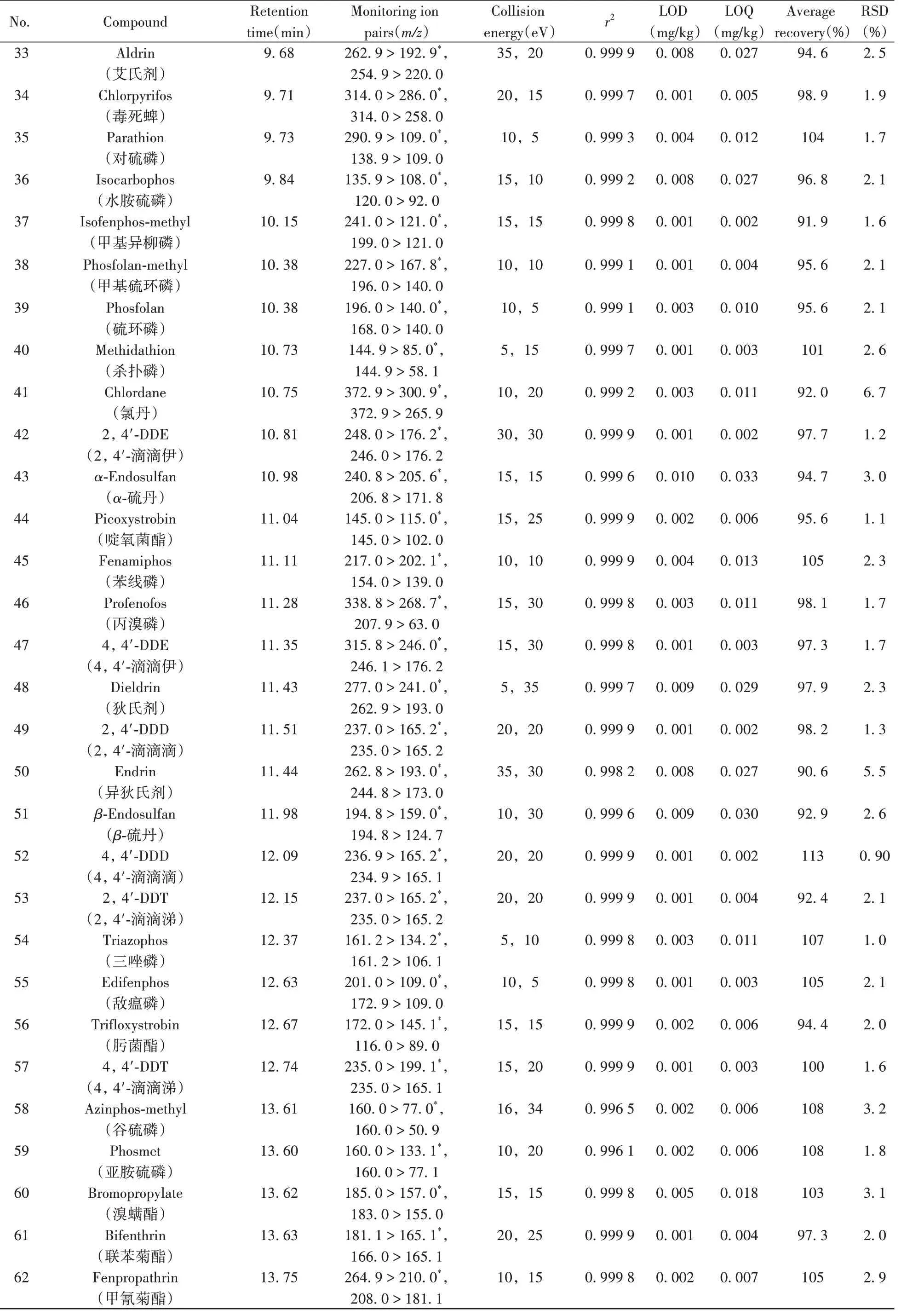
(续表1)
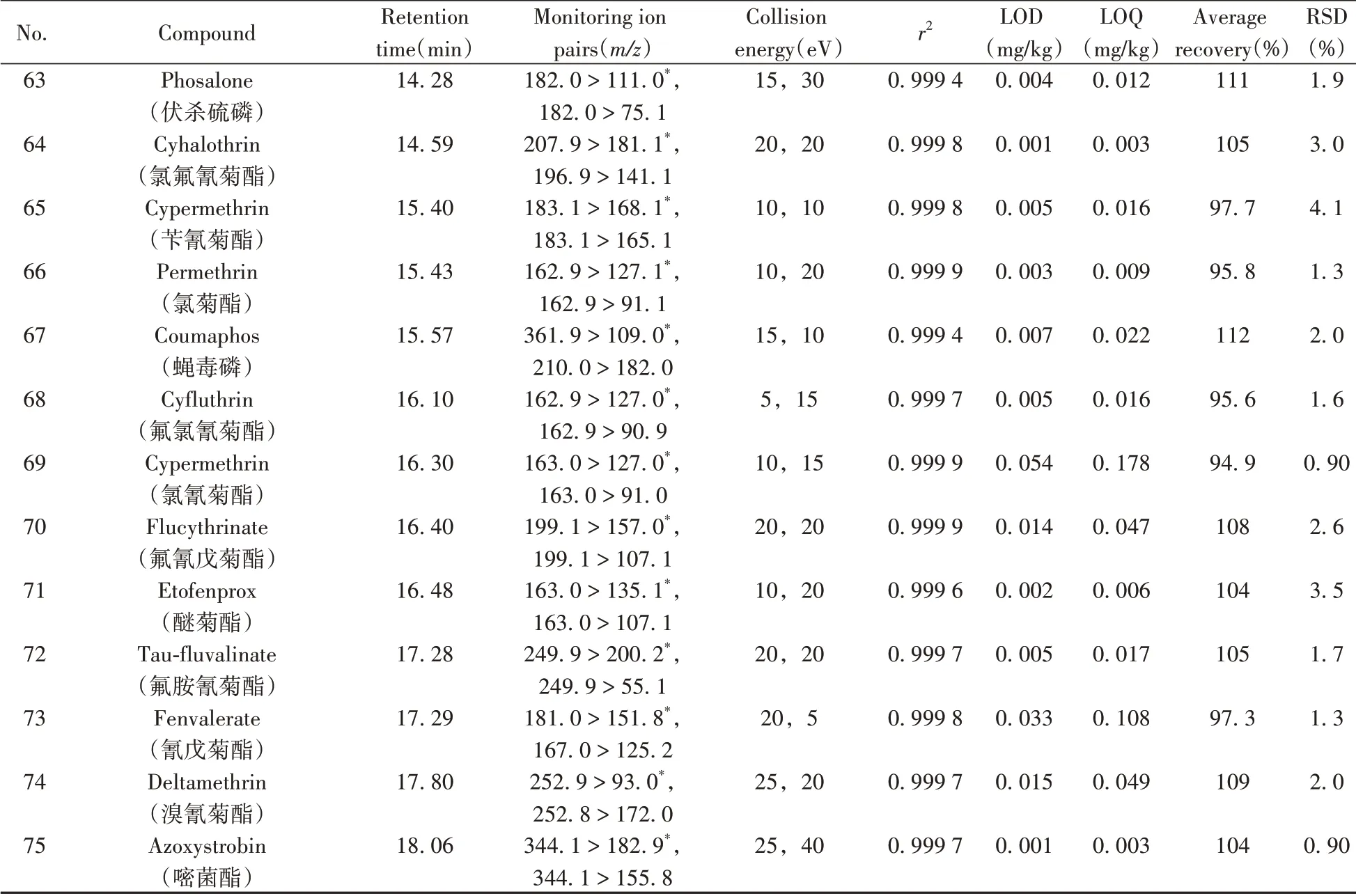
(续表1)
2.4 基质效应的考察
基质效应(ME)是基质匹配标准曲线斜率与溶剂标准曲线斜率之差,除以溶剂标准曲线斜率的比值。当ME 为正值时,呈现基质增强效应;反之则呈基质减弱效应。当ME 小于20%时,基质效应较弱,可忽略不计;ME 大于50%时,呈强基质效应;ME 在20%~50%范围,则为中等基质效应。考察了75种农药在党参中的基质效应(图5),结果表明,93%的农药为基质增强效应,7%的农药为基质减弱效应。其中57%的农药基质效应可忽略,19%的农药为中等基质效应,24%的农药为强基质效应。为弥补基质效应产生的差异,本实验采用基质匹配标准曲线法降低基质效应的影响。
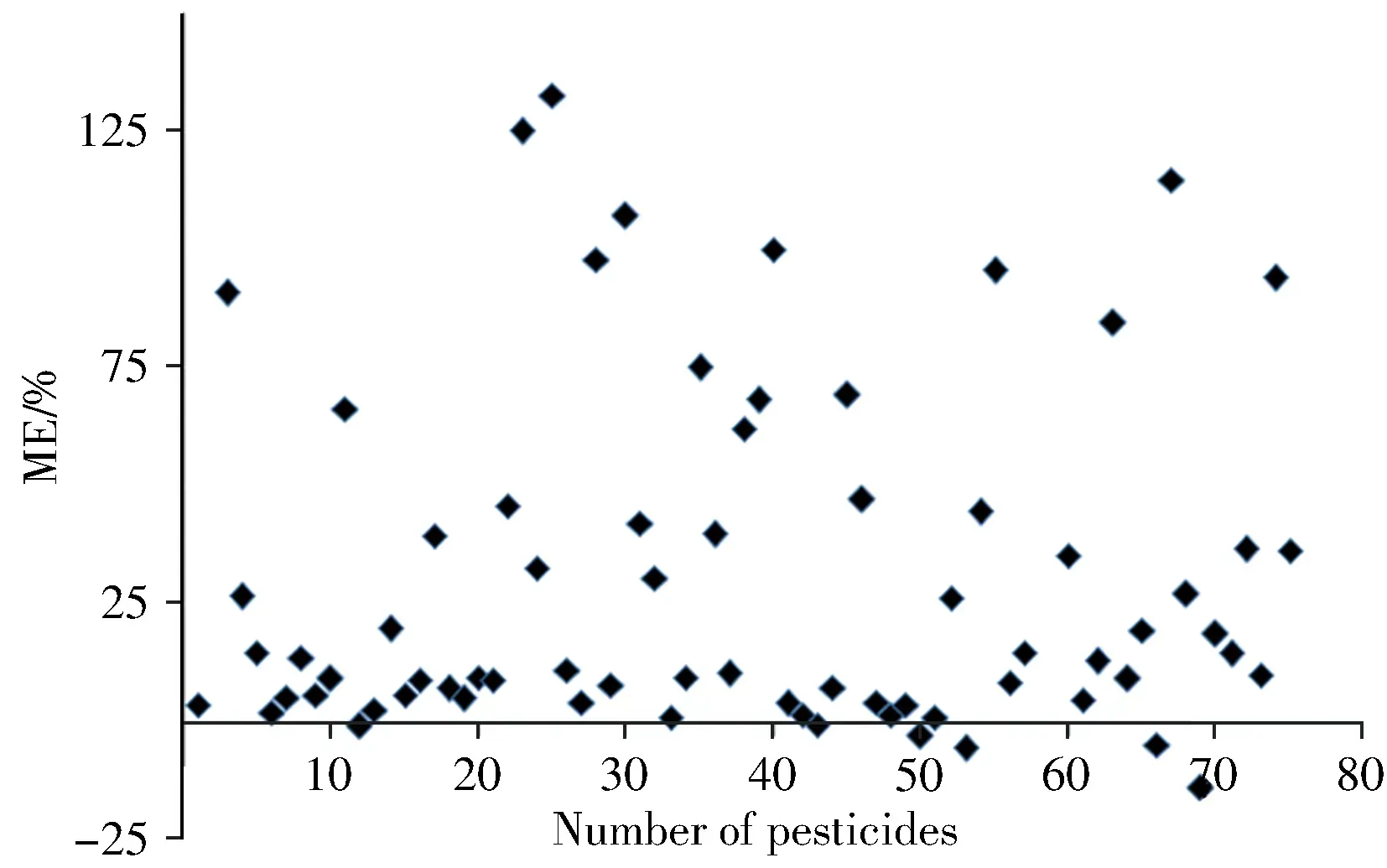
图5 75种农药在党参中的基质效应Fig.5 Matrix effects of 75 pesticides in codonopsis radix
2.5 实际样品检测
采用本方法检测购自中药市场、药店的30批党参样品,结果显示,在7批样品中共检出6种农药,其中1 批样品检出甲拌磷(0.563 mg/kg),1 批样品检出二嗪磷(0.112 mg/kg)和氯唑磷(0.120 mg/kg),1批样品检出四氯硝基苯(0.013 mg/kg)和五氯硝基苯(0.312 mg/kg),2批样品检出甲基异柳磷(含量分别为0.014、0.018 mg/kg),2 批样品检出氯唑磷(含量分别为0.511、1.68 mg/kg);其余样品均未检出。《中国药典》2020年版规定了33种农药的最大残留限量,其中甲拌磷、氯唑磷和甲基异柳磷的限量分别不得超过0.02 mg/kg、0.01 mg/kg和0.02 mg/kg,本文检出的甲拌磷、氯唑磷均超标;甲基异柳磷未超标;《中国药典》未规定其它3种农药的残留限量,故参照GB 2763-2021标准,其中四氯硝基苯参照马铃薯的限量为20 mg/kg,五氯硝基苯参照根茎类调味料的限量为2 mg/kg,二嗪磷参照白术(鲜)的限量为0.3 mg/kg,上述3种农药的残留量均未超标;二嗪磷若参照白术(干)的限量0.1 mg/kg,超标。
3 结 论
本文针对党参中农药多残留检测的前处理条件进行了深入研究,利用新型净化剂羟基多壁碳纳米管优化净化填料组合,提高了净化效果。将改进的前处理方法与GC-MS/MS联用构建了党参中农药多残留的高通量检测方法。该方法操作简单、准确灵敏且经济适用,为党参中农药多残留的快速筛查检测提供了可靠的分析手段。

