纳米纤维固相萃取/超高效液相色谱-串联质谱法检测牛奶中25种糖皮质激素
吴肖肖,蒋迪尧,梅秀明,康学军,李雨枫,张 驰*
(1.南京市产品质量监督检验院 国家市场监管重点实验室(生物毒素分析与评价),江苏 南京 210019;2.东南大学 生物科学与医学工程学院,江苏 南京 210096)
糖皮质激素(Glucocorticoids,GCs)为类固醇激素,是由肾上腺皮质分泌的一类甾体激素,具有抗炎、抗过敏、抗毒、抗休克等药理作用,同时能提高饲料的转化率、促进畜禽生长,因而在畜牧业生产中被广泛使用[1-3]。然而,过量的不合理使用会导致糖皮质激素类药物在动物体内残留,进而危害人体健康,引起肥胖、高血压等疾病[4-5]。因此,各国对动物源性食品中糖皮质激素的最大残留量进行了规定。如GB 31650-2019《食品中兽药最大残留限量》[6]和欧盟法规(EU)No.37/2010[7]均规定牛奶中倍他米松和地塞米松的最大残留量为0.3 μg/kg,氢化可的松仅作外用,未指定残留限量。
目前,同时测定多种糖皮质激素的方法主要有液相色谱-三重四极杆串联质谱法、液相色谱-四极杆/飞行时间质谱法、气相色谱-质谱法以及毛细管电泳法等[8-17]。高效液相色谱-质谱法因具有高灵敏度和高选择性,是痕量分析的常用方法,但其样品需净化以减少基质干扰,而传统的固相萃取前处理方法比较耗时费力[18]。
静电纺丝是一种在强电场作用下将聚合物溶液喷射拉伸得到直径为纳米级纤维的纺丝技术。静电纺丝纳米纤维具有直径小、比表面积大、孔隙率高、易于修饰等特点,基于纳米纤维的固相萃取技术具有操作简单、快速、有机溶剂用量少的优点[19-21]。本研究制备了聚苯乙烯(PS)纳米纤维,并对其形貌、特征基团、接触角、比表面积等参数进行表征,利用强疏水性PS纳米纤维对有环戊烷骈多氢菲结构的糖皮质激素的良好吸附性,通过纳米纤维固相萃取技术对样品提取液中的糖皮质激素进行富集与净化,基于超高效液相色谱-串联质谱(UPLC-MS/MS),建立了牛奶中泼尼松龙等25 种糖皮质激素的检测方法,并将该方法应用于市售牛奶样品检测。
1 实验部分
1.1 仪器与设备
Agilent 1290-6470 超高效液相色谱-三重四极杆质谱联用仪,配有电喷雾离子源(美国安捷伦科技有限公司);ML304T 分析天平(梅特勒-托利多仪器(上海)有限公司);Centrifuge 5430R 低温高速离心机(德国Eppendorf 公司);N-EVAP 112 氮吹仪(美国Organomation 公司);Milli-Q 超纯水系统(美国Millipore 公司);Vortex-Genie 2 涡旋振荡器(美国Scientific Industries 公司);DWP403-1AC 高压电源(天津东文高压电源厂);SU8010场发射扫描电子显微镜(日本株式会社日立制作所);JEOL JEM-00F高分辨透射电子显微镜(日本电子株式会社);Alpha 傅里叶红外光谱仪(德国布鲁克光谱仪器公司);CHD-JCJ180A-1接触角测量仪(东莞诚鼎仪器科技有限公司);ASAP 2460 全自动比表面与孔隙度分析仪(美国麦克默瑞提克仪器公司)。
1.2 试剂与材料
标准品:泼尼松龙、泼尼松、氢化可的松、甲基泼尼松龙、倍他米松、地塞米松、倍氯米松、曲安奈德、氟氢缩松、地塞米松醋酸酯和氢化可的松丁酸酯(100 mg/L,溶于甲醇);可的松(1 000 mg/L,溶于甲醇),氟米松(纯度≥99.8%),氟氢可的松醋酸酯、可的松醋酸酯、甲基泼尼松龙醋酸酯、倍他米松醋酸酯(纯度≥99.5%),购自上海安谱璀世标准技术服务有限公司;泼尼松龙醋酸酯(100 mg/L,溶于甲醇)、曲安西龙双醋酸酯(1 000 mg/L,溶于甲醇)、氢化可的松醋酸酯(纯度>99%),氟米龙醋酸酯(100 mg/L,溶于乙腈),购自德国Dr.Ehrenstorfer GmbH;地夫可特(纯度≥99%)、布地奈德(纯度≥98%),购自多伦多化学研究所;泼尼松醋酸酯(纯度≥98%,中国食品药品检定研究院);氟米龙(纯度≥98%,上海阿拉丁生化科技股份有限公司)。
乙腈、甲醇(LC-MS 级,纯度≥99.9%),购自上海安谱实验科技股份有限公司;甲酸、乙酸(HPLC级,纯度≥99.9%),购自上海阿拉丁生化科技股份有限公司;聚苯乙烯(18 500 Da),购自上海化学试剂研究院;四氢呋喃(THF)、N,N-二甲基甲酰胺(DMF)(分析纯,纯度≥99.59%),购自国药集团化学试剂北京有限公司。
不同品牌的牛奶实际样品随机购自南京市中、大型超市。
1.3 纳米纤维制备、表征及固相萃取柱的制备
1.3.1 纳米纤维制备将1 g PS溶于10 mL THF和DMF的混合溶剂(6∶4,体积比)中,在室温下搅拌16 h。将混合纺丝溶液装入玻璃注射器中(配不锈钢针头),用导线连接不锈钢针与高压电源正极,收集屏连接电源负极,距离不锈钢针20 cm处放置。在24 kV电压下,以2.0 mL/h速度推进溶液,喷出的纤维落于铝箔收集屏上,得到PS纳米纤维。
1.3.2 纳米纤维表征分别用场发射扫描电子显微镜、高分辨透射电子显微镜、傅里叶红外光谱仪、接触角测量仪和全自动比表面与孔隙度分析仪对PS 纳米纤维的形貌、特征峰、吸附性能等指标进行表征。
1.3.3 净化柱的制备与活化称取8 mg 纳米纤维,用实心金属圆柱体送至固相萃取柱下端,压紧制成固相萃取小柱。依次取200 μL甲醇和400 μL水流过柱内纤维,完成固相萃取柱的活化。
1.4 溶液配制
混合标准中间液:分别用甲醇将标准物质溶解或稀释配制成质量浓度为1 000 μg/L 的混合标准中间液,置于4 ℃冰箱中备用。
乙酸水-甲醇溶液:50%(体积分数)乙酸水溶液和甲醇以体积比2∶98混合而成。
1.5 样品处理
精确称取0.5 g 牛奶于10 mL 离心管中,加入5 mL 乙腈,涡旋5 min,以7 500 r/min 离心15 min,取上清液,氮气吹干。用1 mL 5%(体积分数)乙腈水溶液溶解,过0.22 μm 有机滤膜,过活化后的PS纳米纤维固相萃取柱,用100 μL 甲醇洗脱固相萃取柱,收集洗脱液,待质谱检测。样品处理流程见图1。

图1 样品处理流程图Fig.1 Flow chart of sample processing
1.6 色谱-质谱条件
1.6.1 色谱条件色谱柱:ACQUITY UPLC BEH C1(82.1 mm×100 mm,1.7 μm);流动相:0.1%(体积分数)甲酸水溶液(A)-乙腈(B);梯度洗脱程序:0 ~4.5 min,20%B;4.5 ~7 min,20%~45%B;7 ~9 min,45% ~52% B;9 ~10 min,52% ~55% B;10 ~12 min,55% ~65% B;12 ~14 min,65% ~90%B;14 ~15 min,90%B;后运行:2 min;进样量:2 μL;流速:0.3 mL/min;柱温:40 ℃。
1.6.2 质谱条件离子源:双喷射流电喷雾离子源(Dual AJF ESI),扫描模式:正离子模式,检测模式:多反应监测(MRM);雾化器压力:310 kPa;气体温度:350 ℃,气体流速:12 L/min;鞘气(N2)温度:250 ℃,鞘气(N2)流速:11 L/min;毛细管电压:3 500 V。25 种糖皮质激素的质谱参数见表1。

表1 25种糖皮质激素的质谱参数Table 1 Mass spectral parameters of 25 glucocorticoids
2 结果与讨论
2.1 纤维表征
2.1.1 纤维形貌与红外表征在扫描电子显微镜(SEM)和透射电子显微镜(TEM)下,PS 纳米纤维的SEM 图、TEM 图以及直径分布图见图2A-C。由图可知,PS纳米纤维表面光滑,无明显串珠,纤维的平均直径为(818.3±297.5)nm。
PS 纳米纤维的红外光谱图见图2D。根据特征峰[22]判断,纤维的主成分是PS,其中特征峰696、756 cm-1来自单取代苯环===== CH 面外变形,1 028 cm-1来自单取代苯环===== CH 面内变形,1 452、1 493、1 601 cm-1来自苯环—C===== C—弯曲振动,2 849 cm-1来自—CH2—对称伸缩振动,2 922 cm-1来自—CH2—不对称伸缩振动,3 001、3 025、3 064、3 084 cm-1来自===== CH—伸缩振动。

图2 PS纳米纤维的SEM图(A)、TEM图(B)、直径分布图(C)和红外光谱图(D)Fig.2 SEM(A),TEM(B),diameter distribution images(C)and infrared spectrum(D)of PS nanofibers
2.1.2 纤维接触角与比表面积采用接触角测量仪测得PS 纳米纤维的接触角为136.12°,表明PS 纳米纤维具有良好的疏水性,对具有环戊烷骈多氢菲结构的疏水性糖皮质激素有较好的吸附性。经测试,PS纳米纤维的比表面积为57.41 m2/g,孔体积为0.33 cm3/g,平均孔径为24.33 nm。根据国际纯粹与应用化学联合会(IUPAC)规定的孔尺寸定义,PS纳米纤维表面的孔为介孔(2 ~50 nm)。
2.2 色谱-质谱条件优化
为提高分析效率,在尽可能缩短保留时间的同时,需将25种糖皮质激素最大程度地分离,尤其是具有相同定性和定量离子对的倍他米松与地塞米松,以及倍他米松醋酸酯与地塞米松醋酸酯2 对同分异构体,必须以保留时间的差别加以区分。经过优化梯度洗脱程序、碰撞能等色谱-质谱条件,25种糖皮质激素以及2 对同分异构糖皮质激素均能通过色谱峰的保留时间或离子对质荷比的差异实现定性和定量,提取离子流色谱图见图3。
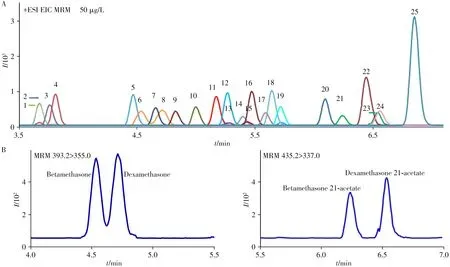
图3 25种糖皮质激素混合标准溶液(A)与2组同分异构糖皮质激素(B)的提取离子流色谱图Fig.3 Extracted ion chromatograms(EIC)of 25 glucocorticoids mixed standard solution(A)and two pairs of isomeric glucocorticoids(B)the numbers marked in the EIC represent the same analytes as those in Table 1
2.3 萃取条件优化
纳米纤维固相萃取技术的原理是通过纤维和目标物之间的相互作用力实现吸附,再将吸附在纤维上的目标物解离。因此,纤维对目标物的作用力既要能实现吸附,又不能有太强的吸附,否则难以洗脱。由纤维表征结果可知,PS纳米纤维的疏水性强,通过π-π键共轭作用可实现对有环戊烷骈多氢菲结构的糖皮质激素的吸附。将5%乙腈水溶液稀释配制的25种糖皮质激素混合标准溶液(20 μg/L)过活化后的PS纳米纤维柱,按照公式(1-残留在柱后溶液中目标物的质谱响应/标准溶液的质谱响应)×100%计算吸附效率,结果显示25种糖皮质激素的吸附效率均大于95%。分别采用甲醇、乙酸水-甲醇溶液对吸附在纤维上的目标物进行洗脱,通过洗脱液与相同浓度的标准溶液质谱响应比值计算得到目标物的提取效率,结果见图4。由图可知,虽然泼尼松、泼尼松龙等6个糖皮质激素的提取效率在酸性条件下略高于甲醇,但可的松醋酸酯、氟氢可的松醋酸酯等目标物在酸性条件下的提取效率极低,无法满足检测要求。而甲醇洗脱时,25种目标物的提取效率为83.6%~109%,可满足检测要求。因此,选择甲醇作为洗脱溶剂。

图4 不同洗脱溶剂对25种糖皮质激素提取效率的影响(n=3)Fig.4 Effect of different elution solvents on extraction efficiency of 25 glucocorticoids(n=3)
2.4 基质效应考察
为考察牛奶样品中25 种糖皮质激素的基质效应(ME),将空白牛奶样品按照“1.5”方法进行处理,得到空白样品基质。采用空白样品基质和甲醇分别配制1 ~100 μg/L 系列质量浓度的混合标准溶液,按照“1.6”条件进行检测,以基质标准曲线和溶剂标准曲线的斜率百分比(SR)评价基质效应。SR越接近100%,表明基质效应越小;SR <100%,表明存在基质抑制效应;SR >100%,表明存在基质增强效应。结果显示,25 种糖皮质激素的SR 在94.4%~104%范围内,表明采用聚苯乙烯纳米纤维固相萃取柱对牛奶样品提取液进行萃取处理,达到了较好的基质净化作用。
2.5 方法学验证
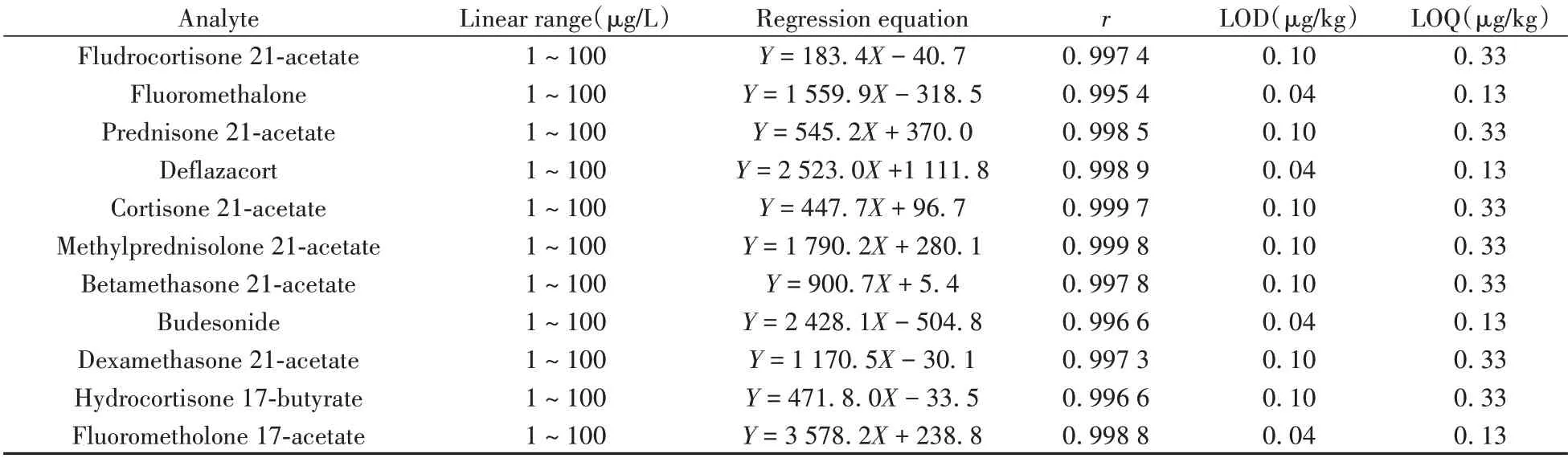
2.5.1 线性关系、检出限与定量下限准确移取适量的25种糖皮质激素混合标准溶液,用5%乙腈水溶液配成质量浓度分别为1、2、5、10、20、50、100 μg/L的系列标准溶液,采用本方法处理后进行检测。采用外标法定量,以目标物的质量浓度为横坐标(X,μg/L),相应峰面积(Y)为纵坐标,绘制标准曲线。结果表明,25 种糖皮质激素在1 ~100 μg/L 范围内呈良好的线性关系,相关系数(r)均大于0.995。采用标准添加法,在空白牛奶样品中添加标准溶液,加标浓度逐级递减,按本方法处理后进行检测,计算检出限(LOD,S/N≥3)和定量下限(LOQ,S/N≥10)。结果显示,25 种糖皮质激素的LOD为0.04 ~0.10 μg/kg,LOQ为0.13 ~0.33 μg/kg(见表2)。

表2 25种糖皮质激素的线性范围、线性方程、相关系数、检出限与定量下限Table 2 Linear ranges,linear equations,correlation coefficients,LODs and LOQs of 25 glucocorticoids
(续表2)
2.5.2 回收率与相对标准偏差为进一步验证方法的准确性,在空白牛奶样品中添加混合标准溶液使待测物含量分别为0.5、5.0、20.0 μg/kg,每个加标水平平行制备6份样品,采用本方法处理后上机测定。根据溶剂标准曲线计算回收率和相对标准偏差(RSD),结果表明,25 种糖皮质激素的回收率为71.5%~105%,RSD为1.8%~10%(见表3)。
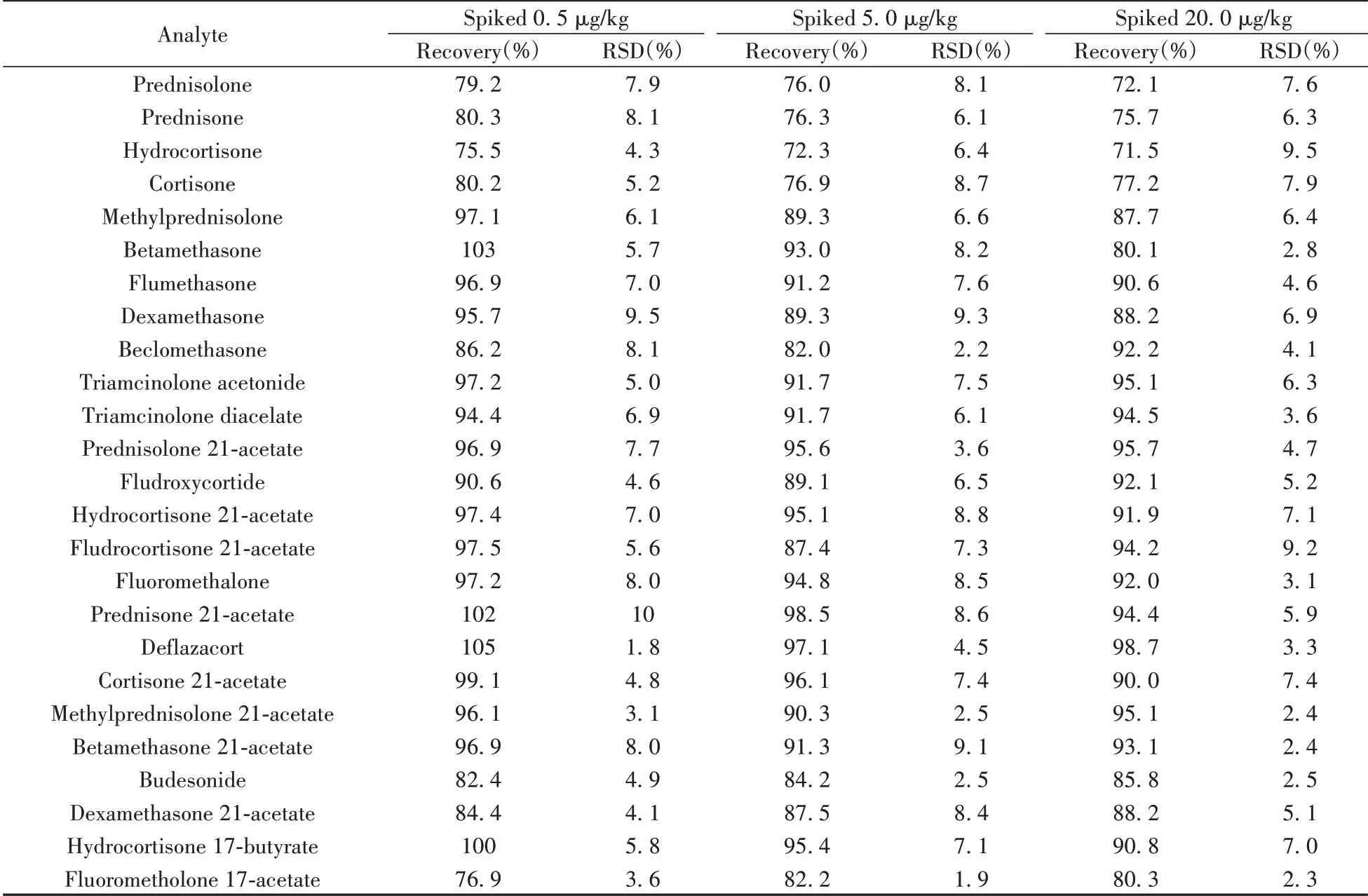
表3 25 种糖皮质激素的回收率及相对标准偏差(n=6)Table 3 Recoveries and RSDs of 25 glucocorticoids(n=6)
2.6 实际样品测定
应用本方法检测市售10 批次牛奶样品中25 种糖皮质激素的含量,仅在1 批次样品中发现微量的氢化可的松(图5),含量为0.35 μg/kg,国标中未指定其残留限量。其余样品均未检出25 种糖皮质激素残留。

图5 阳性样品的提取离子色谱图Fig.5 EIC of the positive milk sample
3 结 论
本研究采用纳米纤维固相萃取法进行前处理,以聚苯乙烯纳米纤维固相萃取柱进行富集、净化,基于UPLC-MS/MS 技术建立了牛奶中25 种糖皮质激素的检测方法。该方法具有前处理操作简单,有机溶剂用量少,基质效应不显著,准确性好,灵敏度高等优点,适用于牛奶中糖皮质激素残留的检测。

