STAT3/IL-21通路介导长链非编码RNA H19参与大鼠重症急性胰腺炎相关性肠损伤
叶 媛, 索质君, 薛 芳
胰腺炎是由多种炎症因子释放引起的胰腺炎症性疾病,其发病率存在一定地区差异,为(4.9~73.4)/10万,5%~10%患者伴有持续的器官功能障碍,进展为重症急性胰腺炎(severe acute pancreatitis,SAP)[1]。对6970例器官功能障碍患者的系统评价和荟萃分析中,并发无菌性坏死病死率为19.8%,而并发感染性坏死病死率高达35.2%[2]。SAP早期常合并肺损伤、肠道损伤等单器官或多器官并发症。肠道损伤早期表现为肠黏膜萎缩、肠道通透性增加,造成内毒素和细菌移位、肠屏障功能障碍和继发感染,炎症介质大量释放,导致病死率升高。肠道损伤致肠屏障功能障碍与胰腺炎严重程度密切相关[3-4]。
长链非编码RNA(long non-coding RNA,LncRNA)为非蛋白质编码RNA。有证据[5]表明,LncRNA参与基因表达调控和各种生物过程。其中,LncRNA H19可以通过转录激活因子3(STAT3)信号通路促进上皮-间质转化[6],参与各种炎症性疾病的发展。多种LncRNA通过直接或间接地影响肠上皮细胞旁通透性、肠上皮细胞增殖和凋亡,以调节肠屏障功能。已有研究[7]表明,STAT3信号通路参与SAP肺损伤的发生发展,白细胞中STAT3表达高低是胰腺炎严重程度的潜在预测因子,与疾病严重程度有关[8]。此通路是否参与SAP导致的肠屏障功能障碍的发病过程,仍需进一步研究。
为确定H19及STAT3/IL-21信号通路是否参与SAP相关的肠道损伤的发生发展,本研究建立SAP大鼠模型,使用 STAT3 抑制剂进行干预,检测血清中白细胞介素-21(interleukin-21, IL-21)及淀粉酶的表达,并评估了肠道组织中肠屏障功能相关基因的表达,探讨SAP相关性肠屏障功能障碍可能的发病机制。
1 材料与方法
1.1实验动物 健康SPF级雄性SD大鼠,6~7周龄,体质量220~260 g,由辽宁长生生物技术有限公司提供,动物许可证号:SCXK(辽)2020-0001,合格证号:210726200100529986。研究样本采集均经过广东省医学实验动物中心实验动物伦理委员会批准(编号:C202202-6)。
1.2主要试剂及仪器 主要试剂:牛磺胆酸钠(阿拉丁);STAT3抑制剂(STAT3-IN-1)(MCE);大鼠血清淀粉酶酶联免疫吸附测定试剂盒(伊莱瑞特);大鼠IL-21酶联免疫吸附法(ELASA)测定试剂盒(伊莱瑞特);Trizol试剂(Ambion);引物由擎科生物合成。主要仪器:微型高速离心机(美国Labnet公司);FlexStation 3多功能酶标仪(美国Molecular Devices公司);实时荧光定量PCR仪(美国ABI公司);PCR仪(北京东胜创新生物科技有限公司)。
1.3模型建立及实验方法
1.3.1 大鼠SAP模型建立 大鼠适应性饲养7 d无异常后,随机选择45只大鼠分为对照组、SAP组和STAT3抑制组,每组15只。各组大鼠禁食16 h后,进行造模:用10%水合氯醛按330 L/100 g对大鼠进行麻醉,上腹部正中开口,找到十二指肠后,在十二指肠与胰腺之间找到胰管,用镊子挑起后缓慢注射5%牛黄胆酸钠,剂量0.1 mL/100 g,注射完成后归位肠管,逐层缝合关腹,对照组注射等量生理盐水。STAT3抑制组大鼠造模后腹腔注射STAT3抑制剂(STAT3-IN-1),剂量10 mg/kg,其余两组注射等体积0.5%DMSO。
1.3.2 标本采集 造模后24 h,以10%水合氯醛麻醉大鼠,心脏取血,静置30 min后,3000 r/min离心10 min,收集上清液放置于-80 ℃冰箱冻存用于进行后续生化检测。取近盲肠部回肠,用于组织mRNA提取,放置-80 ℃冰箱冻存。
1.3.3 ELISA法检测大鼠血清中淀粉酶及IL-21水平 大鼠血液样本3000 r/min离心10 min,收集上清后,按ELISA试剂盒说明书步骤操作,用酶标仪在450 nm波长测量各孔的光密度(OD值)。绘制ELISA标准曲线,计算大鼠血清中淀粉酶及IL-21水平。
1.3.4 RT-PCR法检测大鼠血清中H19、STAT3以及肠道组织中咬合蛋白(Occludin)、带状闭合蛋白-1(ZO-1)、闭合蛋白(Claudins)-1、Claudin-2 mRNA表达水平 Trizol法提取样本RNA,按照两步法逆转录合成cDNA,qPCR法扩增目的基因和内参基因。qPCR反应条件:95 ℃ 60 s,95 ℃ 10 s,60 ℃ 40 s,共40个循环。目的基因引物序列根据NCBI数据库设计获得(见表1),由擎科生物公司合成。采用QPCR算法(2-ΔΔCt法)计算各目的基因mRNA表达水平。

表1 各基因引物序列表
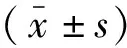
2 结果
2.1大鼠血清中淀粉酶与IL-21表达 采用5%牛磺胆酸钠经胰胆管逆行注射诱发SAP,该造模方法已广泛应用于研究胰腺炎的各种演变事件。与对照组比较,两个实验组大鼠血清淀粉酶水平均显著升高,差异有统计学意义,提示实验组大鼠造模成功。与对照组比较,SAP组及STAT3抑制组大鼠血清中IL-21水平明显升高(P<0.01);STAT3抑制组IL-21水平较SAP组下降(P<0.01)。见表2。
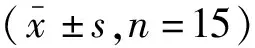
表2 各组间血清中淀粉酶和IL-21表达比较
2.2大鼠血清中H19、STAT3 mRNA表达 与对照组比较,两个实验组大鼠血清中H19、STAT3基因mRNA表达明显升高(P<0.01);STAT3抑制组H19、STAT3基因mRNA表达较SAP组明显降低(P<0.01)。见表3。
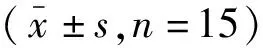
表3 各组间血清中H19、STAT3 mRNA表达比较
2.3大鼠肠道组织中ZO-1、Occludin、Claudins-1、Claudin-2表达 与对照组比较,两个实验组大鼠肠道组织中ZO-1、Occludin、Claudins-1基因mRNA表达水平明显降低,而Claudin-2基因表达明显升高(P<0.01)。STAT3抑制组ZO-1、Occludin、Claudins-1基因mRNA表达均呈下降趋势,Claudin-2基因表达明显升高(P<0.01),且三组间差异均存在统计学意义。见表4。
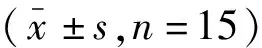
表4 各组间肠道组织中ZO-1、Occludin、Claudins-1、Claudin-2表达水平
3 讨论
SAP是一种高发病率、高入院率和高病死率的消化系统疾病。SAP患者体内炎症因子大量释放,引起肠黏膜严重氧化应激和caspase-3活化,导致肠黏膜细胞凋亡,严重影响肠屏障功能[9]。在大鼠SAP早期,肠道免疫抑制导致细菌和内毒素移位,免疫屏障受损,进一步加重肠屏障功能障碍[10]。肠黏膜损伤是 SAP 进展的关键部分[11],是多器官衰竭的始发事件。
肠黏膜机械屏障的最主要组成部分是紧密连接(tight junction,TJ),广泛分布于相邻肠上皮细胞间,由多种跨膜蛋白(包括ZO、Occludin、Claudins)组成。许多疾病通过破坏TJ蛋白,导致肠黏膜上皮屏障功能障碍。为了进一步证实 SAP 发病期间肠屏障功能的变化,我们测定了跨膜蛋白表达水平,实验显示,与对照组比较,两个实验组大鼠肠道组织中ZO-1、Occludin、Claudins-1基因mRNA表达明显降低,Claudin-2基因表达明显升高,而STAT3抑制组较SAP组改善,表明当大鼠发生SAP时肠屏障功能受损,而STAT3表达被抑制后肠屏障功能障碍有所减轻,提示STAT3信号通路可能参与SAP的发生发展。
SAP肠屏障功能障碍发生时,出现免疫失衡[12]。免疫平衡状态受多种细胞因子调节,STAT3和IL-21在其中发挥重要作用。RNA序列分析显示, STAT3对IL-21介导的基因调控至关重要,STAT3可直接与IL-21启动子结合,促进IL-21基因的表达。有研究[13]表明,与中度急性胰腺炎(MAP)患者比较,SAP患者血浆中IL-21水平明显升高,证明IL-21参与SAP“二次打击”免疫失衡过程。也有文献[14]提示,使用STAT3抑制剂导致Th17相关信号传导的抑制,IL-21水平明显降低,本实验结果也证实这一点。SAP组大鼠IL-21水平较试验组明显升高,而STAT3抑制组大鼠IL-21水平较SAP组有所下降。于是我们推测,SAP免疫抑制受STAT3/IL-21调节,并导致肠屏障功能障碍。
然而,SAP 中 STAT3/IL-21信号通路参与全身炎症反应的机制尚不清楚。众所周知,STAT3是一种转录因子,转录因子可以调节LncRNAs的转录活性。SAP 中STAT3/IL-21通路是否可介导LncRNAs表达变化,进而减轻胰腺炎相关肠道损伤导致的炎症瀑布仍需进一步研究和探讨。查阅文献[15]发现,LncRNA H19在维持肠屏障功能稳定中起着至关重要的作用。H19是位于人类染色体11p15.5上的印迹基因,其功能性产物是2.3 kb的保守LncRNA,主要在胚胎中表达,在出生时表达量下调,在肿瘤中明显表达。H19与肠屏障功能相关研究主要集中在炎症性肠病及肿瘤方面。研究[16]表明,H19可以调节肠易激综合征患者肠道屏障中AQP1和AQP3的表达,进而影响肠道屏障功能。H19过表达增加miR-675p丰度,降低ZO-1和E-cad mRNA水平,从而破坏上皮屏障的完整性[17]。急性肠缺血时,H19作为通过海绵miR-874调节AQP3表达的ceRNA起作用,改变肿瘤坏死因子-α(TNF-α)和TJ蛋白的水平,促进细胞旁通透性,影响肠屏障功能[18]。
本研究认为,在肠功能障碍发生发展过程中,H19扮演极其重要的角色,我们推测,STAT3/IL-21信号途径介导H19上调参与SAP肠屏障功能障碍的发生发展过程。本实验中,使用STAT3抑制剂干预后,H19基因的mRNA表达明显降低,肠屏障功能相关基因的表达明显降低。下一步将进行体外细胞实验,验证H19与STAT3/IL-21信号通路之间的相关作用机制。
综上所述,STAT3/IL-21通路介导LncRNA H19上调,进而下调ZO-1、Occludin、Claudins-1基因mRNA表达,增加Claudins-2基因mRNA表达,进而导致SAP大鼠肠屏障功能障碍加重。因此,STAT3/IL-21/H19通路可能作为SAP患者的潜在治疗靶点。

