基于人工智能的无创血流储备分数(CT-FFR)的临床应用
陈玉环, 尹游兵, 侯江涛, 夏军, 张贺晔
(1.科亚医疗科技股份有限公司, 广东 深圳 518116; 2.香港中文大学 医学院 內科及治疗学科,香港 999077; 3. 深圳大学 第一附属医院∥深圳市第二人民医院 放射科, 广东 深圳 518035; 4.中山大学 生物医学工程学院, 广东 广州 510330)
冠心病是当今威胁人类健康的最主要的心血管疾病,其主要病理生理机制为冠状动脉粥样硬化狭窄或阻塞所致的心肌缺血或坏死,进而可引发一系列临床病症,包括心绞痛、心肌梗死、心力衰竭、心律失常和猝死等[1]。目前临床上诊断冠心病最常用的解剖学评估方法是有创的冠状动脉造影(invasive coronary angiography, ICA)和无创冠状动脉CT血管造影(coronary computed tomographic angiography, CCTA)检查[2]。在有创ICA中,使用压力导丝测定血流储备分数值(fractional flow reserve, FFR)是目前诊断冠心病狭窄生理学评估的“金标准”,但由于FFR的侵入性、费用高昂以及病人可能因扩血管药物使用引起不适等,使得其在常规临床诊断中受限[3]。CCTA无创评价冠状动脉狭窄程度较高的准确性,但缺乏病变血流动力学信息。
通过CCTA获得的无创血流储备分数(CT derived fractional flow reserve, CT-FFR)是近年来血管成像领域的新技术,已成为冠状动脉病变无创功能学评价的一种有效方法[4],主要包括基于计算流体力学(computational fluid dynamics, CFD)[5]的 CT-FFR和基于深度学习(deep-learning)[6]的 CT-FFR。但基于CFD计算的CT-FFR需要利用复杂的流体仿真来模拟血液在血管中的流动情况,其最主要的缺陷是计算量很大,很难做到实时检测[5]。最近,随着人工智能技术发展,采用基于大量数据的深度学习方法,让模型全面学习所有病例解剖学与功能学关系,从而使快速智能评估血流动力学功能成为可能[6-7]。
但是,对于基于人工智能的无创CT-FFR在目前临床实践过程中,由于其提供了全冠状动脉树每一点的FFR值,这其中包含了狭窄血管和非狭窄血管的测量值,同时存在多种因素可能会影响FFR结果。因此,如何正确理解和合理应用CT-FFR结果来辅助和指导临床决策十分重要。本文将简要阐述有创FFR与基于人工智能的无创CT-FFR的原理、无创CT-FFR的临床应用流程等。
1 冠状动脉血流储备分数的意义
FFR作为评估冠状动脉血流的功能学和生理学指标,是目前评估心肌病变特异性缺血的“金标准”[8],其意义是获知在冠状动脉存在狭窄病变时,该血管所供心肌区域获得的血流量与该区域理论上正常情况下所能获得的最大血流量之比,即心肌最大充血状态下的狭窄远端冠状动脉内平均压(Pd)与冠状动脉开口部主动脉平均压(Pa)的比值,FFR理论上的正常值为1。
多项研究表明,尚不能确定解剖学狭窄程度和病变特性是否与心肌缺血之间存在可靠的关系[9-10],造影检测到的冠状动脉狭窄病变并不都会导致压力的下降,同时,也有相当一部分轻度狭窄会导致心肌缺血。在一项纳入1 300多例冠状动脉病变的研究中[11],有65%中度狭窄(狭窄程度50%~70%)和20%重度狭窄(狭窄程度71%~90%)并不导致血流动力学意义的血流改变,即这部分狭窄不会导致心肌功能缺血。而在另一项研究中[12]显示,在冠状动脉狭窄程度0%~30%和31%~50%中分别有13%和33%的患者FFR≤0.80,提示这部分患者即使冠状动脉轻度狭窄也存在心肌缺血。DEFER[13]研究对单支病变患者进行评估,随访15年的数据证实对FFR>0.75的病人延迟干预治疗是安全的。FAME I研究[11]和FAME Ⅱ研究[14]主要针对冠状动脉多支病变患者进行研究,发现FFR指导的血运重建策略在减轻症状、改善临床结果和降低花费上都优于通过造影指导的策略。FAME I研究[11]结果说明了对FFR>0.80的病变延迟血运重建可以明显降低主要不良心血管事件(major adverse cardiovascular events,MACE) 事件,根据FFR值可以判定哪些病变不会从经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)中获益。FAME Ⅱ研究[14]发现对FFR≤0.80的病变进行PCI干预可以降低急诊血运重建率,FFR值能协助判断可以从PCI获益的病变。
不同位置的血管狭窄可能会对FFR临床意义的判定造成影响。例如左前降支(left anterior descending, LAD)近段70%狭窄,FFR=0.78的病变,其预后与LAD远端FFR=0.78的病变是不同的[15]。这是由于LAD近段病变会导致更大面积的心肌发生缺血风险。因此,解剖学和功能学的评估对于冠状动脉病变的评估都非常重要,对于CCTA和CT-FFR分析结果的解释如下:临床医生需要着重考虑狭窄病变是否会引起跨狭窄压力阶差,是否造成病变特异性(lesion-specific)的缺血,病变是否达到了需要进行PCI 或者冠状动脉旁路移植术(coronary artery bypass graft, CABG)的血运重建程度。
2 无创CT-FFR技术原理
通过CCTA获得的无创血流储备分数(CT-FFR)[4]是近年来血管成像领域的新技术,主要包括基于CFD的 CT-FFR和基于深度学习的 CT-FFR。CT-FFR已成为冠状动脉病变无创功能学评价的一种有效方法,该技术不需要额外应用腺苷等药物,也无须使用FFR压力导丝进行有创介入操作,可以在不增加射线量的前提下提供无创“一站式”的解剖和功能评价。
2.1 基于CFD的CT-FFR
基于CFD的无创FFR计算技术是以在静息心率状态下采集的冠状动脉CT数据为基础,采用计算流体力学的方法模拟冠状动脉内血流与压力。其分析过程包括图像分割和冠状动脉树提取,模拟微循环阻力以及通过求解Navier-Stokes方程,来获取冠状动脉树内的血流压力,从而可计算出冠脉树上各个位置FFR值。但是基于CFD的CT-FFR主要存在以下缺点[5,16-17](1)计算量巨大,且对计算机硬件有很高的要求,检测成本高,很难做到实时检测;(2)在算法模型方面,计算方法需对流体力学方程进行求解,其中大量参数需要专家根据经验预先设定,通常一组参数无法适应海量数据的多样性;(3)其数据输入为单一独立的病例,算法模型本身无法考虑不同病例之间的联系,其预测准确率也不会因为数据量的增加而提高。以上不足导致基于CFD的CT-FFR计算模式只适用于类型较单一的小型数据集,较难应用在海量多变的数据集上。因此,基于CFD原理的CT-FFR很难满足我国医院的实际临床应用需求。
2.2 基于深度学习算法的CT-FFR
深度学习是人工智能研究中的一个新领域,着重于建立和模拟人脑对大量数据进行分析和学习的过程。作为一种数据驱动型模型,深度学习的关键在于建立可以模拟人脑进行分析学习的神经网络,模仿人脑的机制来自动挖掘分析大量数据中各个层次的抽象特征,通过算法使得机器能从大量数据中学习规律,从而对新的样本进行智能识别或预测[18]。与基于CFD原理的CT-FFR相比, 基于模仿大脑神经网络行为进行分布式并行信息处理的深度学习算法模型的CT-FFR,使得提高检测精度,缩短检测时间以及减少检测成本成为可能。
目前已经商业化应用的基于深度学习的CT-FFR(DEEPVESSEL FFR, Keya Medical,中国北京)基本原理是:通过直接学习血管的解剖学结构及血流功能,提取关键的特征参数,获得经过验证的训练模型,并应用到新的测量数据上,在保证准确性的同时能够快速得到整个血管树的FFR计算结果[7,19]。该深度学习模型采用其自主开发的树形网络递归神经网络算法,该算法充分融合了多层神经网络和递归神经网络的优势,前者学习血管路径上各点的影像特征、结构特征和功能特征,并映射到同一个向量中,即局部特征向量;而后者综合血管路径上各点的局部特征向量,利用血管所提供的序列信息对整个血管树进行全局化考虑来获取准确的血流特征(如FFR等),因此该方法优点是充分考虑了局部和全局关系。该深度学习模型能够精确快速的预测整条血管路径上的各点的FFR,极大提高计算效率。
已有多项研究[7,20-21]证实了DEEPVESSEL FFR对心脏功能性缺血评价的准确性和可靠性,同时这种无创的CT-FFR还可以改善临床决策、患者预后及减少医疗费用。DEEPVESSEL FFR的算法流程如图1所示,核心部分基于深度学习神经网络的FFR计算模块,具体流程如图1所示。
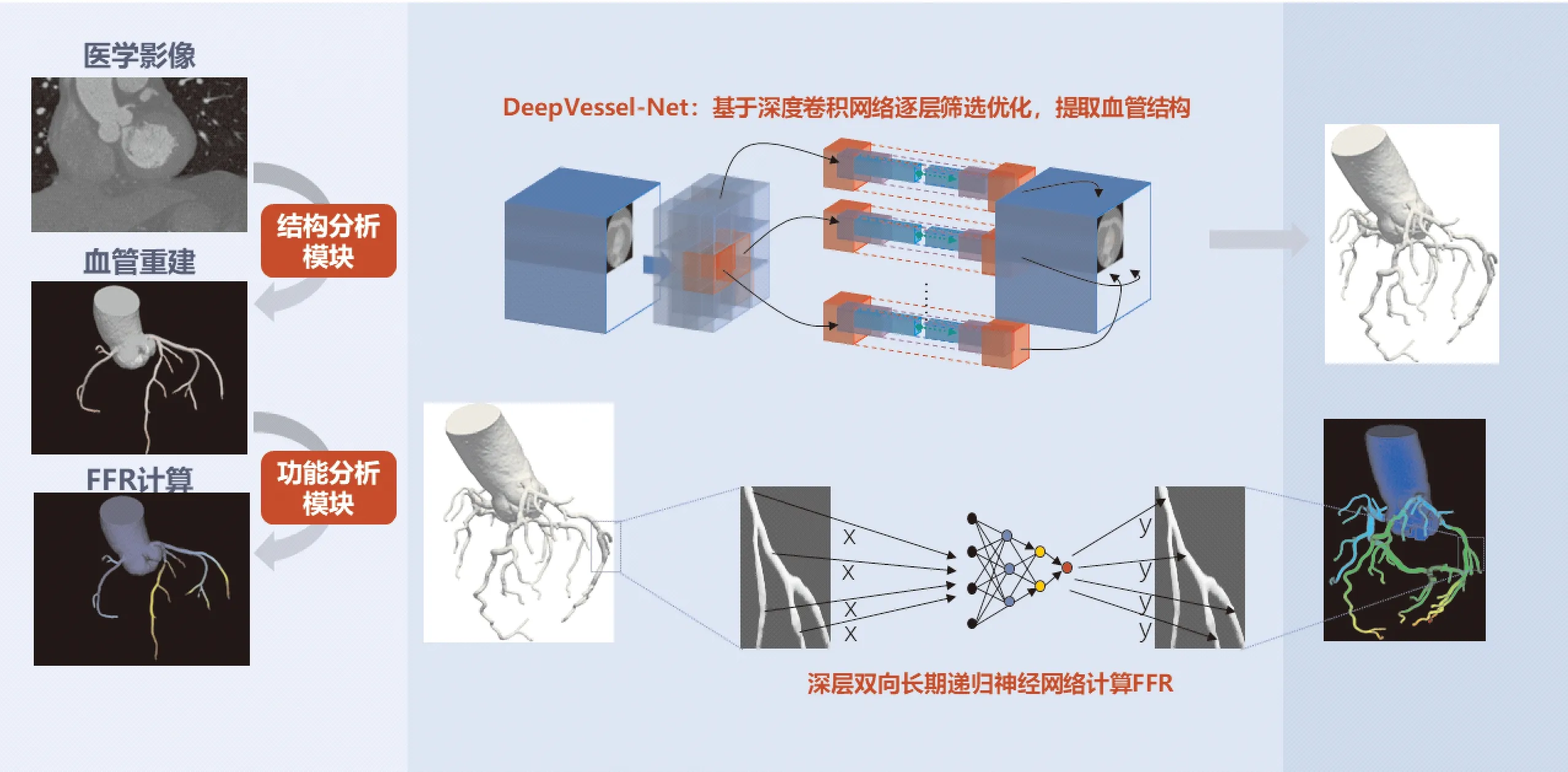
①在结构分析模块中,应用基于深度卷积网络逐层筛选优化进行分割,实现精确3D管腔重建;②在功能分析模块中,应用深层双向长期递归神经网络计算FFR。
3 无创CT-FFR测量及其结果解读
3.1 CT-FFR阈值的确定
在多项研究中,冠状动脉狭窄功能学意义的CT-FFR阈值均在0.75~0.80范围[11,14,22]。CT-FFR≤0.75通常提示可能会诱发心肌缺血,而CT-FFR>0.80一般不会导致心肌缺血,0.76~0.80之间的CT-FFR为“灰区”[20,23]。
3.2 冠状动脉血管树上的压力衰减
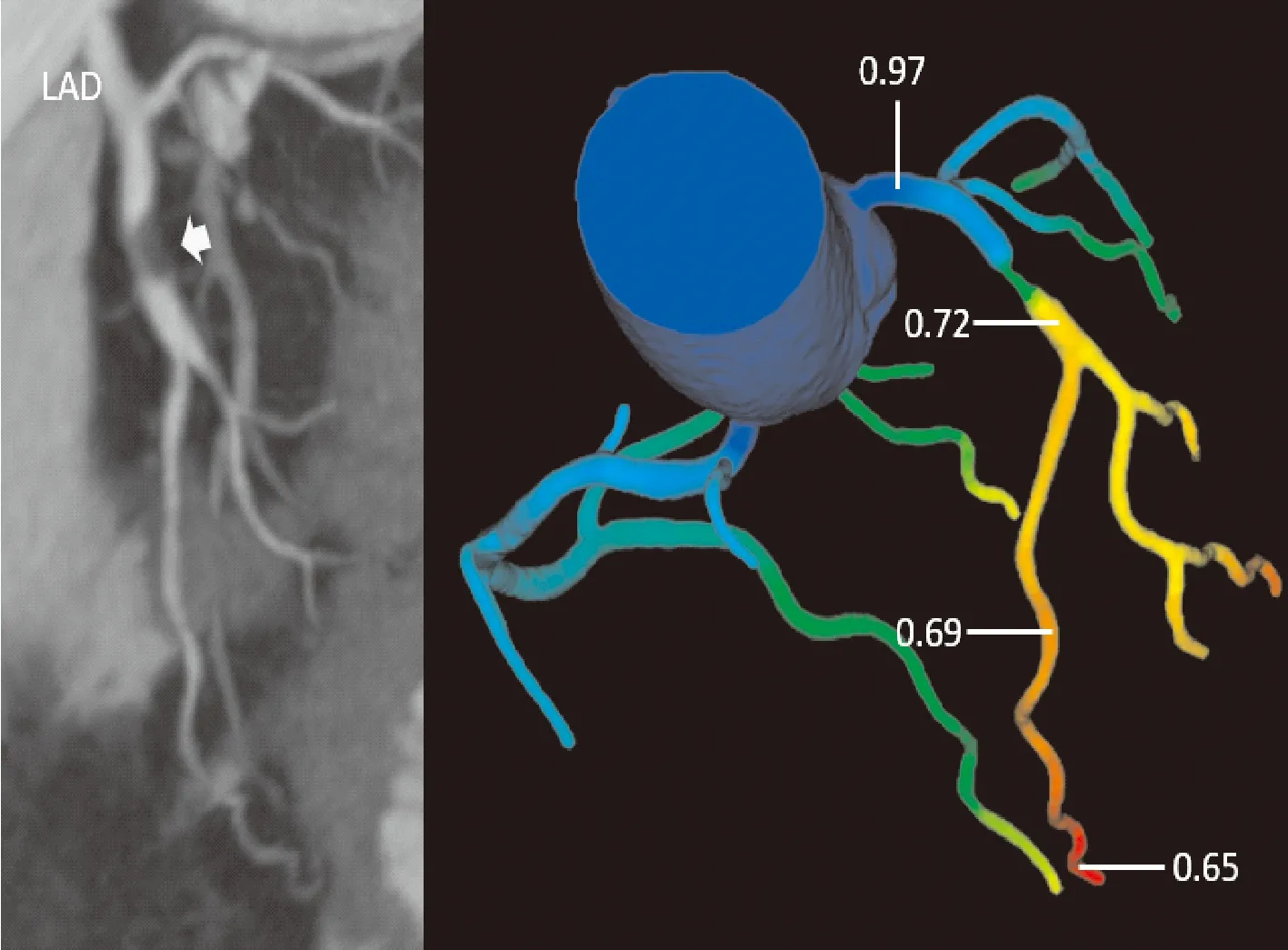
传统有创FFR的理论认为,在无病变的血管上任何点测量FFR值结果都是1, 有创FFR只在目标病变的远端的一个位点进行测量,通常推荐在狭窄远端的20~30 mm的位置,一般不会测量非常远端的血管节段。无创CT-FFR源于CCTA的信息而衍生,不仅能够提供狭窄远端病变特异性的FFR信息,也能够提供整个冠状动脉树上每一个点的FFR信息。随着冠状动脉血管向远端延续,狭窄远端的CT-FFR值可能逐渐下降或衰减,在每支血管的最远端达到CT-FFR的最低值(图2)。而在实际临床实践中,无论FFR还是CT-FFR都常常会随着冠状动脉管腔向远端的延续出现数值的下降。De Bruyne等[24]的研究发现弥漫性动脉粥样硬化,当没有局灶性狭窄的情况下,即通常表现为“正常”的冠状动脉造影图像,但仍有随着管腔向远端延续而出现压力持续下降,从而导致影像结果表现为缺血(FFR阳性);该研究中作者还发现在不存在冠状动脉造影的狭窄时,正常冠状动脉中有创FFR的结果也确实存在有衰减,而不是理论上的“在无病变的血管中各个点FFR都等于1”(图3)。

图2 无血流动力学意义的临界狭窄

图3 无病变的血管也存在压力衰减
Cami等[25]对同一组病人进行CT-FFR和有创FFR全血管段分析,发现无论是有创FFR还是无创CT-FFR,在心血管计算机断层扫描学会(SCCT)定义的0~1级狭窄(狭窄程度0~25%)的血管中,都存在随着血管管腔直径变小而测量数值衰减的现象。研究发现无论是有创FFR还是无创CT-FFR在对血管远端的病变进行分析时,都可能存在有假阳性的情况,Cami等[25]依据泊肃叶定律(流量学定律)可以解释此种现象的原因,在应用中CT-FFR对血管管腔直径要求是病变所在部位的参考血管≥2 mm,直径过小的血管可能会造成假阳性结果。
3.3 CT-FFR测量规则
尽管CT-FFR与有创FFR在数值呈现形式上存在部分差异,但是CT-FFR在临床应用和临床试验中的主要作用,仍是通过评估局灶性狭窄远端的CT-FFR值,作为侵入性FFR的替代方案。
具体而言,对于非弥漫性的局灶性狭窄,在病变远端20 mm~30 mm的管腔部位读取无创CT-FFR值作为该局灶性狭窄的CT-FFR值,这一规则与有创FFR测量的方法相类似。这种方法可以有效地区别“病变特异性缺血(Lesion-specific ischemia)”(图4)和仅有“血管末端阳性的CT-FFR(Distal vessel CT-FFR positivity)”(图5)的情况。
狭窄后立即发生CT-FFR值急剧下降。

狭窄后CT-FFR无急剧下降,血管末端的CT-FFR为阳性结果。
Kueh等[26]采用此种测量规则定义局灶性狭窄的CT-FFR值,评估了对血管末端CT-FFR阳性狭窄的再分类效果,结果发现血管末端阳性的CT-FFR经过再分类后,有43.9%的阳性结果变为阴性。而且这种变化,主要出现在临界狭窄的病变:狭窄程度<50%的病变中有67%结果发生变化,狭窄程度50%~69%病变中有约为49%的结果发生变化。对于仅有血管末端CT-FFR结果阳性,而狭窄后20 mm的CT-FFR结果为阴性时,则可以确定该狭窄并不具有血流动力学意义。在2018年欧洲心脏病学会(European Society of Cardiology,ESC)上发表的ADVANCE研究[27]采用了此种测量规则,说明此规则已经被广泛接受。
另有研究[25]表明无创CT-FFR的读取位置在狭窄后的10.5 mm位置可能更为合理,通过对3支血管近段和中段分布的SCCT2-4级狭窄(25%~99%狭窄)进行了CT-FFR分析,发现在狭窄后的一段长度范围内有CT-FFR数值的平台段,在平台段内不会有CT-FFR数值的衰减,并且推荐狭窄后10.5 mm的位置是可靠读取位置。因此,应用此规则的前提是先要确定目标病变的远端位置,而这个步骤不能单纯地在3D管腔重建上完成,需要在CCTA的曲面重建(curved planar reformation,CPR)图像上对病变的远端位置进行确认,然后才能应用此规则。
3.4 CT-FFR解读方法
针对具体患者的临床决策需要结合其解剖、临床表现、冠状动脉狭窄形态和位置、血管大小、血运重建的可行性等因素进行综合考虑。在一个解剖学局灶性狭窄冠状动脉后的CT-FFR显著下降代表着病变特异性缺血,特别是当CT-FFR的数值<0.75的时候。当CT-FFR值逐渐下降,但CCTA上没有局灶性狭窄存在,特别是在灰区范围(0.76~0.80)的时候,需要考虑其他可能性:弥漫性病变、串联病变、相对于供血区心肌体积过小的血管以及硝酸盐反应不足。
串联病变是指同一支血管上存在多个狭窄病变(图6),其FFR评估对临床治疗有很重要指导作用。Tanaka等[28]应用Heart Flow FFRCT计算跨狭窄压力阶差和跨狭窄ΔFFRCT,对串联病变进行评估,发现FFRct计算的跨狭窄压力阶差以及ΔFFRCT与有创FFR测得的跨狭窄压力阶差以及ΔFFR有很好的相关性;同时该作者指出应用虚拟支架技术会有助于CT-FFR技术对串联病变中每个狭窄的血流动力学评估:对串联病变中的非目标病变进行虚拟支架处理后,再评估目标病变的CT-FFR值,但这需要进一步验证。
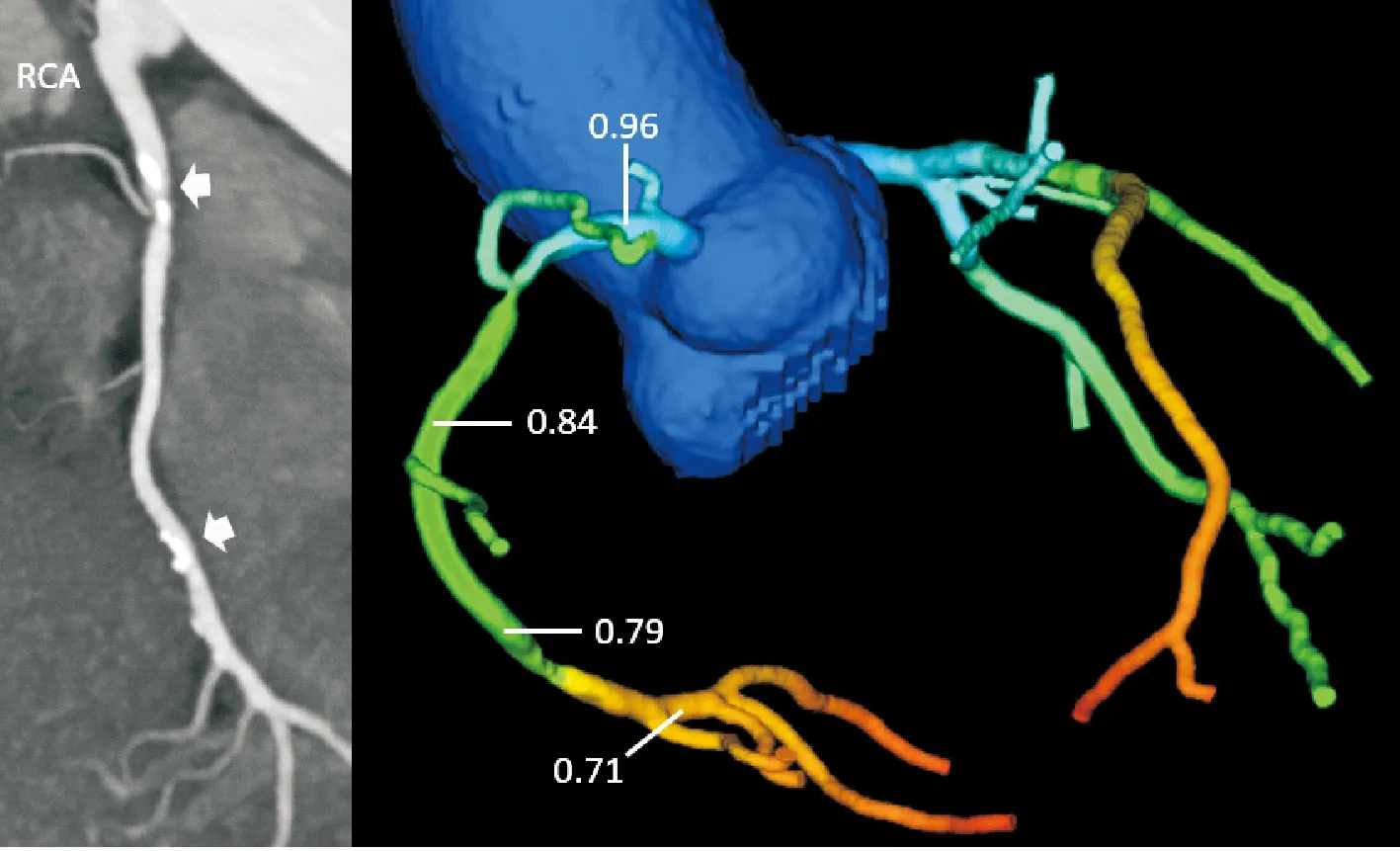
图6 串联病变
目前在已发表的CT-FFR诊断表现的验证性研究中,一般是参照冠状动脉造影记录的有创FFR压力传感器位置来选定CT-FFR测量位置(先确定有创FFR测定压力传感器位置,再测量3D重建模型中该位置的无创CT-FFR数值),然后再进行诊断表现的评价。但在临床的实际应用中,CT-FFR通常没有测量位置的参考,如果先完成CT-FFR的测量,然后再使用FFR测量和验证,其结果可能会存在差异。
造成结果有差异的主要原因可能是有创FFR与无创CT-FFR测量位点不同导致测量结果的差异,具体情况如下:(1)如果在有创ICA检查中,有创FFR压力传感器的位置比CT-FFR的测量位置更靠近近端的话,则CT-FFR的测量结果很可能更低;例如FFR压力传感器的位置恰好位于目标病变的远端20 mm,而与CT-FFR血管最远端的最低值去比较,则会导致CT-FFR值明显低于有创FFR值。(2)如果目标病变位于较大的血管的开口或近段,把压力导丝置于血管远端(>20 mm甚至更远处)进行FFR测量,此时若无创CT-FFR以狭窄后20 mm的位置取值比较,则可能会导致CT-FFR值高于有创FFR值。(3)即使在CT-FFR和FFR测量时都选择了病变远端的20 mm的位置,由于ICA只能看到管腔,而CCTA不仅可以见到管腔狭窄,还能看到管壁的粥样斑块,导致了在CCTA上定义的病变范围可能比ICA定义的病变范围更广泛、更倾向于向血管远端;且FFR又存在随血管向远端延续而压力衰减的特征,所以可能会导致CT-FFR值低于有创FFR值的情况。
此外,有研究表明对局灶性狭窄使用跨狭窄差值(狭窄近端的CT-FFR与狭窄远端CT-FFR的差值,ΔCT-FFR)的分析方法具有较强的缺血鉴别能力[29],但在另一项研究中表明在跨狭窄的ΔFFR值和ΔCT-FFR值比较中,两者差异具有统计学意义(P<0.001)[25]。因此能否以跨狭窄差值来鉴别缺血仍存在争议,临床应用上仍需大量数据验证[29]。
4 影响CT-FFR准确性的因素
CT-FFR的临床结果,有赖于CCTA对冠状动脉管腔模型的解剖学3D精确重建。信噪比及管腔提亮不足、运动伪影或者错层伪影,均会降低对斑块和管腔以及整个血管树的分析能力,进而影响CCTA解剖学评估和无创CT-FFR评估,其中错位/断层伪影是对CT-FFR影响最大的一种情况[30]。
心率过快会增加图像运动伪影风险,减低对血管边界以及斑块的分析能力,从而对CT-FFR的计算结果造成影响,因此,在一般64排窄体探测器CT成像中,建议受试者的最佳心率建议控制在小于70次/min[31]。此外,当病人有心肌桥存在的时,特别是发生在LAD的心肌桥,其近端血管更易发狭窄,心肌桥处会出现收缩期管腔缩小;在心率控制不理想时,可能会在收缩期进行管腔3D重建,从而对CT-FFR的计算结果造成影响。
另外,CCTA图像采集前是否服用硝酸酯类药物及服用剂量也会影响图像质量,进一步可能对CT-FFR计算准确性产生影响[32]。根据SCCT指南[33],在舌下应用硝酸酯时,喷雾剂优于片剂的效果。
5 小结及展望
CT-FFR不同于侵入性FFR和其他非侵入性检查,它提供了整个冠状动脉树的每个病变和血管各处的生理信息,在运用其结果的过程中,临床决策者应全面的掌握这些信息,以更好地实现CT-FFR对冠心病患者临床决策价值。准确且标准化的解读和报告对临床决策至关重要,这要求临床医生在CT-FFR分析的基础上,掌握读取功能数据的能力,以更好地实现对冠心病患者的辅助诊断。
如何充分利用人工智能优势,充分挖掘数据潜力,将 CT-FFR 结果与CCTA 衍生的其他指标(例如高危斑块及缺血心肌的量化)相结合,可能会为冠心病患者临床治疗决策和预测预后提供更加个性化的“一站式”分析。此外,鉴于CT-FFR是近些年来的新技术且发展较快,其在临床使用中的远期有效性和安全性仍需要进一步证实。
作者贡献声明
陈玉环:提出研究思路和框架,撰写、修改论文;尹游兵:提出研究思路和框架,修改论文;候江涛:提出研究思路和框架,修改论文;夏军:提出研究思路和框架,修改论文;张贺晔:提出研究思路和框架,修改论文。
利益冲突声明
陈玉环,尹游兵为科亚医疗科技股份有限公司的员工,作者之间不存在潜在利益冲突。

