HMGA1对肝细胞癌的增殖、迁移和细胞周期的作用影响
应函妤, 邢家恒, 孙江川, 钱颖, 胡林峰, 田男
(浙江中医药大学 生命科学学院, 浙江 杭州 310053)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化系统肿瘤之一,死亡率在恶性肿瘤中排名第三[1],其恶性程度高,发病隐匿,大部分患者确诊时已处于中晚期[2]。目前HCC的治疗以手术切除辅助肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)为主[3],而患者极易产生化疗耐药性。另外,在肝癌晚期形成的肿瘤微环境中,免疫抑制细胞因子系统地扩增使得T细胞的抗肿瘤活性降低,发生免疫逃逸,免疫治疗不能完全解决肿瘤细胞复发、转移等问题,临床效果欠佳[4]。因此,挖掘新的HCC预后分子标志物、挖掘新型防治靶点有利于肝癌治疗新方法的建立。
高迁移率族蛋白组A1(high mobility group AT-hook 1,HMGA1)是hook(HMGA)蛋白家族高迁移率组的转录因子,通过结合双链DNA(double-stranded,dsDNA)中富含AT区域的小凹槽在转录水平上调节下游基因的表达[5]。HMGA1与双链DNA的结合常改变DNA结构以促进其他转录因子的结合,并协调转录复合物的组装以增强或抑制转录[6-7]从而参与胚胎发育、细胞增殖、分化、衰老和转移[8-9]。有研究报道,HMGA1的过度表达增加了乳腺癌细胞S期的占比[10],在宫颈癌中加速G1/S的转变[11]。上述研究均提示,在部分肿瘤的发生与发展中HMGA1发挥了一定的作用。
目前,关于HCC和HMGA1之间的研究尚未清楚。本研究在肝癌细胞中敲低HMGA1表达后,通过实时定量PCR,蛋白质印迹、MTT、克隆形成,transwell以及流式细胞术等实验,研究小干扰RNA(Small interfering RNA,siRNA)敲低HMGA1表达量对肝癌细胞增殖、集落形成、迁移和侵袭能力的影响,为研究肝癌的发生、发展机制提供参考。
1 材料和方法
1.1 材料
1.1.1 细胞培养与转染
人肝癌细胞系HepG2、Hep3B和SNU-182和人肝细胞系HL-7702购自美国模式培养物集存库(American type culture collection,ATCC),使用达尔伯克必需基本培养基(Dulbecco’s modified eagle medium,DMEM)(含质量分数为10%新生牛血清、质量浓度分别为100 U/mL青霉素和100 μg/mL链霉素)并置于37 ℃、体积分数为5%CO2的培养箱中培养。siHMGA1、siRNA对照、miRNA模拟物、抑制剂、sh-HMGA1及其阴性对照由上海吉凯基因医学科技股份有限公司合成。取对数生长期的细胞接种于6孔板中,待其汇合度至30%~50%时按照说明书的指导采用Lipofectamine 2000进行转染。
1.1.2 数据收集及基因表达分析
70例肝细胞癌(HCC)、13例胆管癌(cholangiocarcinoma, CC)和7例混合型HCC和CC的基因表达谱来自GSE15765数据集(GEO,RRID:SCR_005012,https://www.ncbi.nlm.nih.gov/geo/)。肝癌组织和邻近肝组织样本中获得的基因表达谱和临床数据来自TCGA-LIHC(RRID: SCR_003193, http://cancergenome.nih.gov/)。根据TCGA-LIHC数据比较HCC和邻近组织样本中HMGA1的相对表达水平。癌症非编码RNAs地图集(The Atlas of Noncoding RNAs in Cancer,TANRIC)(http://ibl.mdanderson.org/tanric/_design/basic/index.html)用于评估TCGA数据集中不同级别肝癌组织中HMGA1mRNA水平[12]。R2: Genomics Analysis and Visualization Platform (http://r2.amc.nl)用于评估TCGA-LIHC中HCC患者的总体生存率。
1.1.3 基因富集与功能注释评价
注释、可视化和综合发现数据库(The Database for Annotation, Visualization and Integrated Discovery,DAVID)(http://david.abcc.ncifcrf.gov/)用于进行相关路径分析[13]与GO分析对预测基因进行功能注释[14];还通过KEGG法对相关基因进行功能注释。选择在TCGA-LIHC和GSE15765数据库都与HMGA1具有统计显著正相关和负相关的基因进行GO和通路分析。
1.2 方法
1.2.1 实时定量PCR
使用TRIzol试剂分离提取总RNA,并依据使用HiFi MMLV cDNA试剂盒合成cDNA,加入UltraSYBR混合物进行实时PCR。引物:HMGA1正向:5′-TCCAAGAGAGCATCCGCATT-3′,反向:5′-AGAGAGGGAGAGAGAGAGAGAGAGAGTGA-3′;β-actin正向:5′-GGCACCACCTTCTACAT-3′,反向:5′-GTGGTGGAAGCTGCTAGCC-3′。
1.2.2 蛋白质印迹
使用RIPA裂解液提取细胞总蛋白,加入蛋白上样缓冲液沸水浴5 min变性。质量分数为10%十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶分离蛋白质并转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上。质量分数为1%牛血清蛋白(bovine serum albumin,BSA)室温封闭2 h后置于4 ℃一抗孵育过夜。次日取出,经TBST洗涤3次后室温摇床孵育二抗2 h,再用TBST洗涤3次。最后,使用增强型化学发光(enhanced chemiluminescence,ECL)检测试剂盒通过显影仪检测信号。
1.2.3 MTT及克隆形成实验
以每孔5.00×103细胞接种到96孔板中后将细胞置于培养箱中培养。48 h后取出培养板,每孔加入10 μL噻唑蓝(methyl thiazolyl tetrazolium,MTT)溶液(质量浓度为5 g/L)。37 ℃避光培养4 h后弃去上清,每孔加入150 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),震荡使紫色结晶溶解,用酶标仪在波长490 nm下检测吸光度。以每孔500细胞接种于6孔板中,14 d后终止培养,经体积分数为4%多聚甲醛固定30 min,并用质量分数为0.1%结晶紫染色30 min,洗去多余的染液后置于显微镜下观察拍照。
1.2.4 Transwell实验
以每孔1.00×104细胞接种在无血清DMEM的上室,下室加入质量分数为20%血清的DMEM。培养36 h后取出经体积分数为4%多聚甲醛固定30 min,并用质量分数为0.1%结晶紫染色30 min,洗去多余的染液,用棉棒擦去位于上室的细胞,置于显微镜下观察拍照。
1.2.5 流式细胞术检测细胞周期
收集各组细胞,磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤2次,于体积分数为70%乙醇中固定过夜。次日取出离心后弃上清,用PBS洗涤两次,加入碘化丙啶(propidium iodide,PI)即用型染液300 μL及7.5 μL 核糖核酸酶A(ribonuclease A,RNaseA),放于37 ℃避光孵育30 min。过200目筛网后用Guava easyCyte 8流式细胞仪分析样品。
1.2.6 流式细胞术检测细胞凋亡
使用不含EDTA的胰蛋白酶消化细胞,取细胞悬液100 μL于4 ℃、1 000 r/min条件下离心5 min,用PBS洗涤,弃去上清液,加300 μL结合液至每管中,冰上避光,再加入3 μL AnnexinV-FITC和3 μL PI液于细胞悬液中混匀,过200目筛网后用Guava easyCyte 8流式细胞仪计算细胞凋亡率。
1.2.7 裸鼠异体移植实验
将1.00×107HepG2、HepG2/shHMGA1细胞注射到BALB/c裸鼠(每组n=5)的背侧。从接种后第7天开始,每隔3 d测量肿瘤异种移植物的长度和宽度,使用公式V=W2×L×0.5计算肿瘤体积。
1.3 统计学方法
2 结果
2.1 肝癌组织及肝癌细胞系中HMGA1的表达情况
HMGA1在正常肝组织、肝细胞、不同等级的肝癌组织、肝癌细胞系中的表达量及其表达量与患者生存期的关系(图1A~图1E)。通过对TCGA-LIHC数据库包含369个肝癌组织(n=369)和160个正常肝组织(n=160)的数据分析发现,与正常肝组织相比HCC组织中HMGA1基因的表达显著升高,HMGA1在Edmondson Ⅲ级和Ⅳ级肿瘤中的表达水平高于Ⅰ级和Ⅱ级肿瘤,在有血管浸润的肝癌组织中的表达水平高于无血管浸润的肝癌组织(图1A)。进一步提取HMGA1基因的表达水平与HCC预后的相关性数据,Kaplan-Meier Plotter分析后发现HMGA1表达高的患者生存率较低(图1B)。The human protein ATLAS网站分析结果表明HMGA1蛋白在HCC组织细胞核中的表达显著高于正常肝组织(图1C)。实时定量PCR实验结果显示,HMGA1的mRNA在肝癌细胞中的表达量显著高于正常肝细胞(图1D)。蛋白质印迹结果显示HMGA1蛋白在肝癌细胞系中的表达量更高(图1E)。以上结果表明,HMGA1可能参与HCC的发生发展。

1)与正常组比较,P<0.05。
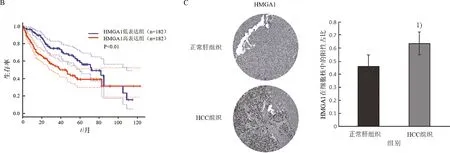
图1B HMGA1的表达量高低与患者生存期的关系

1)与HL-7702组比较,P<0.01; 2)与HL-7702组比较,P<0.05。
2.2 KEGG和GO分析HMGA1及其相关基因的功能
通过京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)和基因本体论(gene ontology,GO)分析,癌症基因组图谱(the cancer genome atlas,TCGA)-肝细胞肝癌(Liver hepatocellular carcinoma,LIHC)数据集中4 474个基因与HMGA1表达显著相关,其中2 672个正相关,1 802个负相关;GSE15765数据集中的1 173个基因,其中654个正相关和519个负相关。满足在两个数据库都具有统计意义的共有451个正相关基因和398个负相关基因。GO分析结果表明:HMGA1及其正相关基因主要富集于信号转导、细胞分裂、转录调控和增殖,参与细胞组分的细胞质、细胞核,以及参与细胞-细胞黏附的蛋白结合、钙粘蛋白结合,与分子功能的相同蛋白质结合(图2A~图2C)。KEGG分析发现HMGA1及其正相关基因参与的前3个途径分别是细胞周期、致病性大肠杆菌感染和志贺氏菌病(图2D),而HMGA1及其负相关基因参与氧化还原过程、代谢过程和蛋白质水解等主要生物过程;组成细胞外泌体、胞质和线粒体等细胞成分;发挥受体结合、氧化还原酶活性和蛋白均聚作用等分子功能(图2E~图2G)。KEGG分析证实这些基因主要参与代谢途径、补体和凝血级联以及脂肪酸降解(图2H)。
2.3 下调HMGA1抑制肝癌细胞的增殖和迁移并促进凋亡
转染HMGA1siRNA对肝癌细胞活力、增殖、迁移和凋亡的影响结果(图3A~图3E)。为检测HMGA1对肝癌细胞增殖和迁移能力的影响,通过siRNA下调了3种肝癌细胞系中HMGA1的表达水平。qRT-PCR和蛋白质印迹结果表明,转染HMGA1 siRNA成功降低了HepG2、Hep3B和SNU-182细胞中HMGA1的表达(图3A)。MTT结果表明与阴性对照相比,转染组细胞的细胞活力显著降低(图3B)。此外,克隆形成试验提示下调HMGA1的表达可抑制细胞的增殖能力(图3C)。Transwell结果显示HMGA1沉默导致HepG2、Hep3B和SNU-182细胞迁移能力下降(图3D)。流式细胞仪检测结果显示HMGA1沉默增加了3株胶质瘤细胞的凋亡率(图3E)。

1)与对应细胞系0 h组相比,P<0.01;2)与对应细胞系0 h组相比,P<0.05。
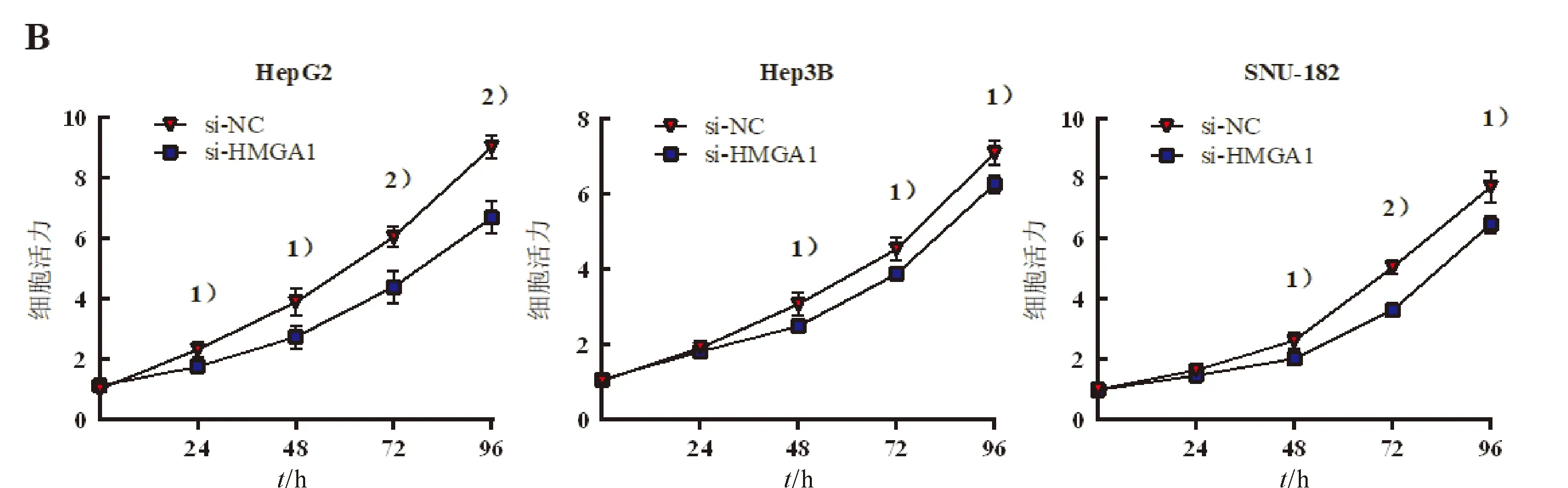
1)与对应细胞系0 h组相比,P<0.05;2)与对应细胞系0 h组相比,P<0.01。

1)与阴性对照组比较,P<0.05; 2)与阴性对照组比较,P<0.01。
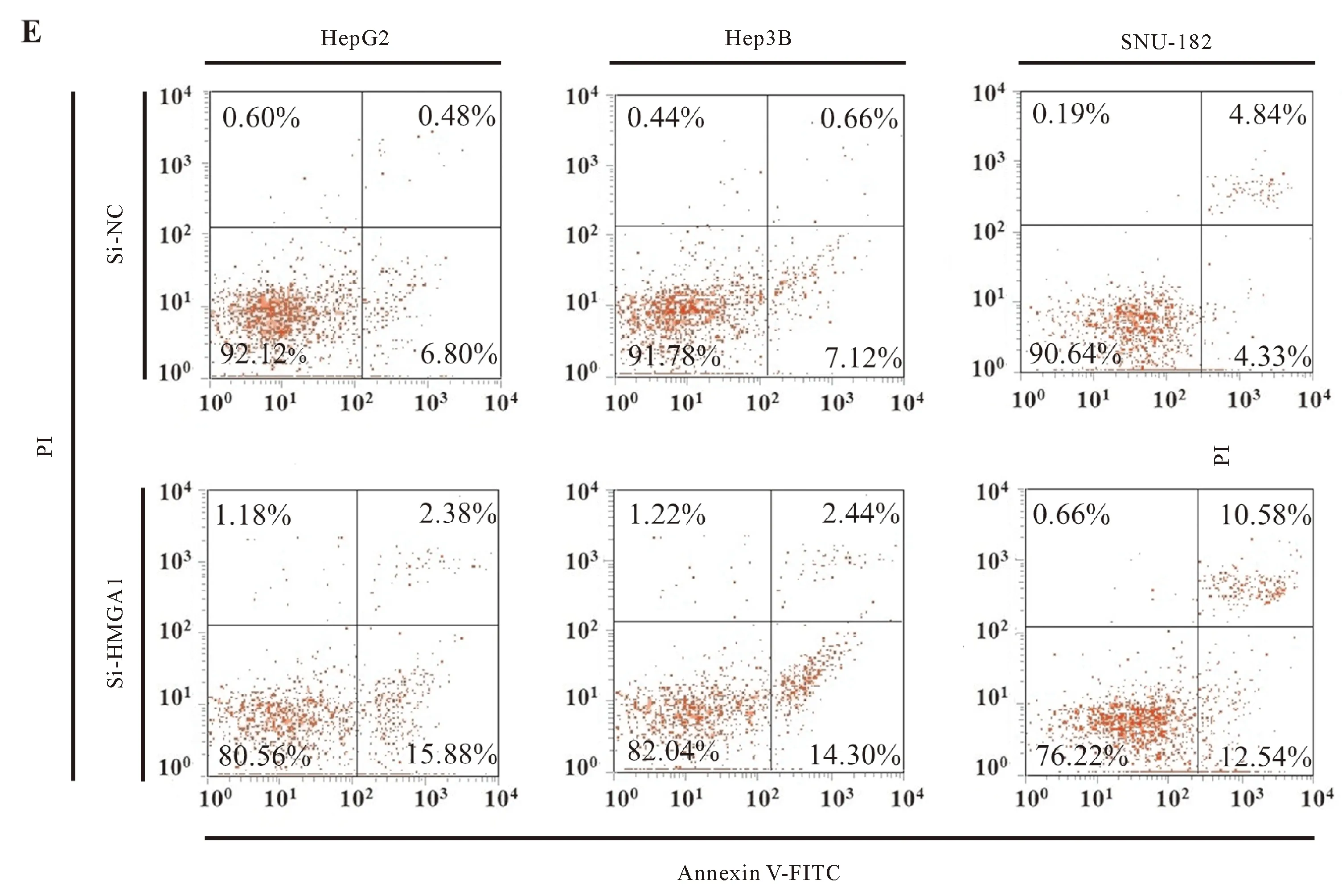
图3E 转染组与阴性对照组的细胞凋亡率
2.4 HMGA1低表达阻滞了肝癌细胞G0/G1期
细胞周期失调与肿瘤生长抑制有关[15],同时KEGG分析发现HMGA1及其正相关基因参与细胞周期调控(图2D)。检测si-HMGA1转染组和阴性对照组细胞的细胞周期分布(图4A、表1)。结果表明,降低HMGA1表达引起肝癌细胞的G0/G1期阻滞,而3株细胞的G2/M期分布无明显变化。为了进一步证明HMGA1表达下调对G0/G1期的阻滞作用,通过蛋白质印迹实验检测各组细胞中周期蛋白依赖性蛋白激酶6(Cyclin-dependent kinases 6,CDK6)和细胞周期蛋白D1(Cyclin D1,CCND1)蛋白的表达量,结果显示si-HMGA1转染组CDK6和CCND1的表达量均低于阴性对照组(图4B)。
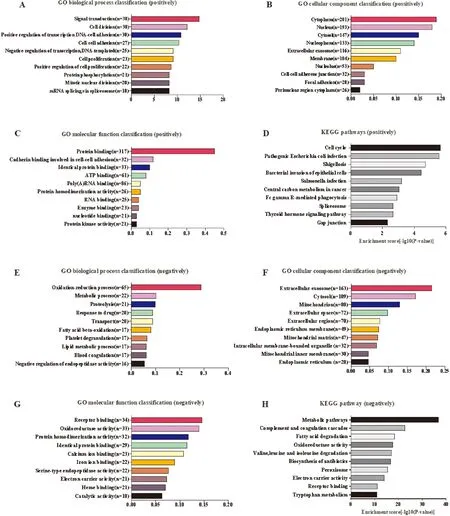
A:正相关基因参与的生物学过程;B:正相关基因参与的细胞组分;C:正相关基因发挥的分子功能;D:显著正相关通路的分析;E:负相关基因参与的生物学过程;F:负相关基因参与的细胞组分;G:负相关基因发挥的分子功能;H:显著负相关通路的分析。

表1 转染组与阴性对照组细胞周期分布的变化

A: 下调HMGA1后3种肝癌细胞周期不同时相的细胞占比;1)与阴性对照组比较,P<0.05;2)与阴性对照组比较,P<0.01;B:敲低HMGA1后3种肝癌细胞系中CCND1和CDK6的表达。
2.5 敲低 HMGA1对其表达量和裸鼠异位移植瘤生长的影响
为了研究shHMGA1的抑制效率,我们通过qRT-PCR和蛋白质印迹实验检测基因敲除结果。qRT-PCR结果显示,与阴性对照相比,转染组HMGA1 mRNA的表达被显著抑制(图5A)。蛋白质印迹结果也证实,低表达HMGA1使其蛋白表达量明显减少(图5B)。采用裸鼠体内肿瘤模型进一步研究HMGA1在肝癌进展中的作用。结果显示:与对照组相比,HepG2/shHMGA1组的肿瘤体积和肿瘤重量显著减少(图5C~图5D)。此外,对肿瘤切片进行Ki-67表达染色,HepG2/shHMGA1细胞显示出较低的Ki-67增殖指数(图5E)。

A:转染组和阴性对照组HMGA1 mRNA的表达量;1)与0 h转染组相比,P<0.01;B:转染组和阴性对照组中HMGA1的相对表达;2)与48 h阴性对照组相比,P<0.01;C:各组裸鼠肿瘤大小的生长曲线;1)与对照组相比,P<0.01;D:各组异体移植瘤的平均重量;3)与对照组相比,P<0.01;E:Ki67和HMGA1在异种移植肿瘤中的表达的免疫组化结果。
3 讨论
近年来,对于肿瘤基因转录调控的研究备受关注,已发现大量原癌及抑癌基因的产物可作为转录调控因子,其表达水平与肿瘤的恶性程度密切相关[16-18]。HMGA1是hook(HMGA)蛋白家族高迁移率组的转录因子,被报道在甲状腺癌的生长和侵袭发挥着重要作用[19]。Fu等[11]发现HMGA1在宫颈癌中高表达,抑制HMGA1的表达可抑制宫颈癌细胞的增殖、迁移及侵袭。Takaha等[20]研究报道,HMGA1在肾癌细胞中高表达,敲低HMGA1可抑制肾癌细胞的克隆形成能力、侵袭迁移能力并诱导细胞凋亡。除此之外,HMGA1还能够通过参与细胞内DNA的复制转录过程调控细胞自噬水平,使肿瘤免疫逃逸发生。并且HMGA1高表达有助于促进肿瘤微血管形成,促进肿瘤生长转移[6-7]。
本研究通过生物信息学分析发现肝癌患者组织中HMGA1基因及蛋白表达水平明显高于正常组织。在不同级别肝癌组织中,高级别组HMGA1表达量高于低级别组,说明HMGA1表达水平越高,肝癌患者病情越重。本研究结果显示HMGA1在有血管浸润的瘤体组织中表达较高,说明HMGA1表达越高,肿瘤发生侵袭转移的可能性越大。另外,生存分析结果显示HMGA1表达高的患者生存期较短,提示HMGA1可能是HCC诊断与预后的潜在标志物。为了进一步研究HMGA1对HCC细胞恶性生物学行为的影响,敲低肝癌细胞中HMGA1的表达量,分析发现下调HMGA1能够明显抑制肝癌细胞的增殖、迁移能力而增加细胞凋亡率,能够明显抑制裸鼠移植瘤的生长。本研究初步表明,HMGA1可能作为原癌基因参与HCC的发生发展过程。
GO功能注释和KEGG通路富集分析结果表明,在HCC中,HMGA1与苯并咪唑出芽抑制解除同源物蛋白激酶1(budding uninhibited by benzimidazoles 1,BUB1)、细胞分裂周期蛋白(cell division cycle 20,CDC20)、细胞周期检查点激酶1(checkpoint kinase 1,CHK1)、E2F transcription factor 3(E2F3)、微小染色体维持蛋白6(minichromosome maintenance 6,MCM 6)等周期调控相关蛋白表达显著正相关,暗示HMGA1可能通过调控细胞周期参与HCC的发生发展。Schuldenfrei等[21]研究发现,HMGA1通过上调细胞周期蛋白A1、A2、B1和E的表达量来维持淋巴细胞的细胞周期进程。因此,本研究通过流式细胞术检测HMGA1对HCC细胞周期分布的影响,结果显示HMGA1低表达诱导的肝癌细胞在G0/G1期发生阻滞。随后,免疫印迹检测G0/G1期阻滞相关蛋白表达发现,下调HMGA1抑制了HCC细胞中CDK6和CCND1的表达。以上结果表明,HMGA1参与HCC细胞的周期调控。
综上,本研究利用生物信息学研究HMGA1在肝癌中的表达模式,分析其参与肝癌发生发展的可能机制,并通过实验手段进行初步验证,为深入探讨HMGA1促癌作用机制提供了参考依据,在HMGA1及其相关基因对肝癌细胞周期的调控方式及参与的信号通路等方向值得深入探索。
作者贡献声明
应函妤:研究设计,撰写并修改论文,数据整理;邢家恒:设计实验方案,修改论文;孙江川:实验操作,统计分析;钱颖:实验指导;胡林峰:实验指导;田男:论文指导。
利益冲突声明
本研究未收到企业、公司等第三方资助,不存在潜在利益冲突。

