团簇NiCo2S4催化析氢活性研究
曾鑫渔,方志刚,井润田,王 倩,朱依文
(辽宁科技大学 化学工程学院,辽宁 鞍山 114051)
近年来,过度使用化石燃料导致的能源危机和环境污染问题,促使研究人员迫切需要寻找高效、清洁和可持续的能源来满足人类的日常需求[1-2]。氢气已被证实是具有高能量密度的无污染能量载体,因此如何获取新能源氢气来满足全球能源需求成为当下研究热点之一。从目前已有研究成果来看,产生高纯度氢最有效的方法之一就是电催化析氢反应(Hygrogen Evolution Reaction, HER)[3]。该方法采用金属催化剂增加电解水效率来生产足量氢气,其中铂(Pt)基合金材料被认为是最先进且绿色环保的金属催化剂,但Pt的稀缺和高成本限制了其在生产生活上的应用。因此开发地球上有丰富资源和经济高效的高稳定性高活性的无贵金属电催化剂对电催化析氢至关重要[4]。为了解决这一问题,人们正在研究自然丰度高的过渡金属物质以期找出可替代铂基合金的催化剂[5],大量实验证实过渡金属硫化物中的Ni-Co-S体系因其兼具过渡金属硫化物和Ni-Co氧化物的优良特性,同时具有丰富的氧化还原反应类型[6]、比对应金属更高的导电率[7]、高导电性[8]、环境相容性[9]和组成金属为非贵金属等优点而受到广泛关注。但在已有可查阅的文献中,对于Ni-Co-S体系的研究大多是以实验设计为主,缺乏基础理论上的研究。因此,有必要运用理论模拟催化过程来辅助或指导催化机理的研究,将实验设计和理论分析结合起来。文献报道已有原子配比Ni∶Co∶S=1∶2∶4[11]的基础上确定的研究对象NiCo2S4,另外,热门的模拟局域结构模型有团簇模型和周期性模型,而Ni-Co-S体系作为非晶态合金具有短程有序、长程无序的微观结构特点[10],由此我们计划从比较多个构型入手选取催化性能最佳的一个,选取团簇模型来模拟NiCo2S4的局域结构,再根据催化析氢反应机理对比参考数据综合判断团簇NiCo2S4的催化析氢反应活性,从而筛选出性能最佳的优化构型。
1 计算方法和反应机制
1.1 设计理论模型和计算方法
利用拓扑学原理[12]设计出近50种初始构型,通过密度泛函理论(Density Functional Theory, DFT)方法[13-14]在B3LYP/Lan 12dz水平下对团簇NiCo2S4在单、三重态下进行全参数优化计算和频率计算[15-17],其中对3种原子采用Hay等人[18]含相对论矫正的有效核电势价电子从头计算基组,即采用18-eECP的双ξ基组(3s、3p、3d/2s、2p、2d)加double zeta优化,并在S原子上添加极化函数ξS,d=0.55[19]。采用Gaussian09程序在启天M4390计算机上完成上述计算过程。
1.2 催化析氢反应机理
本文将团簇NiCo2S4(在反应式中以M表示)作为析氢催化剂,其催化机理如下。
第一步吸附氢原子:
M+e-+H2O→M-Hads+OH-,
第二步析氢反应,有两种途径:
Heyrovsky反应 M-Hads+e-+H2O→M+H2+OH-,
Tafel反应 2(M-Hads)→2M+H2。
2 结果与讨论
2.1 团簇NiCo2S4的热力学稳定性
2.1.1 团簇NiCo2S4的优化构型
依据模型原子数和基础结构进行排列组合来对团簇NiCo2S4进行假想结构的设计,其中涵盖有六棱锥、五棱双锥、单帽四棱双锥和双帽三棱双锥的5类基础结构,共获取了近50种初始构型。再对优化成功的构型排除含虚频的不稳定构型及相同构型,最终确定11种优化构型,其中单重态6种,三重态5种。如图1所示,以能量最低的构型1(3)为参考零点(设其能量值为0 kJ/mol),根据能量由低到高排序,其中编号右上角括号内数字表示重态,编号后括号内的数字表示相对能量。11种优化构型的空间结构分别为六棱锥型(3(1)、6(1)),五棱双锥型(3(3)、4(3)、5(3)、1(1)、4(1)),单帽四棱双锥型(1(3)、2(3)、5(1)、2(1))。
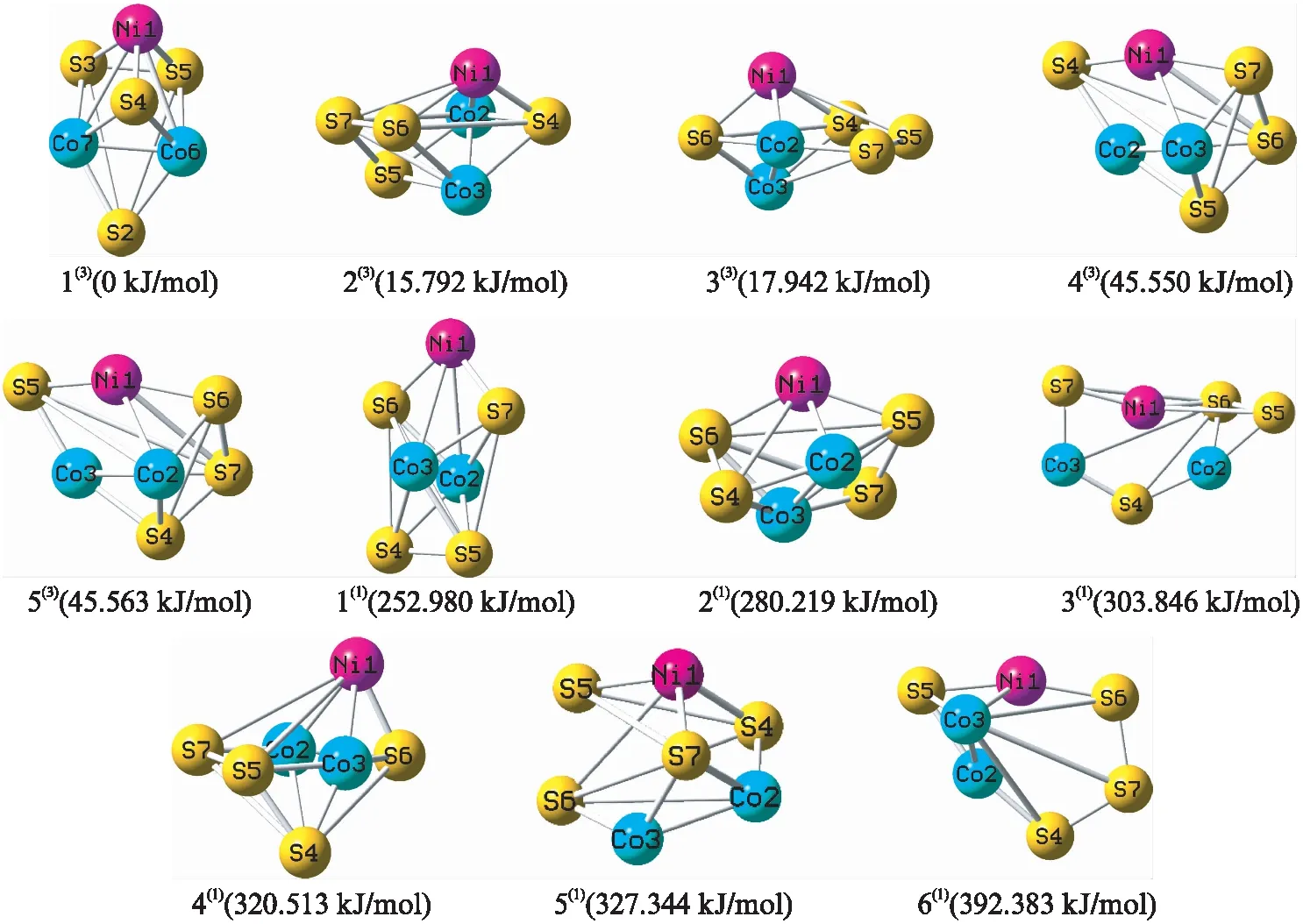
图1 团簇NiCo2S4优化构型图Fig.1 Optimized configurations of cluster NiCo2S4
2.1.2 热力学稳定性分析
讨论催化剂的热力学稳定性对于一个化学反应有着重要意义,因此在分析团簇NiCo2S4的催化析氢反应活性之前,先对各优化构型的热力学稳定性进行比较是有必要的。假设团簇NiCo2S4的生成路线为Ni+2Co+4S→NiCo2S4,通过Gaussian 09的优化计算得到团簇NiCo2S4的各项能量参数,见表1,其中包括校正能EZP、吉布斯自由能G、吉布斯自由能变ΔG以及结合能EB。依据能量最低原则:EZP越低,构型就越稳定;当ΔG小于零时,反应有自发进行的趋势,且ΔG越小,反应自发进行的趋势越大;EB越大,构型中各原子间的结合程度越大,构型就越稳定。构型1(3)的EZP(-1 312 957.921 kJ/mol)最小,构型6(1)(-1 312 565.538 kJ/mol)最大,即构型1(3)热力学稳定性最好,构型6(1)最差。结合ΔG和EB的数据,团簇NiCo2S4所有构型的ΔG均小于零、EB均大于零,且ΔG和EB呈此消彼长的关系,因此所有构型均有自发形成的趋势,同时自发形成趋势越大,构型越稳定。从重态来看,整体上三重态构型的EZP、ΔG均小于单重态而EB均大于单重态,因此三重态构型整体的稳定性均强于单重态。
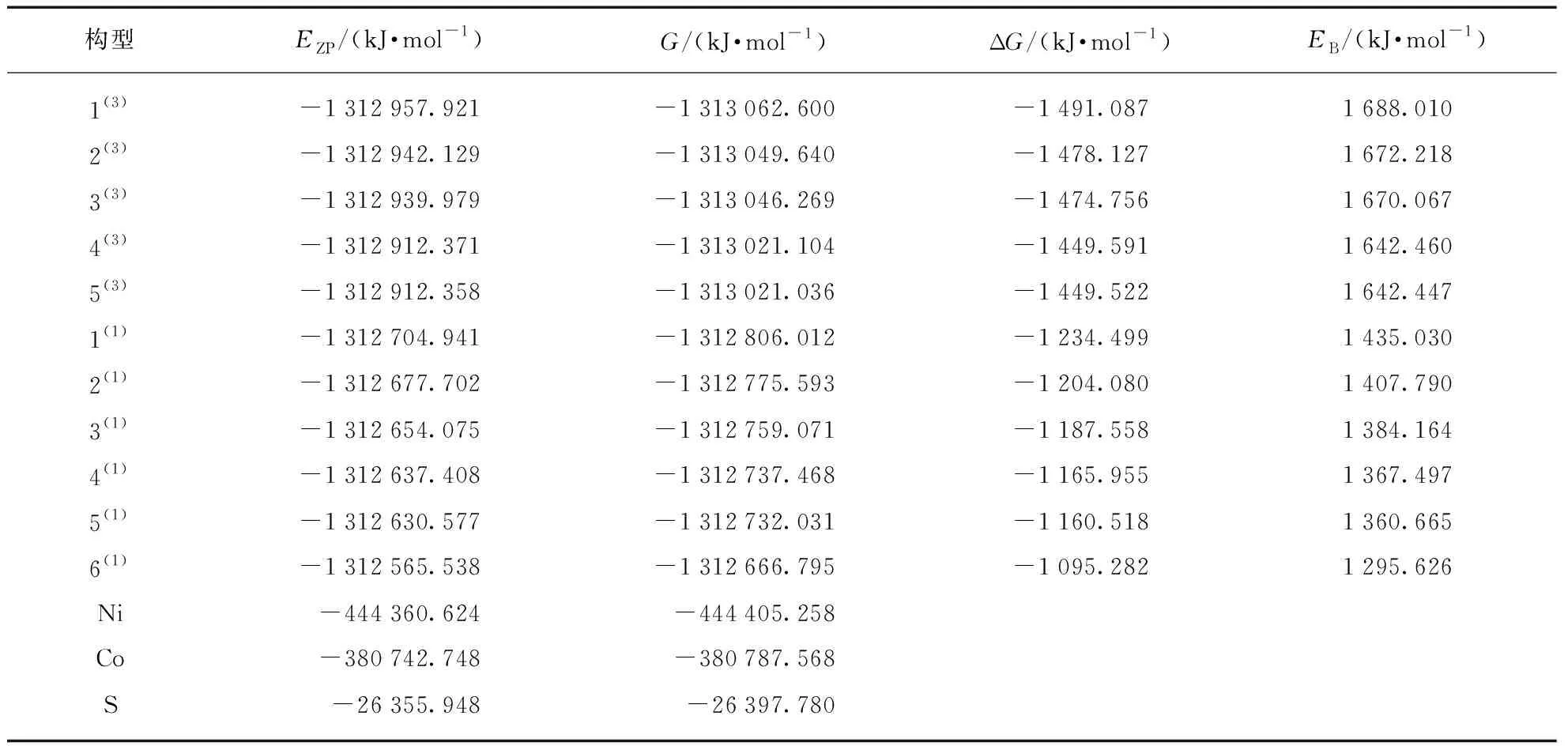
表1 团簇NiCo2S4能量参数
2.2 吸附氢原子性能
2.2.1 团簇NiCo2S411种构型的HOMO轨道图与水分子的LUMO轨道图
团簇NiCo2S4催化析氢的第一步反应是与水分子中的氢原子结合成中间产物NiCo2S4-H,该反应过程中电子从团簇NiCo2S4的HOMO轨道流向水分子的LUMO轨道,因此对比团簇NiCo2S4各优化构型的HOMO轨道电子分布可以初步了解其吸附氢原子性能。而为更直观地看清反应物的电子分布和转移情况,绘制团簇NiCo2S411种优化构型的HOMO轨道图与水分子的LUMO轨道图如图2(见第118页)所示,其中阴影部分表示电子云密度较大的部分,阴影颜色则可以表示电子的轨道波函数相位的正负,浅色表示正相位,黑色表示负相位。另外,三重态优化构型中电子有自旋向上的α电子和自旋向下的β电子两种,为进一步了解电子实际参与反应的情况,将三重态各优化构型HOMO图分为HOMO轨道中所有α电子的分布图(简写为α-HOMO)和所有β电子的分布图(简写为β-HOMO)。
图2中可以明显看出水分子的LUMO轨道上的阴影部分大面积为黑色,而仅仅在氧原子上有部分浅色阴影,说明在水分子LUMO轨道上分布的电子轨道波函数大部分为负相位。而由前线轨道理论可知[20],原子相同相位电子重叠时,电子轨道能量降低,即原子间形成成键轨道;原子不同相位电子重叠时,电子轨道能量升高,即原子间形成反键轨道。所以同相重叠才为有效重叠,而异相重叠为无效重叠。因此团簇NiCo2S4和水分子反应时,水分子的LUMO轨道更容易接受团簇NiCo2S4的HOMO轨道上轨道波函数为负相位的电子,从而实现同相重叠成键生成NiCo2S4-H。故在两者反应时,尽可能使团簇NiCo2S4中各原子负相位电子与水分子重叠,同时保证正相位电子与其重叠部分为中心部分,即各构型中阴影面积的大小和分布位置决定了其在析氢第一步反应机理中的反应活性强弱。三重态中相同构型的α-HOMO和β-HOMO的阴影面积大小没有明显差别,但是根据前面分析可知,团簇NiCo2S4的HOMO浅色阴影在中心、黑色阴影在中心外围时与水分子的同相重叠更佳,再对照HOMO图,同构型的β-HOMO在中心均会有浅色阴影,黑色阴影也在外围分布,则β-HOMO相较α-HOMO而言分布更佳,与水分子反应时同相重叠的可能性更大,对成键贡献更大,发生第一步析氢反应的活性更好;而相对于三重态整体而言,单重态整体在中心分布浅色阴影的概率较小,黑色阴影面积分布在外围的有效面积也相对更小,因而三重态构型与单重态构型相比,在催化析氢第一步反应中活性更强。综上所述,将催化析氢反应第一步的反应活性由强到弱排序即为β-HOMO>α-HOMO;三重态>单重态。

图2 团簇NiCo2S4各优化构型的HOMO轨道图与水分子的LUMO轨道图Fig.2 HOMO orbital diagram of each optimized configuration of cluster NiCo2S4 and LUMO orbital diagram of water molecule
2.2.2 团簇NiCo2S4与水分子间的轨道能级差
由图2虽然可以相对直观地看出不同相位的电子分布情况,但是在上述分析中并不能区分构型间的优劣,具有一定局限性,因此需要进一步比较团簇NiCo2S4三重态优化构型的α-HOMO和β-HOMO轨道能量以及单重态的HOMO轨道能量数据(见表2)。根据前线轨道理论可知,参与化学反应的分子间能级差越小,电子越容易从HOMO轨道跃迁到LUMO轨道,即分子间反应越容易进行,所以能级差也是衡量团簇NiCo2S4吸附氢原子能力强弱的重要参考数据,团簇NiCo2S4各优化构型HOMO轨道与水分子LUMO轨道的能级差计算结果见表2,其中ΔE=ELUMO-EHOMO,三重态EHOMO={max(Eα-HOMO,Eβ-HOMO)},通过比较各构型对应数据可以分析出吸附氢原子的最佳构型。将能级差ΔE由小到大排序得: 2(3)<6(1)<2(1)<3(3)<5(1)<5(3)<4(3)<1(1)<3(1)<1(3)<4(1),其中构型2(3)的能级差ΔE(621.871 kJ/mol)最小,构型4(1)(-698.299 kJ/mol)最大,说明在催化析氢的第一步反应中,构型2(3)HOMO轨道中的电子最容易流入水分子的LUMO轨道,与氢原子成键生成NiCo2S4-H;构型4(1)则最难发生该反应。
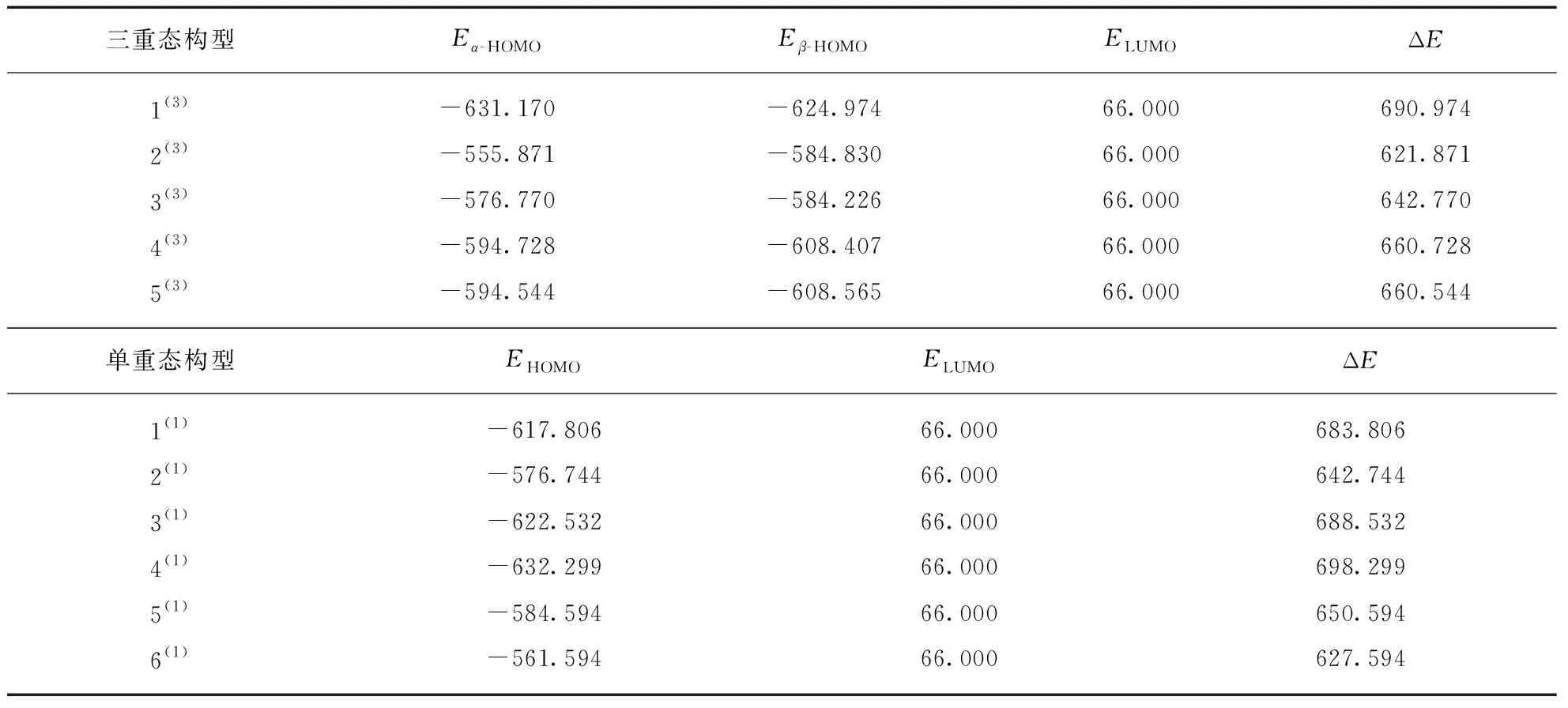
表2 团簇NiCo2S4各优化构型HOMO与水分子LUMO轨道能级差
2.2.3 氢原子在团簇NiCo2S4上的吸附态几何构型
原子在催化剂上吸附时,借助不同的吸附化学键而形成多种吸附态。吸附态不同,最终的反应产物亦可能不同,因而研究吸附态的具体结构具有重要意义。本文根据NiCo2S4-H模型中吸附上的氢原子与其他原子的键长和键级综合判断出氢原子所连原子,从而判断氢原子吸附态的几何构型。一般来说,氢原子的吸附态几何构型分为线式和桥式两种形态,区别在于氢原子所连原子个数,若所连仅有一个原子即氢原子吸附态几何构型为线式,若为两个则为桥式。另外,根据价键理论[21]可知,原子形成分子时,原子轨道重叠越多,成键越牢固,因而原子间键长越短、键级越高,所成键的重叠程度就会越高,成键强度也就越强。因此由原子间键长的长短即可辨别与氢原子所连的原子。NiCo2S4-H中与氢原子成键最短的键长及对应键级见表3,其中A代表NiCo2S4-H结构模型中与氢成键最短的原子,若A有两个原子时,键级取其平均值。从表3中不难发现,除3(3)-H和4(1)-H外其余NiCo2S4-H结构模型的A均为单一原子,说明在团簇NiCo2S4吸附氢原子这一步中线式吸附态为氢原子的优势吸附态,同时对比A-H列数据也可看出3(3)-H(0.183)和4(1)-H(0.183)的A-H是所有NiCo2S4-H结构模型中数值最小的,也进一步证实桥式吸附态不如线式吸附态牢固。除此之外,除3(3)-H、2(1)-H和4(1)-H外,氢原子在NiCo2S4-H结构模型中吸附位点均为S原子,说明在团簇NiCo2S4中S原子是催化析氢中最佳催化活性位点。值得一提的是,虽然仅有2(1)-H的A是Ni原子,但其A-H的数值(0.310)是其中最高的,即Ni-H成键是最牢固的,生成的NiCo2S4-H是最稳固的中间产物。
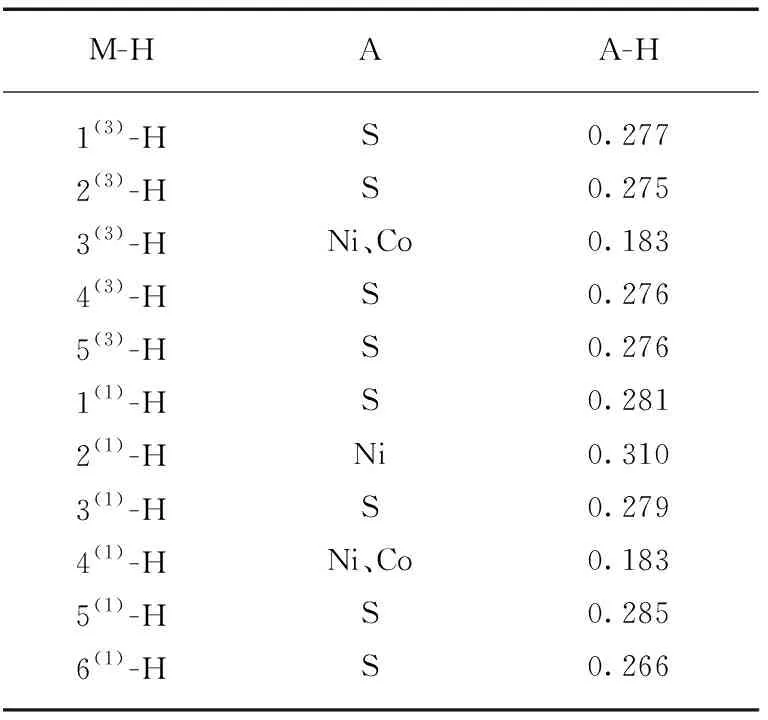
表3 NiCo2S4-H氢原子所连原子及其键级
2.3 解吸过程
2.3.1 Heyrovsky反应
团簇NiCo2S4吸附氢原子后,发生析氢反应时有两种途径,其中一种即为Heyrovsky反应(电化学脱附)。中间产物NiCo2S4-H在发生Heyrovsky反应时,电子从NiCo2S4-H的HOMO轨道转移到水分子的LUMO轨道,从而使水分子的氢原子再次吸附到NiCo2S4-H,使其与原有的吸附氢结合生成氢气,脱离NiCo2S4-H结构,这一步结束后NiCo2S4-H恢复为团簇NiCo2S4,说明催化剂析氢的使命到此为止。不难看出,Heyrovsky反应的原理与第一步吸附氢原子的原理相似,因此对照之前所用分析方法,在此采用NiCo2S4-H各结构模型的HOMO轨道与水分子的LUMO轨道的能级差来预测和对比各结构模型反应过程的难易程度,数据见表4。其中2(3)-H(601.523 kJ/mol)、4(3)-H(601.576 kJ/mol)和5(3)-H(601.523 kJ/mol)结构模型的能级差ΔE数值较小,且三者相差无几,2(1)-H(684.568 kJ/mol)结构模型数值最大,说明2(3)-H、4(3)-H和5(3)-H结构模型最容易通过发生Heyrovsky反应析氢,而2(1)-H结构模型最难通过这一途径析氢。结合2.2.2章节分析内容“构型2(3)的能级差ΔE(621.871 kJ/mol)最小”可知,无论是在吸附氢原子过程中还是在电化学脱附过程中,构型2(3)的HOMO轨道与水分子的LUMO轨道间的能级差均是最小,所以构型2(3)是整个催化析氢反应中的优势构型,即最容易发生这两个反应。
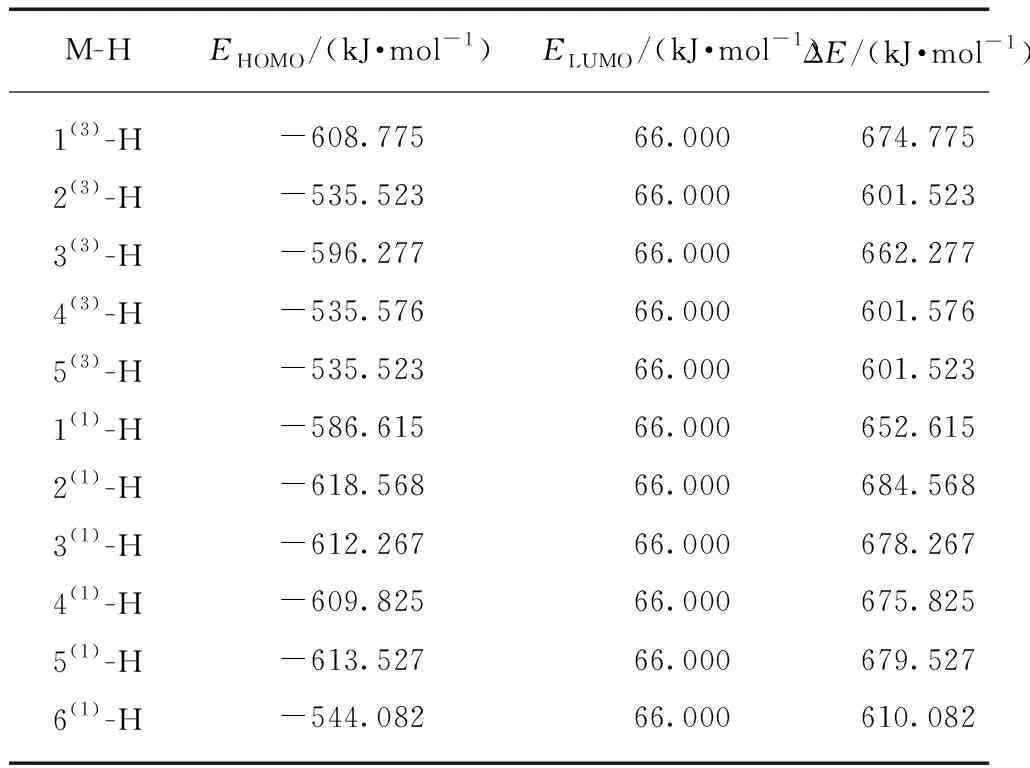
表4 NiCo2S4-H的HOMO轨道与水分子LUMO轨道能级差
2.3.2 Tafel反应
吸附氢原子后的NiCo2S4-H通过Tafel反应析出氢气时,两分子NiCo2S4-H中所含氢原子彼此结合再以氢气的形式脱离结构,从而完成解吸过程。同上,过程结束后NiCo2S4-H结构变成团簇NiCo2S4,说明催化析氢反应结束。在上述反应中,涉及到NiCo2S4-H的断键,因此NiCo2S4-H结构的结合能EB成为衡量Tafel反应难易的标准,只有当NiCo2S4-H结构的结合能EB较小时才有助于解吸过程的完成。所有NiCo2S4-H结构的结合能EB见表5,不难看出,6(1)-H结构的结合能EB(82 143.002 kJ/mol)最小,5(1)-H结构(82 347.319 kJ/mol)的最大,即6(1)-H结构最容易通过Tafel反应这一步骤析出氢气,5(1)-H结构则最难。结合2.2.2章节的能级差排序“3(3)<6(1)<2(1)<4(3)<5(1)<6(3)<5(3)<1(1)<3(1)<2(3)<4(1)”可知,构型6(1)虽然在第一步吸附氢原子中反应活性稍逊于构型2(3),但当通过Tafel反应这一途径反应时,构型6(1)表现更佳。

表5 所有NiCo2S4-H结构模型的结合能EB
3 结 论
团簇NiCo2S4共有11种优化构型,其中单重态5种,三重态6种,构型空间结构有六棱锥、五棱双锥、单帽四棱双锥3种。在热力学稳定性方面,通过分析团簇的各项能量参数得出: 构型1(3)的热力学稳定性最好,构型6(1)最差;三重态构型整体上热力学稳定性强于单重态构型。
在催化析氢的第一步吸附氢反应中,通过对HOMO、LUMO图的分析可知,三重态的β-HOMO反应活性强于α-HOMO,三重态构型整体上反应活性强于单重态构型。通过比较团簇NiCo2S4所有构型与水分子的能级差可知,构型2(3)HOMO轨道中的电子最容易流入水分子的LUMO轨道,与氢原子成键生成NiCo2S4-H;构型4(1)则最难发生吸附氢反应。
对于第二步析氢过程有两种反应途径,分别是Heyrovsky反应和化学重组。构型2(3)是整个催化析氢反应中的优势构型,通过Heyrovsky反应这一途径完成全部析氢过程;构型6(1)在吸附氢时稍逊于构型2(3),最容易通过化学重组这一途径完成析氢过程。构型1(3)的热力学稳定性虽然最强,但在析氢的整个反应中表现均不理想。

