内蒙古农牧交错带农田与草地土壤真菌群落特征差异性分析
韩 丽,李立军,赵 举,张艳丽,尹春艳,,沙 松
(1.内蒙古农业大学农学院,内蒙古呼和浩特 010019;2.内蒙古自治区农牧业科学院,内蒙古呼和浩特 010031;3.呼伦贝尔农垦集团三河农牧场有限公司,内蒙古三河 022256)
土壤是土地生产力的基础,地下环境的差异影响着地上群落。“土壤健康”由DORAN 等[1]最先提出,强调土壤具有较高水平的质地和可持续能力[2-3]。传统的物理和化学指标在过去很长一段时间被用来判断土壤质量优劣[4],随着现代分子技术的不断发展,微生物学指标渐渐进入人们视野,研究表明,微生物多样性较高的土壤能为地上植株带来更高的生产力,对环境胁迫也具有一定的抵抗能力[5-6]。土壤微生物种类繁多,但细菌和真菌在土壤微生物中占据重要地位。土壤真菌作为重要的分解者,参与土壤养分循环和转化过程,从而改善土壤肥力以及土壤质量[7]。
内蒙古农牧交错带是我国北方重要的陆地生态系统,耕地和草地两种土地利用方式构成其独特的生态环境[8-10]。在脆弱敏感的生态环境下,土壤质量提升显得尤为关键。通过对两种土地利用方式下的土壤真菌群落结构和多样性进行研究,可以在一定程度上了解和明确关键物种,对提高微生物多样性及土壤质量、改善生产力具有重要意义[11]。然而,相关研究均在森林[12]、草原[13]、山地[14]等单一生态系统或局域样地水平上进行。对于大尺度范围下的耕地和草地两种土地利用方式下,土壤真菌群落结构以及多样性变化尚不明确。因此,本研究通过采集多区域农田与相邻草地土壤样品,利用高通量测序技术分析其土壤真菌多样性,进一步明确内蒙古农田与草地两种生态系统经长期演化的土壤真菌结构及多样性分布特征,进而从土壤微生物角度出发,为内蒙古农牧交错带土壤微生物多样性研究以及土壤质量提升提供参考。
1 材料和方法
1.1 研究区概况
研究区主要为内蒙古农牧交错带,包括大兴安岭北麓、大兴安岭南麓、西辽河平原、燕山丘陵区、阴山北麓、土默川平原、黄土高原和河套平原8 个有大面积农田与草地分布的生态区。全样带气候条件复杂,横跨半湿润、半干旱和干旱气候带,以温带大陆性季风气候为主,样带以干旱农田和温带草原区为主,从东到西主要的土壤类型有黑钙土、风沙土、栗钙土、草甸土、棕钙土。
1.2 土壤样品的采集
于2019年7—8月作物生长旺盛期,采集不同地区农田土壤与相邻自然草地土壤。由于大兴安岭南北麓区域跨度较大,在南麓和北麓各设1 个样地,以缩小经纬跨度间的差异。农田均选自当地主栽作物且面积超过2 hm2的样区,在每个样区设4 个1 m×1 m 的样方,草地土壤设置4 个30 cm×30 cm的样方。每个样方内根据植株根系大小,去除地表板结的部分,采用对角线取样法采集根层0~20 cm 处土壤样品,保存于灭菌的密封袋中,置于冰袋中冷藏迅速带回实验室,保存于-80 ℃冰箱,供土壤真菌群落结构多样性分析。样地基本信息见表1。所选不同研究区采样点均无明显坡度变化。
1.3 高通量测序
使用OMEGA 试剂盒,提取微生物组样本总DNA,同时采用荧光分光光度计,在260 nm 和280 nm 处分别测定DNA 吸光值,检测DNA 浓度,并用1.2%的琼脂糖凝胶电泳检测DNA 的质量。针对样本采用18S rRNA 基因ITS-V1 区引物(正向:GGAAGTAAAAGTCGTAACAAGG;反向:GCTGCGTT CTTCATCGATGC)进行PCR 扩增。PCR 结束后,对产物进行琼脂糖电泳,并对DNA 进行纯化(磁珠纯化)与定量。
上机测序前,需要对文库在LabChip 上进行质检,合格的文库只有单一峰值,且无接头。在荧光定量系统上对文库进行定量,合格的文库浓度应在3 nmol/L 以上。将合格的各上机测序文库梯度稀释后,根据所需测序量按相应比例混合,并经NaOH变性为单链进行上机测序,使用NovaSeq 测序仪进行双端测序。
1.4 数据分析
将测序原始数据运用QIIME2 平台进行数据处理与分析,利用DADA2 进行数据过滤、降噪、拼接、嵌合体去除与聚类。利用QIIME2 平台和R 语言软件,对数据进行分析,得到每个ASV 对应的物种分类信息。然后进行稀释曲线分析,比较农田和草地土壤在门级别分类水平下真菌群落组成差异,基于ASV 聚类分析和物种分类的共有分析,使用未抽平的ASV 表,进行随机森林分析及巢式分层交叉检验。运用R 语言软件基于UniFrac 距离算法进行主坐标分析(principal coordinate analysis,PCoA)。农田与草地土壤真菌多样性(包括Shannon-Wiener、Simpson 多样性指数和Chao1 丰富度指数)差异运用SPSS 20.0 统计学软件进行区域间单因素方差分析。
2 结果与分析
2.1 土壤真菌物种组成分析
2.1.1 土壤样品测序结果
所有已鉴别的土壤真菌隶属7 门20 纲43 目76 科123 属123 种,根据样品覆盖率指数结果绘制稀释曲线(图1),可以看出各地区农田与草地土壤样品OTU 随着测序片段增加而迅速增加,达到峰值后保持稳定,表明测序结果已足够反映当前样本包含的物种。

图1 农田与草地土壤真菌物种稀释曲线
2.1.2 门水平下真菌群落结构分析
根据农田土壤真菌群落组成(图2a),相对丰度排在前十的真菌门分别为子囊菌门(Ascomycota)、担 子 菌 门(Basidiomycota)、 被 孢 霉 门(Mortierellomycota)、油壶菌门(Olpidiomycot)、壶菌门(Chytridiomycota)、毛霉菌门(Mucoromycota)、球囊菌门(Glomeromycota)、 捕虫霉亚菌门(Zoopagomycota)、芽枝霉菌门(Blastocladiomycota)、罗兹菌门(Rozellomycota);其中,子囊菌门相对丰度E 区最高,为81.58%;担子菌门在B 区丰度达36.44%;被孢霉门在G 区丰度最高,为11.17%。这3 个菌门在不同区域均有分布,而油壶菌门仅在A区和H 区分布,且在A 区丰度高达41.58%,这与土壤地上植被有很大关系,可见,油菜等油料作物多有油壶菌门的存在。其他菌门在B、G、H 区丰度分别为12.56%、12.12%、12.20%。
从草地土壤真菌群落分布来看(图2b),相对丰度前十的菌门分别为子囊菌门、担子菌门、被孢霉门、壶菌门、球囊菌门、油壶菌门、毛霉菌门、罗兹菌门、芽枝霉菌门、捕虫霉亚菌门;与农田土壤不同的是,草地土壤中比重较小的菌门排序有所改变。子囊菌门在G 区最高,为76.58%;担子菌门在H 区最高,达48.12%;被孢霉门在D 区最高,达24.85%。农田土壤子囊菌门和被孢霉门总丰度高于草地土壤,而草地土壤担子菌门总丰度高于农田土壤,且其他菌门在各地区土壤间相对丰度均表现为草地高于农田。

图2 农田与草地土壤真菌群落结构相对丰度
2.2 土壤真菌多样性分析
2.2.1 土壤真菌α 多样性分析
由表2 可知,样品覆盖率均为0.99,结合稀释曲线(图1)以及区域分布范围(表1)可知,测序结果基本能够反映各区域真菌群落分布情况。Chao1 指数反映了物种丰富度,Shannon-Wiener 指数和Simpson 指数共同决定着微生物均匀度,Simpson 指数适用于简单群落;Shannon-Wiener 指数更适用于复杂群落。不同区域农田真菌α 多样性指数显示(表2),B 区农田土壤Chao1 指数显著(P<0.05)高于其他区,为926.53,而H 区显著(P<0.05)高于A、C、D、E、F、G 区,其余区域间差异不显著(P>0.05),为359.84~509.29;Shannon-Wiener 指数和Simpson 指数表现出A 区显著低于(P<0.05)其他区域的趋势。从草地土壤真菌多样性指数来看,B、F 区Chao1 指数显著高于其他区域,分别为1 088.41、1 041.50,D区最低,为324.39;Shannon-Wiener 指数在区域间有显著差异(P<0.05),分布在4.82(H 区)~7.32(B 区);Simpson 指数H 区草地土壤低于其他区域,在其余区域间差异不显著(P>0.05)。综合各区域多样性指数,农田土壤多样性指数在区域间由高到低为B>H>F>E>G>D>C>A;草地土壤多样性指数在区域间由高到低为B>F>G>H>E>C>A>D,说明大兴安岭南麓与河套平原农田土壤真菌多样性较高,大兴安岭南麓与土默川平原草地土壤真菌多样性较高。
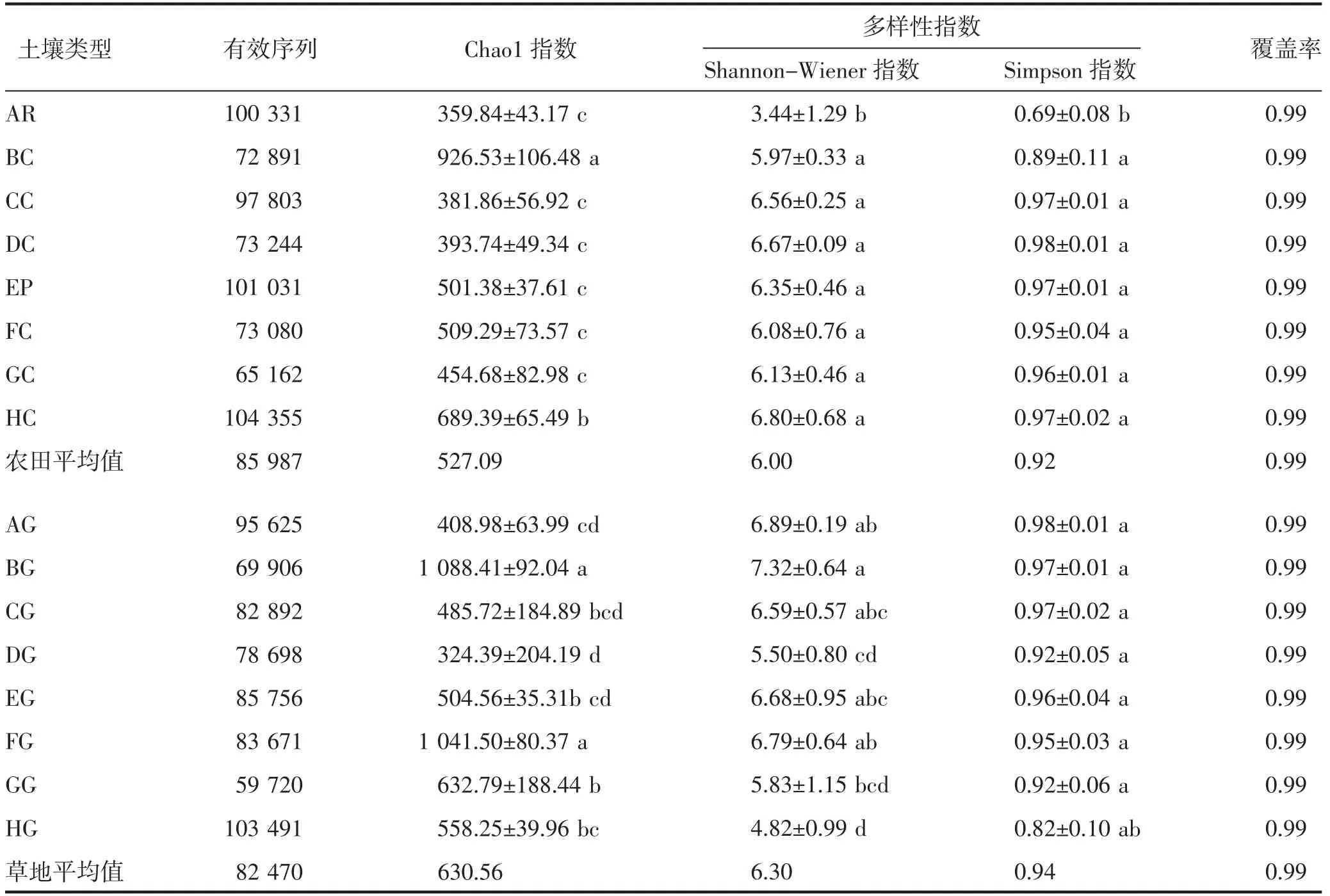
表2 真菌群落α 多样性指数特征
将不同区域土壤样品分为农田和草地两种土地利用类型后,对各样区多样性指数进行平均,土壤Chao1 指数、Shannon-Wiener 指数和Simpson 指数表现出一致规律,平均值均为草地土壤大于农田土壤,说明草地土壤物种数目明显高于农田土壤。
2.2.2 土壤真菌群落β 多样性分析
农田土壤PCoA 分析显示(图3a),第一、二主成分的方差贡献率分别为17.4%、13.4%,两个主成分共解释了总变异的30.8%。各样品在由PCo1 与PCo2 组成的二维图上呈现明显的空间差异:PCo1将A 区土壤与其他区域土壤明显分为两区,PCo2 将A、B、C、D 区土壤与E、F、G、H 区土壤明显分开。从草地土壤PCoA 分析来看(图3b),第一、二主成分的方差贡献率分别为11.8%、8.9%,两个主成分共解释了总变异的20.8%。PCo1 将A、D、E、H 区土壤与B、C、F、G 区土壤明显分开,PCo2 将C、E、H 区土壤与A、D、F 区土壤明显分开。农田土壤在群落相似度上呈现出组间差异,组内差异较小;草地土壤组内差异相比农田土壤变异率更大,组间差异无明显分布规律,各群落间差异较大,仅B、C、F、G 4 个区域草地土壤真菌群落较为相似。
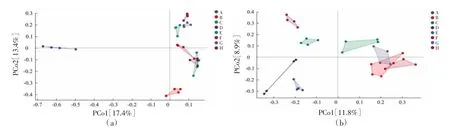
图3 农田与草地土壤真菌群落主成分分析
2.3 土壤真菌物种差异分析
2.3.1 不同区域土壤OTU 水平分析
由图4 可知,不同区域间OTU 数差异明显。农田土壤(图4a)共有OTU 数为43,草地土壤(图4b)共有OTU 数为17;对各地区进行比较,农田中B 区土壤OTUs 最多为1 706,各区域农田土壤OTUs 从高到低依次为B>H>F>G>E>A>C>D;草地土壤OTUs 在B 区最高达1 802,各区域从高到低依次为B>F>E>D>A>H>G>C。整体来看,草地土壤真菌类群相对丰富,农田土壤真菌类群相对较少,草地土壤较农田土壤组间差异更大;B 区土壤相比其他区域来说物种更为丰富。
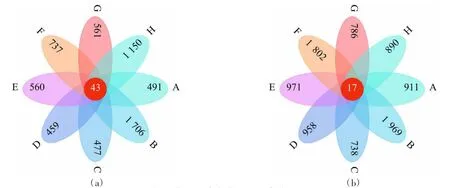
图4 农田、草地土壤真菌OTU 分类花瓣图
2.3.2 不同区域土壤真菌随机森林分析
图5 为各区域中门水平下物种的丰度分布。从上到下,物种对模型的重要性依次递减,可以认为这些重要性靠前的物种是组间差异的标志物种。决定农田土壤真菌群落差异的重要物种依次为担子菌门、油壶菌门、子囊菌门、壶菌门、被孢霉门、球囊菌门、毛霉菌门,这些菌门重要值由0.148 至0.074 依次降低(图5a)。草地土壤中的差异物种重要值在0.067~0.135(图5b),从大到小依次为担子菌门、油壶菌门、球囊菌门、被孢霉门、子囊菌门、罗兹菌门、壶菌门、毛霉菌门。担子菌门、油壶菌门和子囊菌门是农田土壤真菌组间差异的标志物种(重要值>0.12),而草地土壤真菌组间差异的标志物种(重要值>0.12)分别为担子菌门、油壶菌门、球囊菌门和被孢霉门。

图5 农田与草地物种差异热图
3 讨论
有研究表明,真菌相比细菌数量类群要少,但真菌在土壤微环境中的作用十分重要[15]。从内蒙古农牧交错带土壤真菌群落结构来看,各区域群落组成无显著规律,但在不同作物及不同土地利用方式上体现出显著差异,SHANG 等[16]的研究也表明,在群落演替过程中,土壤微生物群落组成和多样性受植物多样性和土壤理化性质的显著影响。农田与草地土壤的主要优势菌门均为子囊菌门、担子菌门和被孢霉门,这与其他农田或草地真菌群落构成的研究相似[17-19],说明内蒙古农牧交错带土壤真菌群落在门水平下,菌群丰度在不同生境类型及同一生境不同区域间均有差异,其相对丰度受不同生态类型以及不同作物种类的影响较大[20],群落构成反映出土壤真菌种类集中于已知的几个大类群,草地土壤其他菌门丰度总是高于农田土壤,因此,对草地土壤真菌资源开发研究价值高于农田土壤。在油菜田中发现,油壶菌门占据很高的丰度,但在油菜绿肥还田的研究中[21],油壶菌门并未出现在真菌群落优势菌门中,说明油壶菌门仅存在于油料作物生长季,并不能在绿肥中体现。在两种土地利用方式下,农田土壤子囊菌门和被孢霉门总丰度高于草地,子囊菌门在真菌群落中存在数量最多,大多数为腐生菌,含有纤维素和木质素分解酶,可以将养分有效地分解为易吸收物质[22]。一些研究表明,被孢霉门多数存在于健康土壤中,属于有益真菌[23-24]。可见,施肥为农田土壤提供大量养分供其分解,可提高土壤有益真菌的丰度。马欣等[25]在黄土高原的研究表明,农田土壤担子菌门相对丰度显著高于紫花苜蓿土壤,是因为传统耕作措施提高了农田土壤中的木质素含量,从而增加了担子菌门相对丰度。本研究中草地土壤担子菌门总丰度高于农田,农田翻耕等措施并未提高木质素等的分解率,而草地土壤的扰动较小,土壤中富集大量凋落物,一定程度上提高了担子菌门的丰度。
本研究表明,草地土壤真菌多样性指数高于农田土壤。此前,有研究证明,农田生态系统相比草地生态系统受人为干扰大,导致其土壤微生物多样性低于草地土壤[26-28]。但在一些研究中存在相反结论,认为农业实践频繁干扰有助于保持土壤微生物多样性和系统的抗逆性[29]。综合比较各区域土壤真菌多样性发现,大兴安岭南麓农田和草地土壤多样性均表现较高。长期耕作环境对微生物群落组成会有影响,但不会影响群落功能,且农田和草地还存在一种微妙的关联[30],这使得各区域农田与草地真菌多样性高低表现出相同趋势。从土壤群落分布可以看出,农田土壤主要受到作物类型与地理位置影响,呈明显差异。而草地土壤真菌群落变异率较大,分布较松散,PAN 等[31]研究同样证实,草地真菌网络连通性较低。复杂的土壤环境导致草地真菌群落的分布差异,多种因素调控其群落变化[32]。担子菌门和油壶菌门均为两种生态系统的标志差异物种,而子囊菌门是影响农田的重要真菌;球囊菌门和被孢霉门是造成草地土壤差异的重要真菌,这些核心类群在维持群落功能方面发挥着重要作用。真菌群落与土壤环境密切相关,对土壤因子与菌种的关系进一步探究,能间接反映土壤质量,采取措施能有效提高土壤微生物多样性。
4 结论
内蒙古农牧交错带农田和草地土壤优势真菌门均为子囊菌门、担子菌门、被孢霉门;农田土壤子囊菌门和被孢霉门总丰度高于草地土壤,草地土壤担子菌门总丰度高于农田,且各区域草地未知菌门的丰度均高于农田。土壤α 多样性指数分析表明,草地土壤多样性指数高于农田土壤。大兴安岭南麓农田和草地土壤多样性指数均较高。土壤β 多样性指数分析表明,农田土壤受地上植株和地理位置影响明显;而草地土壤组内变异率较大,组间无明显分布规律。随机森林分析表明,担子菌门、油壶菌门和子囊菌门(重要值>0.12)是农田土壤真菌组间差异的标志物种,而草地土壤真菌组间差异的标志物种(重要值>0.12)分别为担子菌门、油壶菌门、球囊菌门和被孢霉门。

