重组人型肿瘤坏死因子受体-抗体融合蛋白治疗活动性强直性脊柱炎对患者T淋巴细胞亚群和单核细胞CD36表达的影响*
王 倩,成善毅,罗 斌,李智伟△
1.新疆维吾尔自治区人民医院临床检验中心,新疆乌鲁木齐 830001;2.新疆医科大学,新疆乌鲁木齐 830011
强直性脊柱炎(AS)是一种以中轴性关节病变为特征的慢性进行性全身免疫系统疾病,可累及周围关节、内脏及其他组织,严重时可能导致患者躯体功能障碍甚至致残[1-2]。该病青壮年多发,男性患病率明显高于女性,国际上其比例为2∶1[3],有家族聚集性,可能与遗传相关[3]。其发病机制复杂,迄今未明。除遗传假说 (HLA-B27、内质网氨肽酶)和微生物感染假说(细菌、支原体)外,免疫假说也备受关注。关于免疫假说的研究主要集中于CD4+T淋巴细胞的亚群[如Th1、Th2、Th17、调节性T细胞(Treg)]调节异常及亚群紊乱[4-5]。CD36是一个表达于单核细胞、血小板、巨噬细胞的黏附分子和清道夫受体。最近有学者发现,单核细胞CD36的异常表达与AS病程也密切相关[6-7]。近年来,随着肿瘤坏死因子(TNF)抗体为代表的生物制剂的广泛应用,极大提高了AS临床症状的缓解率,减轻关节损害,并显著改善了疾病预后[8-10],使该病转为低活动状态。本文旨在比较活动性AS患者注射重组人型肿瘤坏死因子受体-抗体融合蛋白(RhTNFR-Fc)治疗前后患者外周血T淋巴细胞亚群比例和单核细胞CD36荧光强度的变化,探讨生物制剂治疗对活动性AS患者各指标的影响。
1 资料与方法
1.1一般资料 选取2017年1月至2019年12月于新疆维吾尔自治区人民医院风湿科首次进行生物制剂治疗的活动性AS患者作为研究对象,共78例,男57例(73.01%)、女21例(26.92%),年龄14~61岁。临床检查结果显示,78例活动性AS患者中骶髂关节CT Ⅰ级31例,Ⅱ级21例,Ⅲ级19例,Ⅳ级7例。将所有活动性AS患者按随机数字表法分为观察组和对照组,每组39例。两组患者性别、年龄、病程、骶髂关节CT分级、疾病类型、巴氏强直性脊柱炎疾病活动性指数(BASDAI)和巴氏强直性脊柱炎功能指数(BASFI)等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。见表1。同时,本研究选取同期在新疆维吾尔自治区人民医院体检的20例体检健康者作为健康对照组,且健康对照组研究对象的年龄、性别与活动性AS患者比较差异均无统计学意义(P>0.05)。本研究经新疆维吾尔自治区人民医院伦理委员会审核批准,患者及家属均签署知情同意书。
1.1.1活动性AS的诊断标准 AS的诊断基于1984年的纽约标准[11],且存在放射学诊断为骶髂关节炎的证据。采用BASDAI评分判断AS患者的疾病活动性,以BASDAI评分>4分定义为活动性AS。
1.1.2纳入标准 (1)明确诊断为AS(依据1984年修订的AS纽约标准);(2)治疗前为活动性AS;(3)入组前正在使用治疗AS的植物药制剂(如雷公藤、白芍总苷等)、沙利度胺或正在接受物理治疗的患者,需停用至少4周。
1.1.3排除标准 (1)患其他自身免疫性疾病,比如系统性红斑狼疮、炎性肠病及风湿性关节炎;(2)患血液性疾病、糖尿病、高血压、心血管疾病及传染性疾病;(3)有肝肾功能损伤、恶性肿瘤及精神性疾病;(4)接受过TNF生物制剂治疗。
1.2仪器与试剂
1.2.1仪器 全自动血液分析仪(深圳迈瑞公司生产,型号:BC-5390);流式细胞仪(美国BD公司生产,型号:BD FACS Canto)。
1.2.2试剂 CD3-FITC(美国BD公司生产,批号:554832)、CD4-FITC(美国BD公司生产,批号:553650)、CD8-PE(美国英杰生命技术有限公司生产,批号:MHCD0804)、CD14-PE(美国BD公司生产,批号:553740)、CD36-FITC(美国BD公司生产,批号:555454)、CD69-APC(美国BD公司生产,批号:555533)、IFN-γ-APC(美国BD公司生产,批号:341117)、IL-4-APC(美国BD公司生产,批号:554486)、CD183-PE(美国BD公司生产,批号: 551128)、CD196-APC(美国BD公司生产,批号:560619)、CD25-APC(美国BD公司生产,批号:555434)、CD127-PE(美国BD公司生产,批号:552543)、鞘液(美国BD公司生产,批号:342003)、Iono(上海碧云天生物技术有限公司生产,批号:S1672)、Monensin(上海宝曼生物科技有限公司生产,批号:K0048)、破膜剂+固定剂(杭州联科生物技术有限公司生产,批号:70-GAS003/2)、溶血素(美国BD公司生产,批号:349202)。

表1 两组患者基线资料比较
1.3方法
1.3.1治疗方案 对照组患者口服柳氮磺嘧啶,1 g/ d,小剂量非甾体抗炎药口服,连续用药6个月,进行治疗前、治疗后的疗效评估。观察组在对照组治疗基础上给予RhTNFR-Fc(商品名:强克,上海赛金生物医药有限公司生产,批准文号:国药准字S20110004)25 mg皮下注射,每周2次。当AS患者为低疾病活动度时,进行剂量递减个体化治疗;每2个月进行一次效果评估。
1.3.2标本采集 采集所有研究对象静脉血4 mL于乙二胺四乙酸(EDTA)抗凝管中,颠倒混匀,1 h内进行检验。
1.3.3单核细胞CD36的检测 取所有研究对象EDTA抗凝管新鲜血液50 μL加入CD14-PE和CD36-FITC抗体各10 μL标记单个核细胞,避光孵育,分析FITC和PE双阳性细胞单核细胞CD36的荧光强度。
1.3.4Th1、Th2细胞检测 取所有研究对象EDTA抗凝管新鲜血液加入PMA、Iono、Monensin刺激,放入37 ℃、5% CO2细胞培养箱中孵育4~6 h。取50 μL刺激后全血,加入CD3-FITC、CD8-PE抗体各10 μL,避光孵育20 min,加入BD溶血素孵育8 min,离心洗涤,经过固定、破膜后,分别加入IFN-γ-APC、IL-4-APC抗体10 μL避光孵育15 min后进行胞内染色。采用FACSCanto流式细胞仪测定外周血Th1(CD3+CD8-IFN-γ+)、Th2(CD3+CD8-IL-4+)细胞比例。
1.3.5Th17、Treg细胞检测 取所有研究对象EDTA抗凝管新鲜血液50 μL分别加入CD3-PerCP-Cy5-5、CD4-FITC、CD183-PE、CD196-APC标记Th17细胞,CD4-FITC、CD25-APC、CD127-PE标记Treg细胞,避光静置15 min,加BD溶血素避光静置8 min,离心、洗涤、重悬细胞于BD FACS Canto流式细胞仪检测外周血Th17(CD3+CD4+CD183-CD196+)、Treg(CD4+CD25+CD127low)细胞比例。
1.3.6红细胞沉降率(ESR)及C反应蛋白(CRP)指标检测 用109 mmol/L枸橼酸钠抗凝剂对血液标本进行抗凝,抗凝剂与血液按 1∶4的比例置于特制刻度测定管内,垂直立于室温中,1 h观察红细胞层下沉距离,用毫米(mm)报告结果,即ESR。CRP采用乳胶增强免疫比浊法在迈瑞全自动血液分析仪BC-5390上定量检测。
1.4观察指标 (1)记录健康对照组Th1、Th2、Th17、Treg细胞比例及单核细胞CD36荧光强度;(2)记录活动性AS患者注射RhTNFR-Fc治疗前及治疗2、4、6个月后ESR、CRP水平,Th1、Th2、Th17、Treg细胞比例及单核细胞CD36荧光强度;(3)记录活动性AS患者注射RhTNFR-Fc治疗2、4、6个月后BASDAI和BASFI评分;(4)分析骶髂关节CT分级、BASDAI评分和BASFI评分与 Th1、Th2、Th17、Treg细胞比例及单核细胞CD36荧光强度的相关性。

2 结 果
2.1两组患者临床病情活动度评估指标于治疗期间的变化比较 与治疗前相比,观察组患者在治疗后2、4、6个月后临床BASDAI评分、BASFI评分、CRP水平、ESR均明显降低(P<0.05),对照组患者治疗后4个月、6个月后临床BASDAI评分、BASFI评分、CRP水平、ESR均明显降低(P<0.05)。治疗2、4、6个月观察组BASDAI评分、BASFI评分均明显低于对照组(P<0.05),且观察组评分结果下降幅度明显大于对照组(P<0.05)。见表2。
2.2两组患者治疗前后及健康对照组Th1、Th2、Th17、Treg细胞比例及单核细胞CD36荧光强度 见表3。与健康对照组相比,治疗前活动性AS患者的Th1、Th17细胞比例明显增高(P<0.05),Th2、Treg细胞比例下降(P<0.05)。与治疗前相比,观察组患者在治疗2、4、6个月后Th1、Th17细胞比例明显下降(P<0.05),而单核细胞CD36荧光强度增高(P<0.05)。治疗2、4、6个月后观察组Th17细胞比例低于对照组(P<0.05),且观察组Th17细胞比例下降幅度明显大于对照组(P<0.05)。治疗2、4、6个月后观察组单核细胞CD36荧光强度高于对照组(P<0.05),且观察组升高幅度大于对照组(P<0.05)。
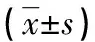
表2 两组患者治疗前后临床病情活动度评估指标的变化比较
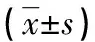
表3 两组患者治疗前后及健康对照组Th1、Th2、Th17、Treg细胞比例及单核细胞CD36荧光强度
2.3Th1、Th2、Th17、Treg细胞比例与骶髂关节CT分级、BASDAI评分和BASFI评分的相关性分析 由表4可见,Spearman 相关分析显示,活动性AS患者外周血Th1、Th17 细胞比例与骶髂关节CT分级、BASDAI评分和BASFI评分呈正相关(r>0,P<0.05)。
2.4单核细胞CD36荧光强度与外周血Th1、Th2、Th17、Treg 细胞比例及骶髂关节CT分级、BASDAI评分、BASFI评分的相关性分析 活动性AS患者单核细胞CD36荧光强度与外周血Th1细胞比例(r=-0.39,P=0.008)、Th17细胞比例(r=-0.36,P=0.016)及骶髂关节CT分级(r=-0.37,P=0.021)、BASDAI评分(r=-0.41,P=0.018)、BASFI评分(r=-0.43,P=0.015)呈负相关,与外周血Th2细胞(r=0.33,P=0.010)、Treg 细胞比例(r=0.31,P=0.016)呈正相关。

表4 活动性AS患者外周血Th1、Th2、Th17、Treg细胞比例与疾病相关评分的相关性分析
3 讨 论
目前,对TNF在自身免疫性疾病中的深入研究显示,该因子在自身免疫性疾病及炎性骨吸收等方面发挥了作用[12-13]。AS患者TNF-α水平明显升高,其不但可通过瀑布效应使免疫炎症放大,而且可通过对 IGF-1、Osx及 Run2 的抑制作用而抑制成骨细胞分化,并刺激破骨形成[14]。因此,研发以TNF为靶点的治疗性抗体以阻断TNF发挥生物学效应成为目前治疗AS的新策略。而目前对于TNF抑制剂治疗AS后对患者T淋巴细胞亚群和单核细胞CD36荧光强度的影响尚不清楚。
近年来,T淋巴细胞亚群在各类疾病治疗的监测中备受瞩目,目前有研究表明其与系统性红斑狼疮、类风湿关节炎等自身免疫性疾病的转归具有相关性[15-16]。活动性AS患者体内有大量活化的T淋巴细胞和单核细胞,同时被激活的Th1细胞能产生 IL-2、IL-10 和 TNF-α等细胞因子协同促进巨噬细胞、自然杀伤细胞等效应细胞的活化,通过上调细胞间黏附分子、血管细胞黏附分子的表达,进一步加剧骨关节破坏。IL-17还可调节黏附分子和Th1细胞,促进TNF-α的表达,进而促进炎性反应,在骨关节炎症的进程中,软骨细胞产生的TNF-α通过自分泌和旁分泌作用使关节损害放大[17]。本研究中利用临床研究分析了生物制剂治疗活动性AS前后T淋巴细胞亚群的动态变化,与健康对照组相比,治疗前活动性AS患者外周血Th17细胞比例显著高于健康对照组,Treg细胞比例则相反,提示在活动性AS患者体内Th17细胞处于激活状态,Treg细胞受到抑制,Th17细胞/Treg细胞免疫格局偏向Th17。据研究报道,Th1细胞通过分泌一系列细胞因子加剧机体炎性反应,引起组织炎症损伤[18]。在本研究中发现活动性AS患者外周血Th1细胞处于优势状态,Th1/Th2细胞亚群向Th1偏移,提示 Th1 细胞导致患者机体处于过度炎症状态。
活动性AS患者在常规治疗基础上联合应用RhTNFR-Fc,治疗2个月时,观察组BASDAI评分、BASFI评分、CRP、ESR改善程度明显优于对照组,表明RhTNFR-Fc能显著缓解临床症状,提高临床疗效。同时,治疗2个月时,观察组Th1和Th17细胞比例也较对照组明显减低,Treg细胞比例一定程度增高,提示RhTNFR-Fc可快速降低细胞免疫反应,有效改善T淋巴细胞亚群紊乱,减轻炎性反应,有利于缓解病情。有研究表明,IL-17可通过与TNF-α之间的协同效果,作用于微环境导致骨关节损害,从而促进AS的进展[19],RhTNFR-Fc作为TNF拮抗剂可以极大程度抑制TNF的活化表达,进一步抑制Th17细胞的增殖,减缓体内炎性反应状态。另一方面,本研究还发现活动性AS患者外周血Th2、Treg细胞比例与BASDAI评分和BASFI评分呈负相关,Th1、Th17 细胞比例与骶髂关节CT分级、BASDAI评分和BASFI评分呈正相关。本研究推测外周血T淋巴细胞比例与活动性AS患者的机体炎性反应密切相关,从炎性反应角度间接明确其对AS病情评估的作用。
CD36是一种存在于单核细胞、血小板、血管内皮细胞表面的清道夫受体,据报道发现其参与了动脉粥样硬化、炎症、血栓形成等众多生理和病理过程[20-22]。经深入研究证实,单核细胞CD36的表达与炎症性疾病、糖尿病、心血管疾病及脑卒中等均密切相关[23-24],而目前有学者发现该指标与AS也具有相关性[7-8]。研究表明:金属蛋白酶17缺失时CD36表达水平显著升高,体内巨噬细胞对凋亡细胞的摄取增加,促进了炎症的消退[25];另一方面,炎症因子可抑制CD36启动子的调节而减少CD36的表达[26-28]。此外,单核细胞CD36的表达在机体中与过氧化物酶体增殖物激活受体及TNF呈负相关[29],可推测单核细胞CD36的表达可能受机体炎症的影响。本研究证实,单核细胞CD36荧光强度在活动性AS患者中下调。观察组在治疗前与治疗2、4、6个月后相比,单核细胞CD36荧光强度明显增高,推测单核细胞CD36参与了AS转归的这一过程,RhTNFR-Fc治疗可能缓解机体炎症状态,恢复单核细胞CD36的表达。
CD36通过过氧化物酶体增殖物激活受体β信号通路对线粒体适应性进行调控,对Treg细胞进行编程使其适应富含乳酸的肿瘤微环境。据报道,某研究团队近日取得一项新成果:在肿瘤内Treg细胞中,CD36作为中央代谢调节剂而被选择性上调;进一步研究发现,CD36缺陷型小鼠的肿瘤负荷情况有所减轻,肿瘤内的Treg细胞数量与功能皆下降,而健康组织Treg数量和功能却无变化,CD36缺乏症可使肿瘤内Treg线粒体的数量和功能下降,导致细胞凋亡[30]。在本研究中发现,单核细胞CD36荧光强度与Treg 细胞比例呈正相关,证实了单核细胞CD36的表达与Treg细胞密切相关,而具体作用机制还亟待深入研究。
综上所述,RhTNFR-Fc通过干预TNF过表达而发挥作用。本研究提示RhTNFR-Fc联合非甾体类药物共同治疗活动性AS起效快,可有效缓解活动性AS临床症状,达到协同用药效果。此外,活动性AS炎症与T淋巴细胞亚群动态变化密切相关,经RhTNFR-Fc治疗可调节免疫细胞平衡,抑制Th1、Th17细胞驱动的炎性反应,Treg细胞则随治疗时间的延长而逐渐回升,缓解病情发展。通过初步了解RhTNFR-Fc治疗活动性AS后患者外周血T淋巴细胞亚群的动态变化,本研究团队推测Th1、Th17、Treg细胞日后可能会成为RhTNFR-Fc治疗活动性AS的疗效监测指标,这将有助于临床了解患者机体免疫细胞紊乱情况,及时干预治疗。此外,单核细胞CD36荧光强度可以提示活动性AS患者机体炎症状况。经RhTNFR-Fc治疗后炎症负荷缓解,单核细胞CD36表达增高,可间接评估AS患者疾病活动度。单核细胞CD36荧光强度与Treg细胞比例也密切相关,在TNF拮抗剂治疗后二者明显回升,可缓解机体局部及全身炎性反应,减少骨损伤。

