黑曲霉拮抗菌Xenorhabdus bovienii 445筛选、鉴定及发酵优化
高宇洁,詹发强,,陈 澄,包慧芳,杨 蓉,王 宁,侯新强,侯 敏,史应武,龙宣杞,
(1.新疆大学生命科学与技术学院,乌鲁木齐 830046;2.新疆农业科学院微生物应用研究所/新疆特殊环境微生物重点实验室,乌鲁木齐 830091)
0 引 言
【研究意义】新疆葡萄种植面积一直居全国首位,2018年达到14.29×104hm2,占全国葡萄种植面积的19.7%[1]。葡萄果实含水量较高,在贮藏过程中容易受到微生物污染产生腐烂,霉菌侵染是引起生鲜葡萄采后霉变腐烂的主要原因[2]。我国每年因此而导致的葡萄等大宗果蔬损失占其总产量的30 %~40 %,尤其在常温、亚常温的运输和销售过程中,挤压及机械伤口极易引起黑曲霉(Aspergillusniger)大范围感染,即黑粉病,多发生在葡萄果柄基部或果粒伤口处[3],导致果蔬失去其食用价值和商品价值[4]。昆虫病原线虫共生菌不仅能产生对昆虫有杀伤作用的毒素,还能产生其它代谢产物[5],如胞外酶、胞内晶体蛋白、色素、荧光素和抑菌物质等。【前人研究进展】目前,国内外常用葡萄保鲜方式主要有物理保鲜、化学保鲜和生物保鲜3大类[6]。生物防治具有无毒、无害、残留量低等优点。研究表明,昆虫病原线虫共生菌对植物病原菌具有较好的抑菌效果[7、8、9、10],主要集中在生物防治番茄灰霉病、大豆疫霉病,辣椒疫霉病、苹果轮纹病[11]、苹果腐烂病和苹果灰霉病等。【本研究切入点】昆虫病原线虫共生细菌具有广谱高效的抑菌作用,目前应用于果蔬采后保鲜的生防菌有酵母菌[12]、芽孢杆菌[13]、荧光假单胞菌[14]、乳酸菌[15]等,利用昆虫病原线虫共生菌作为生防菌株的研究较少。需从现有共生细菌资源中筛选对黑曲霉具有高拮抗作用的菌株。【拟解决的关键问题】利用昆虫病原线虫共生细菌广谱高效的抑菌特性,以黑曲霉为靶标菌,从现有昆虫病原线虫共生细菌资源中筛选对葡萄黑曲霉具有高拮抗作用的共生细菌,通过单因素筛选和响应面分析法优化菌株培养条件,防效试验验证拮抗细菌防治效果,为葡萄采后黑曲霉感染的生物防治提供新的生物材料和相关研究基础。
1 材料与方法
1.1 材 料
供试病原菌:黑曲霉(Aspergillusniger)(GenBank ID:MT832028)由新疆农业科学院农产品贮藏与加工研究所提供。所用菌株均为实验室保存。表1

表 1 供试昆虫病原线虫共生菌Table 1 Test strains of Entomopathogenic nematode symbiotic bacteria
供试培养基:NBTA培养基(在NA培养基中加入0.04%三苯基四氮唑(w/v)和0.002 5%溴百里酚蓝(w/v));休和利夫森二氏培养基、明胶培养基(Nutrient Gelatin Medium)、尿素试验培养基(Urea Medium)[16],用于生理生化特征测定试验。
供试昆虫:大蜡螟老熟幼虫Galleriamellonella,本实验室繁殖保存。
营养琼脂(Nutrient Agar)培养基、营养肉汤( Nutrient Broth)培养基、MRS 肉汤培养基、MRS 琼脂培养基、琼脂粉等购自北京奥博星生物技术有限责任公司;DP302-02(离心柱型)细菌基因组 DNA 提取试剂盒,天根生化科技(北京)有限公司。
1.2 方 法
1.2.1 昆虫病原线虫共生菌的分离、纯化及保藏
在直径为9 cm的培养皿底部铺一层灭菌滤纸,加入1 mL 1 000 IJs/mL的昆虫病原线虫液均匀滴于滤纸上,放入5头新鲜健康的大蜡螟幼虫,用不同品系昆虫病原线虫侵染。
将被线虫致死的大蜡螟幼虫在无菌条件下用75%(体积分数)乙醇表面消毒30 s,重复 2 次;用无菌剪刀剪去大蜡螟第 5 或第 6 对腹足,用接种针沾取血淋巴于NBTA平板培养基上划线,28 ℃暗培养 2~3 d,可吸附色素并在其周围形成透明圈的菌落即为目标菌落。挑取蓝色初生型单菌落于NBTA平板划线纯化并接于20 %甘油管-80 ℃保存,备用。
1.2.2 拮抗黑曲霉的昆虫病原线虫共生菌筛选
1.2.2.1 初 筛
采用平板对峙法,在NA培养基平板上同时接种黑曲霉和共生菌培养 3~5 d,每组处理设置3个重复,以只接病原菌作对照,观察是否有拮抗效果,记录病原菌生长半径,计算抑菌率:
抑菌率(%)=(对照组病原菌菌落半径-处理组菌落半径)/对照组病原菌菌落半径×100。
1.2.2.2 复 筛
根据初筛结果,挑取对黑曲霉具有显著抑菌效果的单菌落接种至NB培养基中,180 r/min、28 ℃振荡培养12 h,得种子液。将种子液按2 %接种量接于NB培养基中,180 r/min、28 ℃振荡培养72 h,得发酵液,于4 ℃条件下,10 000 r/min离心10 min,所得上清经0.22 μm滤膜过滤除菌的发酵滤液,离心沉淀用 0.9 % NaCl 溶液清洗2次,将最终所得沉淀物用蒸馏水重悬制成菌悬液。
采用预加菌液倾注平板法结合打孔法,确认拮抗菌的抑菌效果。
向已冷却至50 ℃左右的平板培养基中注入1×106spores/mL的黑曲霉孢子悬液,混合均匀,倾注平板,水平静置凝固后备用。用8 mm的无菌打孔器在试验平板上打孔,挑去培养基小块以做成圆孔,向孔中注入200 μL发酵液,4 ℃预扩散2 h,28 ℃培养48 h,观察并测量抑菌圈大小,并计算抑菌效价。
抑菌效价(cm/mL)=(抑菌圈直径-打孔器直径)/ 发酵液体积×100。
1.2.3 拮抗黑曲霉的昆虫病原线虫共生菌鉴定1.2.3.1 生理生化特征测定
分离得到的供试菌株进行生理生化检测[14],检测内容包括明胶液化、接触酶、葡萄糖发酵和蔗糖利用等生理生化指标。
1.2.3.2 分子生物学鉴定
根据天根生化科技(北京)有限公司的DP302-02(离心柱型)细菌基因组 DNA 提取试剂盒要求,提取菌体总DNA。
以提取的细菌基因组 DNA 为模板,使用细菌16S rRNA 通用引物27F(5′-TCC TCC GCT TAT TGA TAT GC-3′)和1492R (5′-CAA ACT TGG TCA TTA GAG GA-3′)进行PCR扩增。
PCR反应体系:1× PCR预混液25 μL,上下游引物27F和1492R (10 μmol/L)各1 μL,ddH2O 23 μL。
PCR反应条件:94 ℃ 5 min;94℃ 30 s,54℃ 30 s,72 ℃ 1 min 30 s,35个循环;72 ℃ 10 min。PCR扩增产物经1.0 %琼脂糖电泳检测后送至北京鼎国昌盛生物技术有限责任公司测序。所得序列提交至GenBank并利用BLAST相似序列检索比对,使用MEGA 7.0软件进行多序列同源性分析,并采用邻接法(Neighbor-Joining Method)构建系统进化树。
1.2.4Xenorhabdusbovienii445生长量测定
取菌株种子液(OD600约为1),按2 %接种量转接至盛有100 mL NB培养基的250 mL三角瓶,平行三组,置于28 ℃,180 r/min的摇床摇瓶培养,每隔2 h取样,测菌液的OD600,取平均值,直至取到72 h。以取样时间为横坐标,光密度值OD600为纵坐标,绘制生长曲线。
1.2.5Xenorhabdusbovienii445抑制黑曲霉发酵条件优化1.2.5.1 不同单因素发酵条件筛选
选取不同种龄(6、8、10、12、14 h)、接种量(1%、2%、3%、4%、5%)、装液量(50、80、100、120 mL/250 mL)、发酵时间(24、36、48、72、96 h)、pH(5、6、7、8、9)、温度(26、28、30、32、35 ℃)进行单因素试验,各处理均在培养后,按照复筛方法检测抑菌活性,以抑菌圈直径作为指标。
1.2.5.2 响应面法发酵条件优化设计
采用中心组合试验Box-Behnken 设计方案,对抑菌活性影响最显著的3个因素接种量(%)、pH、装液量(mL),分别用A、B、C来表示,+1、0、-1 分别代表变量的水平,发酵液的抑菌圈直径Y表示响应值,每组试验重复 3 次。表2

表 2 Box-Behnken 设计因素水平编码Table 2 Factors and levels of Box-Behnken design
1.2.6Xenorhabdusbovienii445对黑曲霉的防效测定
葡萄果实处理参考李丽梅等[2]方法。挑选大小、色泽及成熟度一致的果粒,将葡萄果粒从叶茎上剪下,防止葡萄果粒干枯,每个葡萄果粒上留有5 mm的果梗。将葡萄果粒浸入无菌的2 %次氯酸钠溶液中表面消毒2 min,用无菌水冲洗以去除残留的次氯酸钠溶液,置于无菌操作台中晾干。待葡萄果粒表面无水分残留时,用无菌牙签刺破果实赤道部位3 mm×3 mm×5 mm的伤口,处理组果实伤口处分别加入10 μL拮抗菌共生菌发酵液,2 h后加入10 μL病原菌孢子悬浮液(104spores/mL),于室温(25 ℃)下放置1 h,待果实风干至伤口边缘无流动液体后置于无菌培养皿盖中,用保鲜膜进行密封,以 25 ℃/ 93 %湿度恒温保湿培养,每天观察并测量伤口处病斑大小和腐烂率,对照组加入无菌水和病原菌孢子悬浮液。
腐烂率(%)=(每个处理中果实腐烂的个数)/(每个处理中果实总数)×100;
防治效果(%)=(对照组病斑直径-处理组病斑直径)/(对照组病斑直径-刺孔直径)×100。
1.3 数据处理
采用SPSS 22.0 统计软件分析,这用 LSD 法和Duncan’s 多重比较检验法分析数据和差异显著性检验(P<0.05),利用Microsoft Excel 2010软件作图,采用 Design-Expert (version 8.0.6)统计软件进行响应面设计与分析。
2 结果与分析
2.1 不同共生菌对黑曲霉的抑制效果
研究表明,初筛得到的20株共生细菌对黑曲霉抑制率均超过58%以上,其中抑菌率最大为65.00%(B5),最小为58.49%(sf-ZMHYL),其中抑菌率超过62% 6个菌株为B5、445、NLKSD 3-1、YC、ALL和sf-scp,抑制率分别为65.00%、64.92%、64.30%、63.58%、62.86%和62.25%,针对这6株菌进行复筛。图1,表3
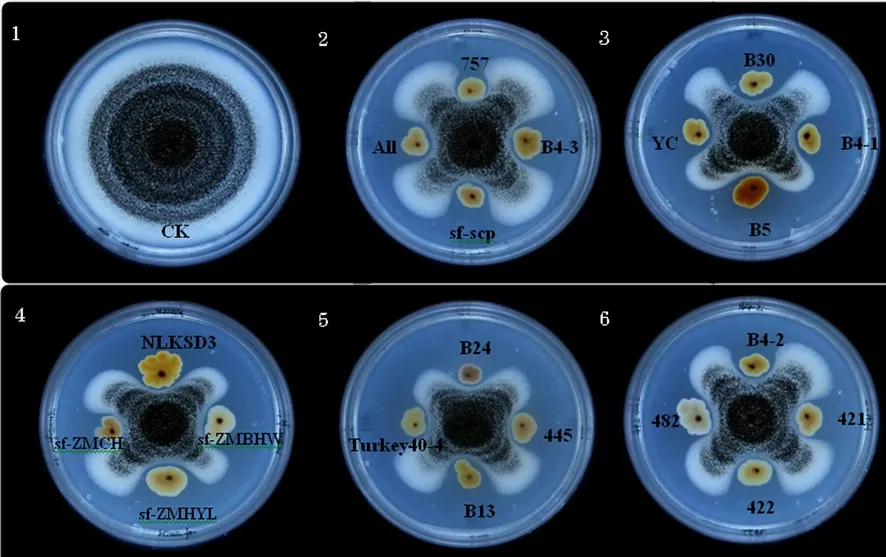
图 1 不同共生细菌菌株对黑曲霉Aspergillus niger的抑制效果Fig.1 Antagonistic effects of different symbiotic bacteria strains on Aspergillus niger

表 3 不同共生菌株对黑曲霉的抑制率Table 3 Inhibition rate of Aspergillus niger by different symbiotic strains
菌株445抑菌圈直径最大为(23.72±0.61) mm,抑菌效价为7.61 cm/mL,并显著高于其它4株共生菌(P<0.05)。图2,表 4

注:
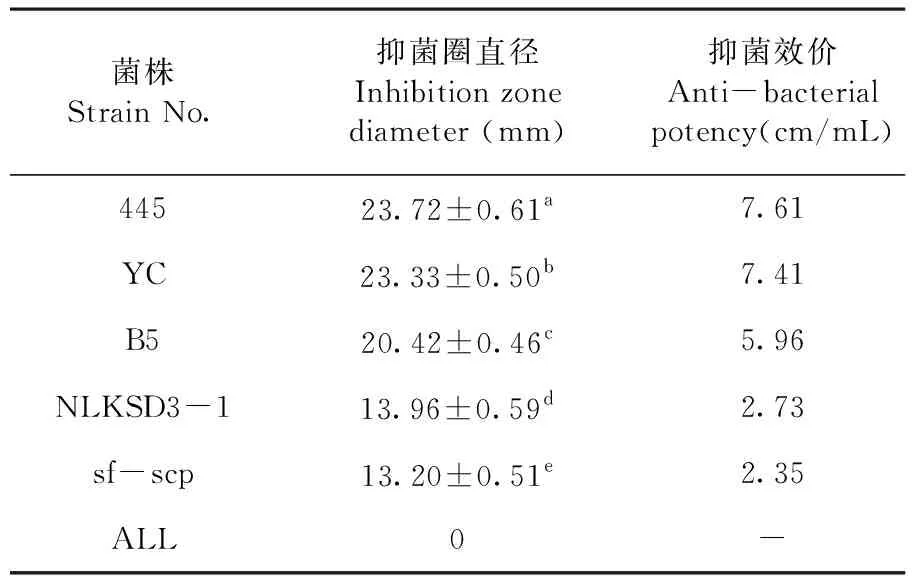
表4 不同共生菌株对黑曲霉的抑制效果Table 4 The inhibitory effect of different symbiotic strains on Aspergillus niger
2.2 Xenorhabdus bovienii 445的鉴定结果
2.2.1Xenorhabdusbovienii445菌落形态及生理生化特征
研究表明,菌株445可在浓度为2%的NaCl溶液中生存,可水解油脂、氧化葡萄糖酸盐,可利用葡萄糖、乳糖进行发酵。图3,表5
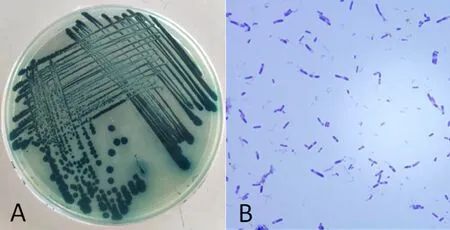
图 3 A:Xenorhabdus bovienii 445菌落形态; B:Xenorhabdus bovienii 445革兰氏染色Fig.3 A: Colonial morphology of Xenorhabdus bovienii 445; B: Gram staining of Xenorhabdus bovienii 445

表5 Xenorhabdus bovienii 445主要生理生化特征Table 5 Main physiological and biochemical test of Xenorhabdus bovienii 445
2.2.2 分子生物学鉴定
研究表明,菌株445的16S rRNA与Xenorhabdusbovieniistrain Xb139 (MG995576.1)聚于同一分支,相似性达99.79%,结合菌落形态及生理生化特征,445(GeneBank ID:OK560680)菌株为伯氏致病杆菌Xenorhabdusbovienii。图4

注:分支处数值表示 Bootstrap 值;括号内数字表示序列 GeneBank 登录号;标尺为进化距离
2.3 Xenorhabdus bovienii 445在不同时间内生长量变化
研究表明,Xenorhabdusbovienii 445的生长曲线,0~6 h 为延迟生长期,6~14 h 为对数生长期,14 h以后进入稳定生长期。图5

图 5 Xenorhabdus bovienii 445 的生长曲线Fig.5 The growth curve of Xenorhabdus bovienii 445
2.4 Xenorhabdus bovienii 445抑制黑曲霉发酵条件优化结果
2.4.1 单因素试验筛选结果
研究表明,在培养条件分别为种龄8 h,接种量3 %,pH 7.0,装液量为100 mL/250 mL,温度28℃,发酵时间36 h时Xenorhabdusbovienii445对黑曲霉的抑菌活性较高,其中,接种量、pH和装液量对抑菌活性影响显著高于其它单个因素(P<0.05)。图6
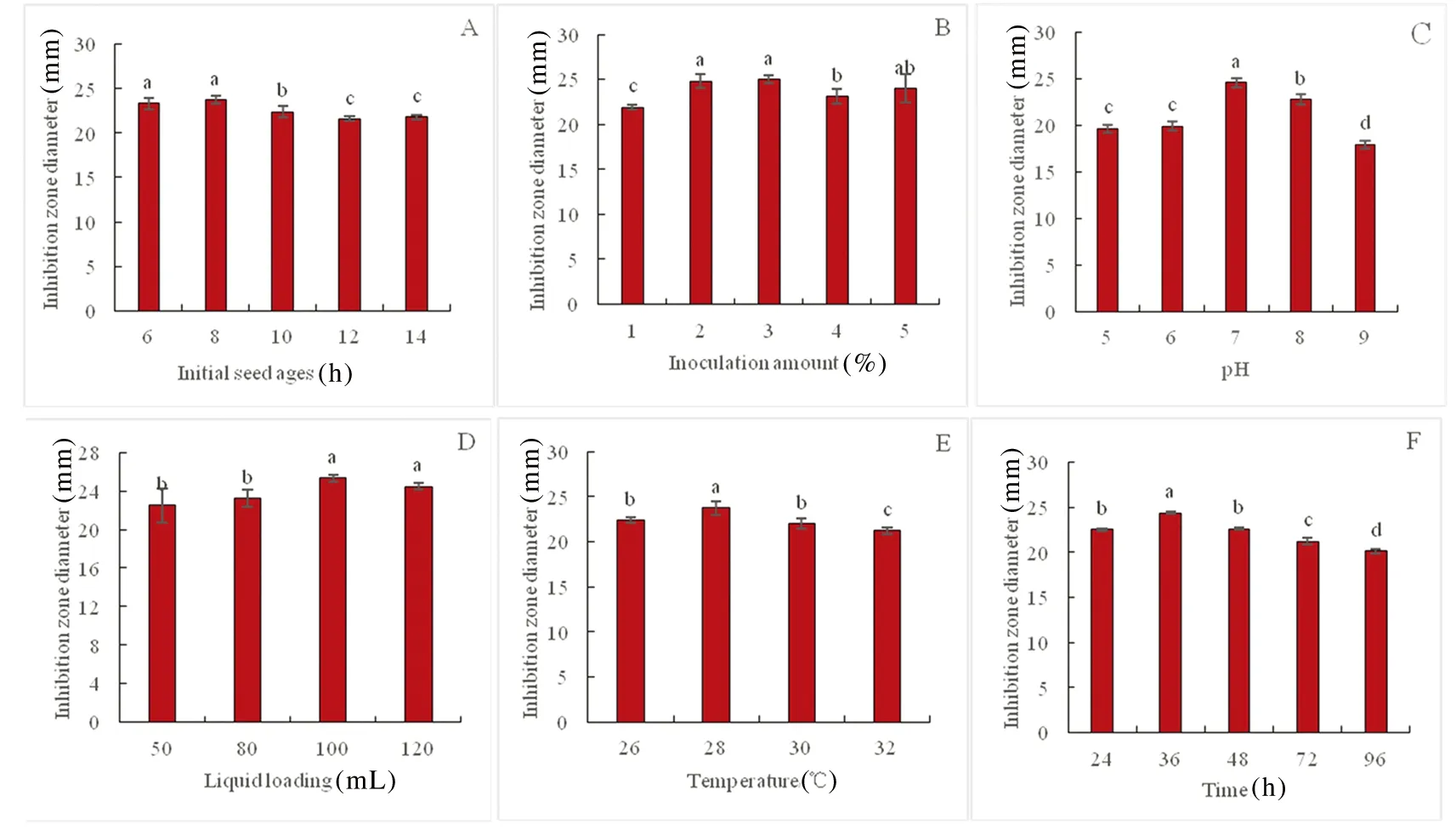
图 6 不同初始种龄(A)、接种量(B)、pH(C)、装液量(D)、时间(E)和 温度(F)对Xenorhabdus bovienii 445 抑菌活性的影响Fig.6 Effects of different initial seed ages (A),inoculum concentration (B), pH (C), liquid loading (D), time (E), and temperature (F) on the inhibitory activity of Xenorhabdus bovienii 445
2.4.2 响应面法发酵条件优化2.4.2.1 Box-behnken组合结果
研究表明,17个试验点中12个是析因点,5个是零点,析因点是自变量取值在 A、B、C所构成的三维顶点,零点表示区域的中心点,其中重复零点试验 5 次,用以估算试验误差。表 6
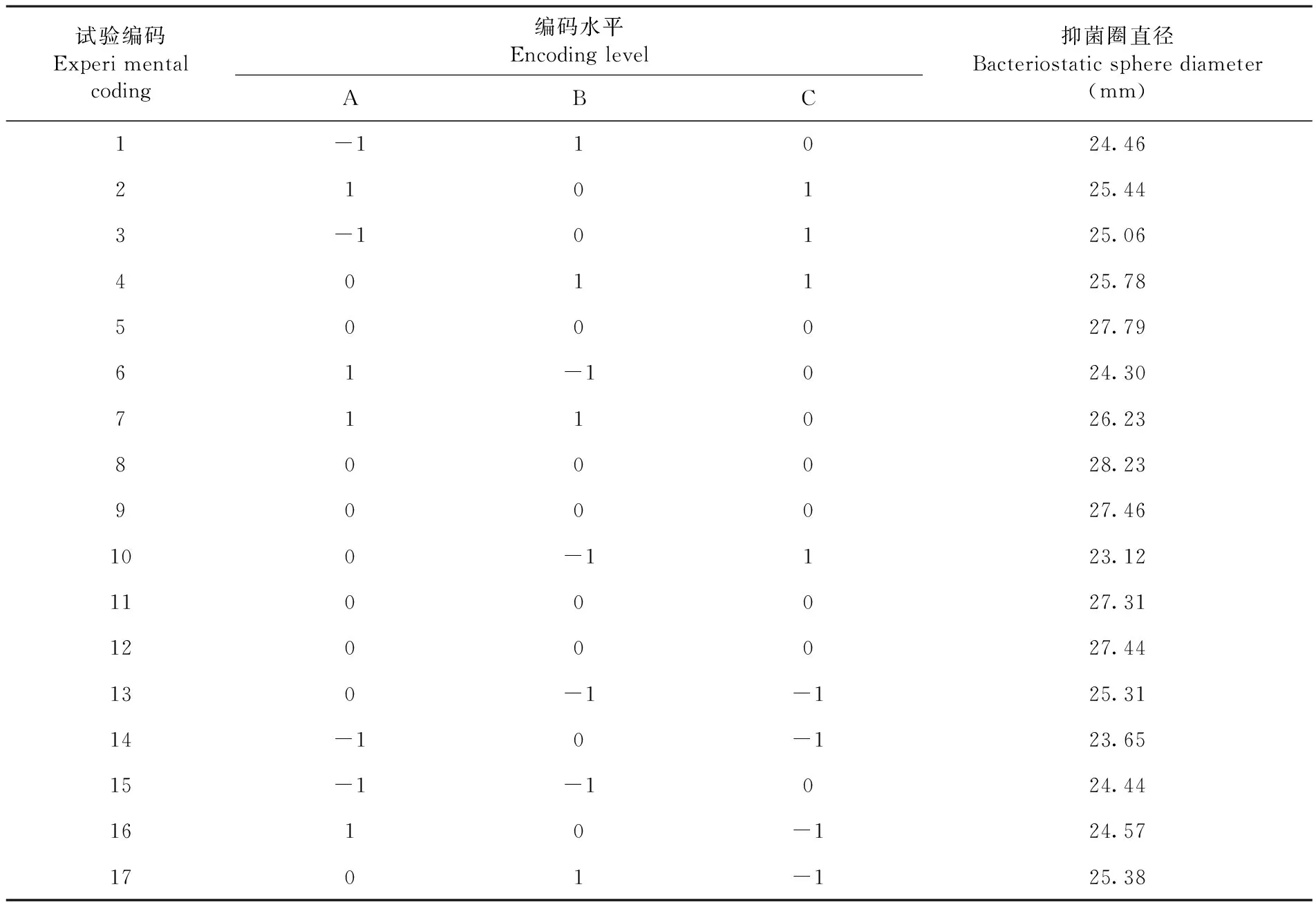
表 6 不同试验编码下菌株 445抑菌活性变化Table 6 Effect of different test sites on the antibacterial activity of strain 445
2.4.2.2 回归模型的建立与方差
研究表明,Xenorhabdusbovienii445发酵液抑菌圈直径(Y)对接种量(A)、pH(B)、装液量(C)的多项回归方程:
Y=27.65+0.37A+0.59B+0.061C+0.48AB-0.13AC+0.65BC-1.50A2-1.29B2-1.46C2
F值为10.03,相关系数R2= 0.9280,P< 0.01,达到显著水平,失拟项的P= 0.0721 > 0.05不显著,说明该模型拟合程度较好,试验误差小,用此模型预测Xenorhabdusbovienii445发酵条件对抑菌活性的影响。B的一次项显著(P< 0.05),A、B、C二次项极显著(P< 0.01),其他项均不显著。各因素对抑菌活性影响的主次顺利为B > A > C,即pH >接种量>装液量。图2,表7

表 7 二次回归模型的方差显著性Table 7 Significance of the variance in the quadratic regression model

图7 两因素交互作用下抑菌圈直径变化Fig.7 Influence of interaction of two factors on the diameter of bacteriostatic zone
2.4.2.3Xenorhabdusbovienii445发酵条件优化后模型验证
研究表明,Xenorhabdusbovienii445抑菌活性的最优培养条件为接种量3.06 %、pH 7.0、装液量100.15 mL/250 mL,在此条件下抑菌圈直径为(29.67±0.28) mm。在最适条件下经过 3 组重复性试验,抑菌圈的平均直径为 29.63 mm,仅比预测值小0.04 mm,无显著性差异(P> 0.05),拟合度良好,确定模型条件可以用于预测实际值,此方程有效可靠。在此条件下抑菌效价为10.59 cm/mL,比优化前提高了39.16%。
2.5 Xenorhabdus bovienii 445对黑曲霉的防效测定
研究表明,室温条件下(25±1℃)第3 d时,CK组开始发病,发病率为6 %,第4 d时,CK组发病率达到54 %,而Xenorhabdusbovienii445发酵液处理后发病率为32%。研究表明,室温贮藏6 d之内,处理组发病率显著低于CK组(P< 0.05),至第7 d时,对照和处理组葡萄果实全部发病。表8

注: A、B为优化后的抑菌效果;C、D为优化前的抑菌效果
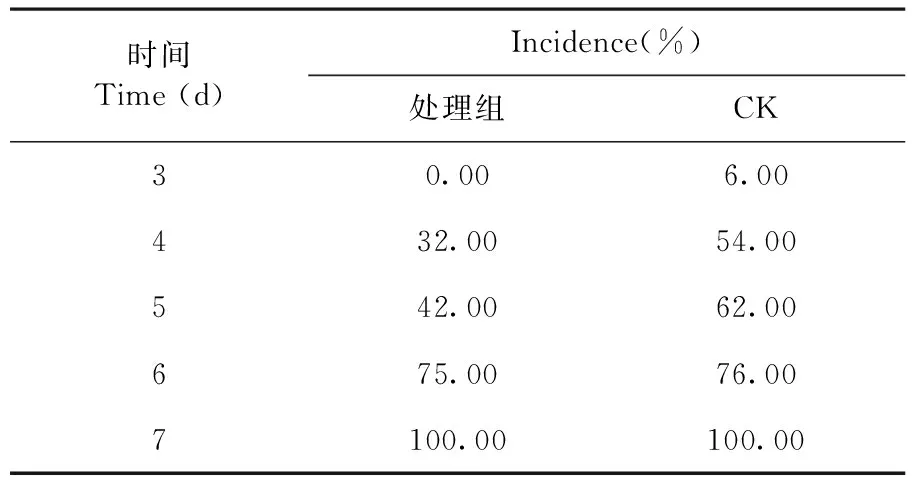
表 8 3~7 d内处理组与CK组的发病率Table 8 Incidence rate of treatment group and control group within 3-7 days
葡萄果实接种黑曲霉后,病斑直径随贮藏时间的推移逐渐增大。在整个常温实验期间CK组病斑直径逐渐增大,且始终大于发酵液处理组果实的病斑直径。发酵液处理可显著抑制果实病斑的扩展(P< 0.05),在25 ℃条件下贮藏至第4 d,Xenorhabdusbovienii445发酵液处理组葡萄果实病斑直径为(6.01±0.40) mm,对于葡萄采后病原菌黑曲霉的防治效果达到61.30 %,Xenorhabdusbovienii445发酵液可有效控制黑曲霉对葡萄果实的侵染,能够显著延缓葡萄腐烂。图9,表 9
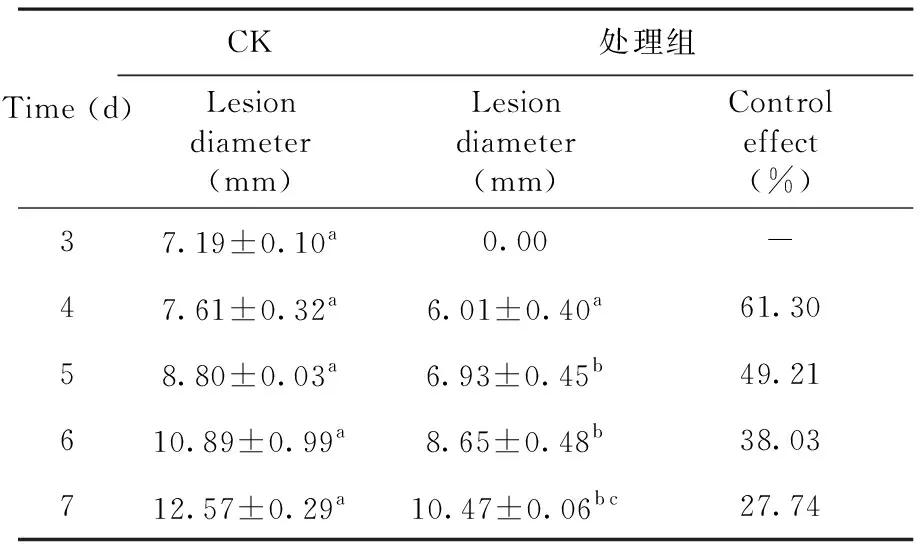
表 9 3~7 d内Xenorhabdus bovienii 445对黑曲霉的抑制效果Table 9 The inhibitory effect of Xenorhabdus bovienii 445 on Aspergillus niger within 3-7 days

图 9 Xenorhabdus bovienii 445在葡萄果实上对黑曲霉的防治效果 Fig.9 Control effect of Xenorhabdus bovienii 445 on Aspergillus niger in grape fruit
3 讨 论
目前国内外在昆虫病原线虫共生菌资源收集、鉴定等方面做了大量研究工作,已发现一批具有应用开发前景的优良菌株,相关共生菌次级代谢物质已被开发成为杀虫剂[17]、杀菌剂[18]等,是微生物源农药的重要来源之一。
当前,利用昆虫病原线虫共生菌防治葡萄采后黑曲霉病害国内外鲜有报道,但是利用昆虫病原线虫共生菌防治其它植物病原菌已有部分报道。张园[9]等报道了线虫致病杆菌HB310发酵上清液对苹果灰霉病原菌菌丝抑制率为30.35%,且对苹果轮纹菌和腐烂菌菌丝生长、孢子萌发具有良好的抑制效果。张潘杰[19]等研究发现伯氏致病杆菌NN6的10%发酵无菌滤液对禾谷镰刀菌的菌丝抑制率为55.21%,孢子萌发抑制率为100%,具有极显著的抑制活性。窦振国[20]等通过硫酸铵沉淀伯氏致病杆菌NN6的胞外蛋白,其具有良好的抑菌作用,对禾谷镰刀菌菌丝生长和孢子萌发的IC50分别为517.37和47.86 μg/mL。Chacón Orozco Julie G.[21]等研究表明,Xenorhabdusszentirmaii的发酵滤液可以抑制大豆核盘菌Sclerotiniasclerotiorum菌丝生长且抑制率达98%以上,而细菌培养产生的挥发物可以完全抑制菌丝生长和菌核生成;将Xenorhabdusszentirmaii的发酵液稀释至33%并涂在大豆种子上,与对照组相比,发酵液稀释液可抑制核盘菌提高种子萌发率(78.3%)。Li Bo[22]等发现一株昆虫病原线虫共生细菌XenorhabdusbudapestensisC72对南方玉米叶枯病 (SCLB) 的菌丝生长和孢子萌发具有显著的抑制作用,温室和田间试验的相对防治效果分别达到59.15%和77.96%,与杀菌剂的效果相当。研究以黑曲霉病菌为指示菌,利用实验室现有的共生菌资源,进行了拮抗菌株的筛选,筛选出1 株有显著抑菌作用的Xenorhabdusbovienii445,其抑菌圈可达(23.72±0.61) mm,其抑菌效价为7.61 cm/mL。
实验室先前筛选得到的嗜线虫致病杆菌ALL在葡萄灰霉病防治实验中表现出良好的防治效果[23],而在研究中,嗜线虫致病杆菌ALL对于黑曲霉的抑制效果显著低于伯氏致病杆菌445,可能是由于致病杆菌属不同菌株所产生的抑菌物质种类和产量有所区别。通过适当发酵方法,昆虫病原线虫共生菌能产生并积累较多活性物质,并可相应提高活性物质的抑菌活性。优化生防菌培养液组成成分和培养条件,可以促进菌体的生长量增加,并提高抗菌活性物质的产量及防效[24]。
响应面分析法通过局部试验回归拟合因素与结果间的全局函数关系,得到准确有效的试验结论,能在整个考察区域上确定各个因素的最佳组合及最优响应值,可信度高[25]。Wang Yonghong[26]等采用响应面法优化了伯氏致病杆菌YL002产抗生素的培养基成分,获得了较高的抗生素活性(337.5U/mL),优化后其抗生素活性总体提高了37.8%。研究采用单因素试验结合响应面分析法,对Xenorhabdusbovienii445抑菌活性的培养条件进行了优化,最佳条件为接种量3.06 %、pH 7.0、装液量100.15 mL/250 mL,在此条件下抑菌圈直径为(29.67±0.28) mm,抑菌效价为10.59 cm/mL,比优化前提高了39.16%。王永娟[27]等针对嗜线虫致病杆菌HB310菌株抑菌活性对发酵培养的因素进行了筛选优化,得出的接种量、装液量和培养基初始pH值的结论与本研究一致,致病杆菌属共生菌抑菌物质产生的最适条件具有一定的相似性。
张磊[28]等利用新疆无核白葡萄为试材,采用500 μL/L的H2S气体对葡萄果实进行间歇熏蒸,可有效控制常温条件下葡萄采后黑曲霉的生长和病斑直径的扩展,贮藏至第2 d,葡萄果实开始腐烂,贮藏至第3 d,H2S处理组和对照组葡萄果实的病斑直径分别为10.8 mm和14.3 mm,H2S处理组果实的病斑直径比对照果实的病斑直径小24.5 %。研究中,发酵液处理后在第四天开始腐烂,腐烂率为32 %,果实病斑直径为(6.01±0.40) mm;CK此时的腐烂率为54 %,病斑直径为(7.61±0.32) mm,处理组果实病斑直径比对照组果实低了21.02 %。室温条件下,研究利用昆虫病原线虫共生菌株Xenorhabdusbovienii445发酵液生物防治葡萄黑曲霉与使用H2S气体熏蒸的物理方法达到了相似的防治效果。后续研究将进一步聚焦抑菌活性物质的分离纯化、鉴定以及相关代谢产物的功能特性分析等。
4 结 论
初筛筛选出6株抑菌率超过62%的菌株,通过复筛筛选出1株有显著抑菌作用的共生细菌,经鉴定为伯氏致病杆菌Xenorhabdusbovienii(OK560680)。确定该菌株抑菌活性的最优培养条件为:接种量3.06 %、pH 7.0、装液量100.15 mL/250 mL,在此条件下抑菌圈直径为(29.67±0.28) mm,抑菌效价为10.59 cm/mL,比优化前提高了39.16 %。在常温条件下对葡萄进行损伤接种的防效试验中,Xenorhabdusbovienii445发酵液具有显著的抑制黑曲霉、延缓葡萄腐烂的作用。应用昆虫病原线虫共生细菌防治葡萄贮期黑曲霉侵染,具有较好的生防潜能。

