红枣多糖提取工艺优化及颗粒剂的研制*
赵亚飞, 李春梅, 闵伊婷, 谢 婕
(哈尔滨商业大学药学院, 黑龙江 哈尔滨 150070)
红枣,又名大枣,是鼠李科枣属植物枣Ziziphuszizyphus.var.iuermis(Bunge)Rehd.的成熟果实,含有丰富的营养物质[1]。据文献报道,红枣水提物中主要成分为多糖类、核苷类和黄酮类3种[2-5]。除此之外还有蛋白质,氨基酸,维生素等成分。红枣多糖是红枣中一类重要活性成分,研究表明,红枣多糖具有增强免疫力、抗病毒、抗肿瘤、抗感染、抗氧化[6-7]、抗衰老、抗疲劳[8]、降血脂[9]、保肝和免疫调节等多种生理活性[10]。红枣是我国传统“药食同源”的一种中药,集保健和食用于一体。口感好,是一种不可多得的优良补品。中国红枣的研究,在国内和国外报道与研究均很少。本实验通过对红枣中多糖提取工艺的优化及辅料筛选,研制出红枣多糖颗粒剂,为进一步将红枣多糖作为保健食品或药品开发提供研究基础。
1 实 验
1.1 仪器与设备
CP224S型分析天平,北京赛多利斯仪器系统有限公司;电子调温加热套,天津泰斯特仪器有限公司;UV-5200PC紫外可见分光光度计,上海元析仪器有限公司;数显恒温水浴锅,常州市恒久仪器制造有限公司;电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂。
1.2 实验药品与材料
红枣:产地:新疆图木舒克市,购于人民同泰药店。
无水乙醇、丙酮、浓硫酸、5%苯酚溶液、标准葡萄糖、氢氧化钠、丙三醇、3,5-二硝基水杨酸、糖粉、糊精、淀粉、乳糖、微晶纤维素等均为分析纯。
2 内容与方法
2.1 红枣多糖的提取
红枣多糖的提取采用热水浸提法。将红枣洗净,粉碎,过40目筛,按照1:10料液比加入蒸馏水,于60 ℃条件下提取2 h,过滤,合并滤液,真空过滤,浓缩后向提取液中缓慢加入3倍体积的无水乙醇,放置过夜充分沉淀,减压抽滤,将沉淀分别以无水乙醇、丙酮反复洗涤后,真空干燥后得粗多糖粉末备用。
2.2 总糖含量的测定
粗多糖中的总糖含量测定使用苯酚-硫酸法,还原糖含量测定采用3,5-二硝基水杨酸(DNS)法,多糖含量等于总糖含量减去还原糖含量。苯酚-硫酸法测总糖是先用浓硫酸把原多糖断裂,再和苯酚反应显橙黄色,颜色稳定,且在490 nm处有最大吸收,测出的吸光度值与糖含量呈线性正比关系。
2.2.1 对照品溶液制备
精确称取在105 ℃温度条件下烘干至恒重的葡萄糖粉末50 mg,将其放于500 mL的容量瓶中,配成浓度为0.10 mg/mL的标准溶液。
2.2.2 供试品溶液制备
取红枣粉末0.50 g,精密称定,按2.2的方法提取过滤,合并滤液,移入250 mL容量瓶中,用水稀释至刻度,摇匀,得供试品溶液。
2.2.3 标准曲线的绘制
将标准溶液加入不同体积的蒸馏水,分别配成浓度为0、0.02、0.04、0.06、0.08、0.10 mg/mL的溶液于六支试管中。每1 mL的标准液分别加入 5% 的苯酚溶液1 mL,并迅速加入浓硫酸5 mL,静置10 min,混匀,在30 ℃温度条件下放置30 min后于490 nm波长处测定吸光度值,以葡萄糖含量为横坐标,吸光度值作为纵坐标,制作得到标准曲线。
2.3 还原糖含量测定
2.3.1 DNS显色液的制备
称取3.25 g DNS,并将其溶于少量蒸馏水,用玻璃棒搅拌溶解,之后转移至500 mL容量瓶中,依次加入体积为162.5 mL 的2 mol/L的NaOH溶液,7.5 mL的丙三醇,振荡摇匀,加蒸馏水定容至刻度,摇匀。
2.3.2 标准曲线的绘制
准确称取105 ℃温度条件下烘干至恒重的葡萄糖粉末50 mg于50 mL容量瓶中配成浓度为1 mg/mL的葡萄糖标准溶液。取六支试管,向其中分别加入体积为0.00 mL,0.10 mL,0.20 mL,0.30 mL,0.40 mL,0.50 mL的浓度为1 mg/mL的葡萄糖标准溶液,再依次向六支试管中分别加入蒸馏水补至0.50 mL,再向每个试管中分别加入DNS试剂1.50 mL,振荡摇匀。六支试管均配制好溶液后,把它们置于沸水浴中煮沸5 min,然后取出迅速流水冷却,最后分别在每支试管中加入4 mL蒸馏水,振荡混匀。在540 nm的波长处测量吸光度值。以葡萄糖浓度(μg/mL)为横坐标,吸光度值为纵坐标,作出标准曲线,得出线性回归方程。
2.4 红枣多糖含量测定
总糖含量测定:吸取1.00 mL样品液,按照2.3.3的步骤操作,计算出样品的总糖含量。
还原糖含量测定:吸取0.50 mL样品液,按照2.4.2的步骤操作,计算出样品的还原糖含量。
红枣多糖含量=总糖含量-还原糖含量。
2.5 方法学考察
2.5.1 精密度实验
精密吸取供试品溶液0.80 mL,补蒸馏水到1 mL,再加入 5% 苯酚溶液1 mL,并迅速加入浓硫酸5 mL,静置10 min。摇匀,30 ℃放置30 min后于490 nm测定吸光度值,重复测定6次,求RSD值。
2.5.2 稳定性实验
以上述供试品溶液做稳定性实验。供试品溶液取0.40 mL、0.60 mL、0.80 mL于试管中,并标号1、2、3,用2.3的方法进行测定, 分别选取三只试管中吸光度在标准曲线范围内良好的一支试管,在60 min内,每隔10 min 测定一次其吸光度,求得RSD值。
2.5.3 重复性实验
精密吸取供试品溶液6份,每份0.80 mL,补蒸馏水到1 mL,再用2.3的方法测定吸光度值,计算RSD值。
2.6 红枣多糖的提取工艺
2.6.1 单因素实验
以料液比,温度,提取时间三因素做单因素实验,分别讨论以上三因素对多糖提取率的影响,为下文正交实验筛选出最适的研究范围。
(1)提取温度对红枣多糖提取率的影响
称取红枣10 g,采用1:10的料液比,在60 ℃、70 ℃、80 ℃、90 ℃按2.3.2的提取方法分别提取2 h,选出最适提取温度范围。
(2)料液比对红枣多糖提取率的影响
称取红枣10 g,在60 ℃条件下,按料液比1:5、1:10、1:15、1:20按2.3.2的提取方法分别提取2 h,选出最佳提取的料液比范围。
(3)提取时间对红枣多糖提取率的影响
称取红枣10 g,在60 ℃条件下,采用1:10的料液比,按2.3.2提取方法分别提取1 h、2 h、3 h、4 h,选出最佳提取时间范围。
2.6.2 正交实验
以单因素实验分别选取出的三个水平,安排三水平正交实验,以多糖得率作为评价指标,选取热水提取红枣多糖的最佳条件。
2.7 红枣多糖颗粒剂的制备工艺
根据预实验筛选出淀粉和乳糖进行混合辅料配比的筛选。以原料药与辅料比为1:3,70%的乙醇作为润湿剂进行制粒。淀粉和乳糖的比例设置为1:1;1:2;2:1。以颗粒成型率和吸湿率为指标,对以上辅料进行优选。
成型率的测定:取制备的样品颗粒称重,将颗粒通过一号筛和五号筛,能够通过一号筛并且不能通过五号筛的颗粒即为成型较好的颗粒,收集这种颗粒并称重。计算颗粒成型率。公式为:
成型率=(通过一号筛而未通过五号筛颗粒重量/样品颗粒重)×100%
吸湿率的测定:将盛有氯化钠过饱和溶液的干燥器放入50 ℃的烘干箱内2 h,称取样品颗粒约1.00 g,置恒重称量瓶中,干燥至恒重后精密称取重量,放于底部盛有氯化钠过饱和溶液的干燥器内,并将称量瓶盖打开,放置2 h,称量重量,计算吸湿率。公式为:
吸湿率=(吸湿后的重量-吸湿前的重量)/吸湿前的重量×100%
以上述两项指标对辅料综合评分,其中成型率占50分,吸湿率占50分,选择成型率高且吸湿率低的辅料为最优辅料。
红枣多糖颗粒剂的制备采用湿法制粒的方法。将得到的粗多糖溶解,加入上述比例的辅料混合,混合均匀,至轻握成团轻压即散,用20目筛过筛使成颗粒分铺烘盘上,于60 ℃以下干燥24 h,得到红枣多糖颗粒剂。
2.8 红枣多糖颗粒剂的质量检测
根据《中国药典》(2020版)颗粒剂项下要求检查外观、粒度、水分,干燥失重和溶化性等颗粒剂项下指标。
3 结果与讨论
3.1 总糖含量测定结果
葡萄糖标准曲线如图1所示。得回归方程y =4.885x-0.0137,r=0.9998。结果表明葡萄糖在0.02~0.1 mg范围内线性关系良好。
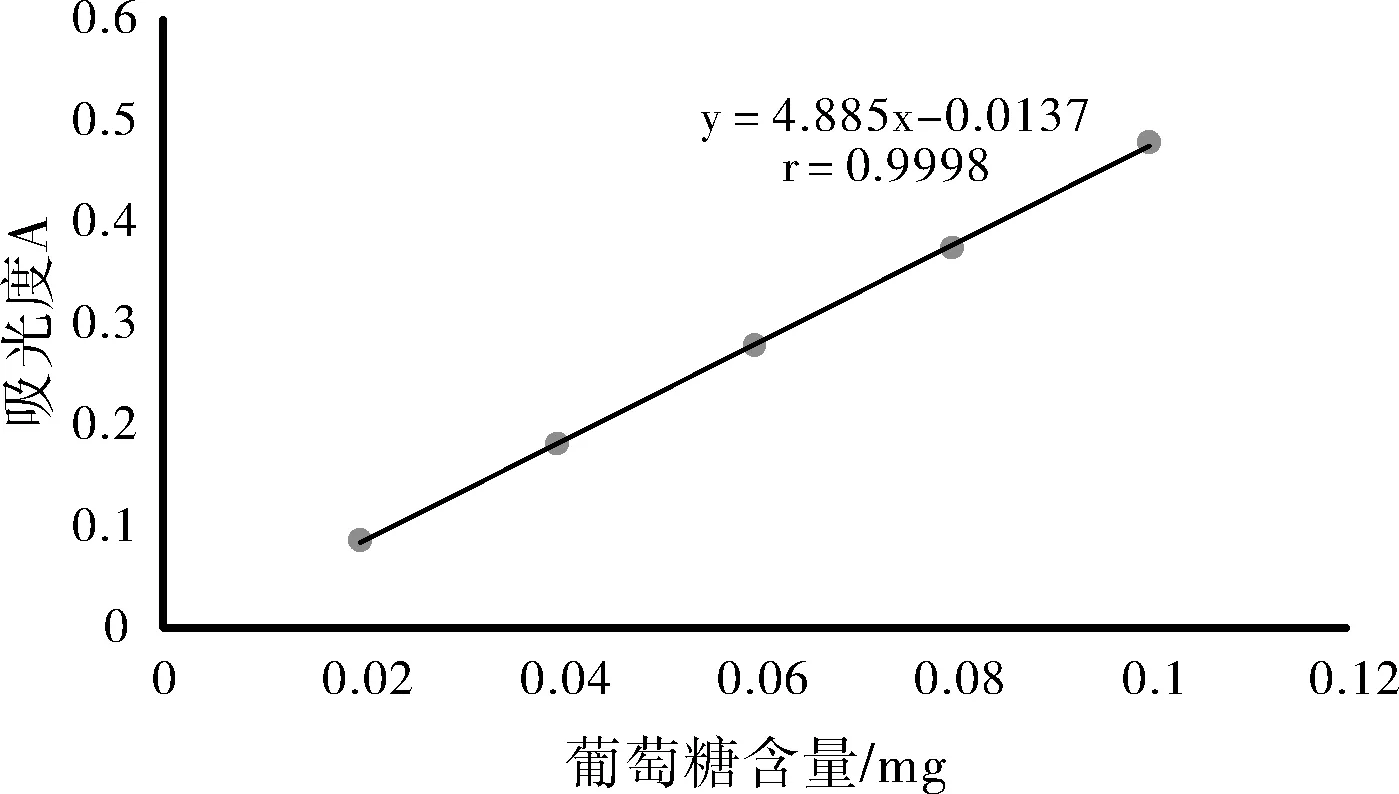
图1 葡萄糖标准曲线
3.2 还原糖含量测定结果
DNS标准曲线如图2所示。得回归方程y =0.766x-0.0058,r=0.9998,结果表明葡萄糖浓度在0.1~0.5 mg/mL范围内线性关系良好。

图2 DNS标准曲线
3.3 方法学考察结果
3.3.1 精密度实验
[1]马少波、章力辉等:《中国京剧史》,中国戏剧出版社,北京市艺术研究所,上海艺术研究所组织编,1990年.
吸光度值见表1,求得RSD值为1.06%,吸光度稳定,说明精密度良好。

表1 精密度试验表

续表1
3.3.2 稳定性实验
吸光度值见表2。由其数据可以看出在490 nm 波长测定总糖含量时, 吸光度稳定, RSD为2.49%。说明实验的稳定性良好。
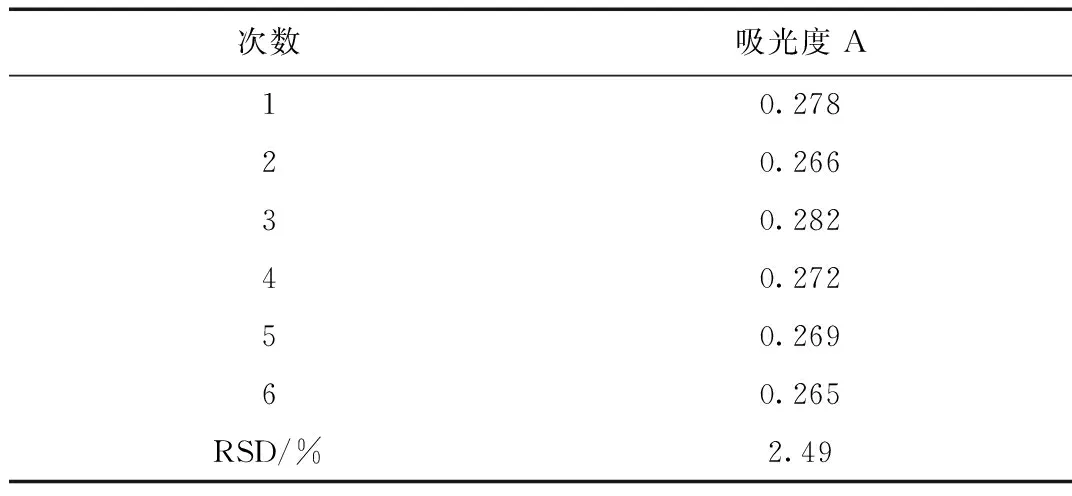
表2 稳定性试验表
3.3.3 重复性实验
吸光度值见表3,算出RSD为1.36%,吸光度稳定,说明重复性良好。
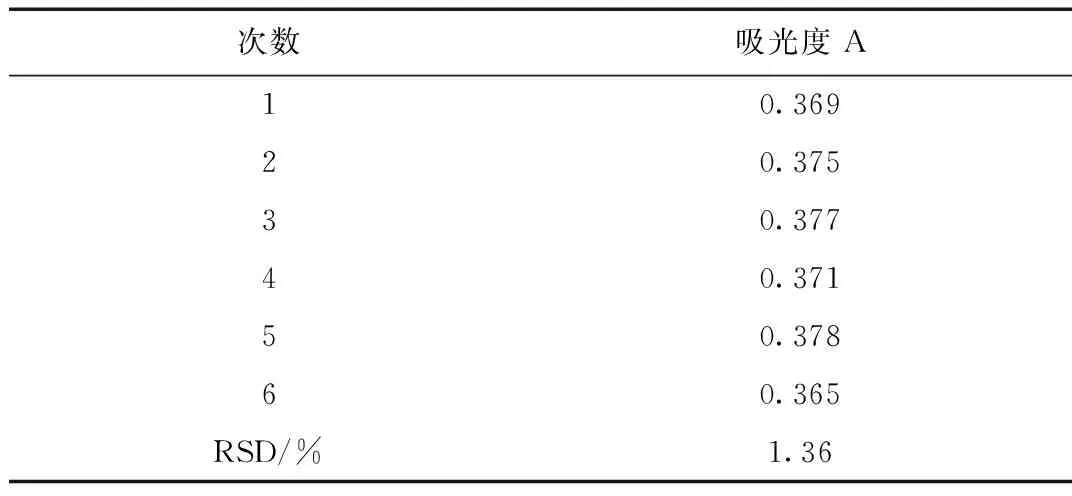
表3 重复性试验表
3.4 红枣多糖含量的测定结果
根据上文的方法,测得在60 ℃,料液比1:10,提取时间为2 h的条件下,红枣多糖含量为2.76%。
3.5 红枣多糖提取工艺结果
3.5.1 单因素实验
称取红枣10 g,采用1:10的料液比,在60 ℃、70 ℃、80 ℃、90 ℃按上述提取方法分别提取2 h,结果如图3所示。
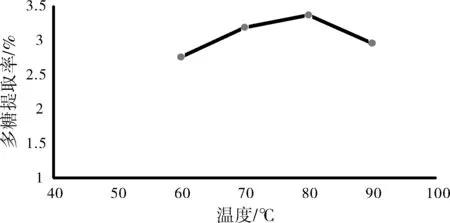
图3 提取温度对红枣多糖提取率的影响
由图3可以看出,随着水浴温度的升高,红枣多糖的提取率也不断升高,80 ℃时达到最高,超过80 ℃,多糖提取率又呈下降趋势。提取温度过高会使多糖分解,温度过低不易于多糖的浸出。因此,红枣多糖的最适提取温度范围是70~90 ℃。
(2)料液比对红枣多糖提取率的影响
称取红枣10 g,在60 ℃条件下,按料液比1:5、1:10、1:15、1:20,即稀释5倍、10倍、15倍、20倍,按上述提取方法分别提取2 h,结果如图4所示。
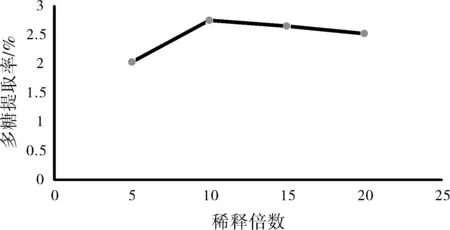
图4 料液比对红枣多糖提取率的影响
由图4可以看出,随着加水倍数的增加,红枣多糖的提取率也随之增加,稀释倍数为10即料液比达到1:10时,红枣多糖提取率达到最大值,最后又呈下降趋势,水量过少会使红枣粉浸泡不完全,水量过多不会显著提高提取率,可能还会使多糖水解,降低提取率。
(3)提取时间对红枣多糖提取率的影响
称取红枣10 g,在60 ℃条件下,采用1:10的料液比,按上述提取方法分别提取1 h、2 h、3 h、4 h,结果如图5所示。

图5 提取时间对红枣多糖提取率的影响
由图5可以看出,随着提取时间的增加,红枣多糖的提取率也不断升高,2 h时达到最高,超过2 h,多糖提取率又呈下降趋势。因此,提取时间过长或过短都会影响红枣多糖的提取率。提取时间短多糖没有完全提取出来,时间过长会导致多糖分解,降低提取率。
3.5.2 正交实验
在单因素实验的基础上,分别选取三个水平,正交实验的因素水平表见表4,安排三水平正交实验,做L9(34)正交表,以多糖得率作为评价指标,选取热水提取红枣多糖的最佳条件,结果见表5。
从上述试验结果和方差分析,可以看出:(1)极差R反映各因素对指标影响的大小。由于RA>RB>RC,由此可知,以上3个因素对红枣多糖提取率影响大小是:提取温度>料液比>提取时间。(2)均值K反映该因素水平对指标的影响的大小。由正交实验表得知,KA3>KA2>KA1,在提取温度这一因素下,80 ℃比其他两个水平要好;KB2>KB3>KB1,在料液比这一因素下,1:10比其他两个水平要好;KC1>KC2>KC3,在提取时间这一因素下,2 h比其他两个水平要好。综上所述,最佳提取工艺是A2B2C1,即提取温度80 ℃,料液比1:10,提取时间2 h。在此条件下红枣多糖的提取率为3.37%。
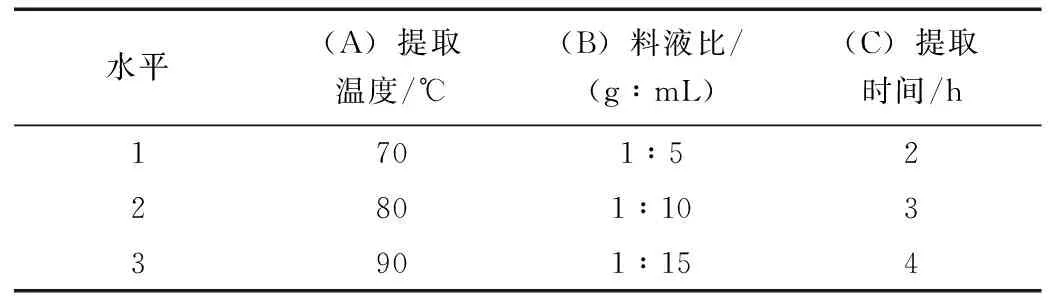
表4 因素水平表
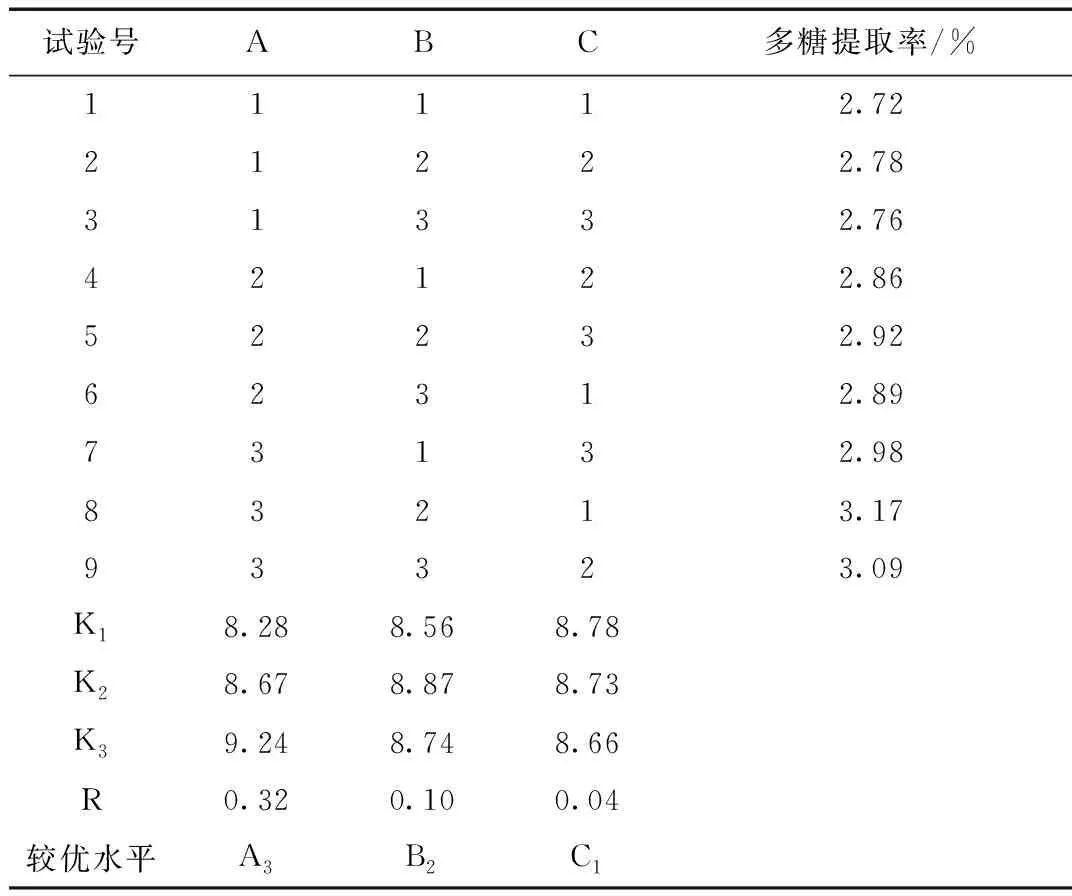
表5 正交实验结果
工艺验证:根据正交实验筛选出的最佳工艺提取,连续提取五次,提取率分别是3.37%,3.29%,3.24%,3.33%,3.26%,RSD=1.60%,该工艺稳定可行,红枣多糖的平均提取率为3.30%。
3.6 红枣多糖颗粒剂制备工艺结果
对成型性和吸湿率综合评价,根据表6,综合评价最佳辅料配比是可溶性淀粉:乳糖=2:1。
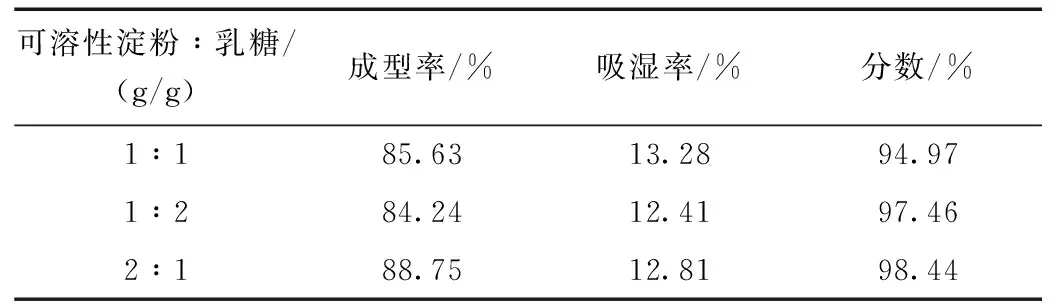
表6 混合辅料配比的筛选
3.7 红枣多糖颗粒剂的质量检测结果
制成的红枣多糖颗粒颜色为米黄色,颗粒大小均一,颗粒饱满,干燥后颗粒疏松干燥,色泽一致,总混后颗粒颜色变浅,变白,色泽基本一致。外观、粒度、水分,干燥失重和溶化性均符合《中国药典》(2020版)颗粒剂项下的规定。
4 结 论
本实验采用水提醇沉法提取红枣中粗多糖,含量测定采用苯酚-硫酸法测总糖含量;DNS法测还原糖含量;二者相减即为多糖含量。根据正交试验选出红枣多糖的最佳提取方案为80 ℃,料液比1:10,提取时间2 h,多糖提取率为3.37%。在红枣多糖颗粒剂的辅料筛选工艺中,以成型率和吸湿率为评价指标进行综合评分,选出分数最高的两种辅料进行混合辅料制剂,再以上述指标对混合辅料配比进行筛选,筛选出淀粉和乳糖为最佳辅料进行混合辅料制粒,比例为原料药:可溶性淀粉:乳糖=1:2:1。红枣作为一种众所周知的药食同源的中药材,前景十分广阔,本课题的研究也是对中医药的现代化研究的一次探索。

