乳酸菌发酵核桃粕制备多肽及其体外抗氧化活性
贺莹,陈杰
(吕梁学院生命科学系,山西 吕梁 033000)
核桃,又称胡桃,是人们熟知的一种天然坚果,在中国的种植面积广,产量大,栽培种植历史长[1]。核桃粕是核桃加工的副产物,含有一定量的核桃多酚和蛋白质,核桃蛋白质的总含量约占核桃粕干重的30%~70%,具有较高的利用价值[2]。如今,工业生产中多以蛋白质为主要原材料,通过酶水解法、微生物发酵法和化学水解法等方法制备多肽。其中,微生物发酵有许多优点,它可以利用原料中的各种营养物质,可利用自身的酶将蛋白质水解为多肽,并且对于多肽的提取机械化要求低,因此生物发酵现已发展为生物研究的热点之一[3]。固态发酵法是微生物发酵中的一部分,具有发酵成本低、能直接实现较大规模工业化生产、产生的污染物较少、对原料利用率高等众多优点[4]。目前核桃活性肽的生理活性研究还不够深入,还停留在初级阶段,且尚未成功开发出具有较高生理活性的人工核桃多肽产品。因此人工制备核桃生物活性肽已成为研究热点[5]。
本研究在前人研究基础上以核桃粕为发酵原材料,应用固态发酵方法[6],以乳酸菌[7]作为发酵菌种,在单因素试验基础上,运用响应面法优化工艺,最终确定出最佳的工艺条件,为工业化生产以及核桃副产物资源有效利用提供参考。同时对核桃多肽抗氧化能力进行评价,为制备核桃多肽及功能性开发利用提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料及试剂
乳酸菌:吕梁学院微生物实验室分离保藏。
核桃饼粕:市售;硫酸铜、三氯乙酸、硫酸铜、1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、甲醇、磷酸盐缓冲液(phosphate buffered solution,PBS)溶液、铁氰化钾、三氯化铁、三氯乙酸:天津市凯通精细化工有限公司;还原性谷胱甘肽、抗坏血酸:浙江海正药业股份有限公司;乳酸菌培养基(de Man,Rogosa and Sharpe,MRS):青岛拓普生物工程有限公司。以上试剂均为分析纯。
1.1.2 仪器与设备
DFT-100粉碎机:温岭市林大机械有限公司;RE-5298旋转蒸发仪:上海亚荣生化仪器厂;GZX-9146MBE电热鼓风干燥箱:上海博迅实业有限公司;HC60001电子天平:无锡玛瑞特科技实业有限公司;Neofuge 13R离心机:上海力申科学仪器有限公司;GZX-9146MBE恒温培养箱:上海培因实验仪器有限公司;UV-3100PC紫外可见分光光度计:上海美谱达仪器有限公司。
1.2 方法
1.2.1 基础及固态发酵培养基的制备
基础培养基:MRS培养基。
固态发酵培养基:称取核桃粕20 g(80目筛),加入到基础培养基内,121℃灭菌20 min[8]。
1.2.2 种子液的制备
通过无菌操作,用挑取1环活化的乳酸菌菌种接种到MRS液体培养基中,生化培养箱温度设为37℃,进行厌氧培养48 h。
1.2.3 固态发酵及发酵样品处理
准备若干250 mL锥形瓶,在每个烧杯中分别称取20 g核桃饼粕粉末,置于灭菌锅内,121℃灭菌20 min,然后无菌操作,补充无菌蒸馏水。按接种量15%接入至预先制备好的种子液,搅拌混匀,温度设为37℃,发酵12 h。发酵完毕后,过滤,离心,恒温50℃干燥,干燥结束后得到发酵样品[9]。
1.2.4 多肽含量的测定
参考刘潇等[10]的双缩脲方法测定核桃多肽浓度。
1.2.5 单因素试验
1.2.5.1 发酵时间对乳酸菌固态发酵制备多肽产量的影响
发酵温度37℃,接种量15%的条件下,分别考察发酵时长[11-12]为 10、12、14、16、18 h 时对乳酸菌发酵制备核桃粕多肽的影响。
1.2.5.2 发酵温度对乳酸菌固态发酵制备多肽产量的影响
发酵时间12 h,接种量15%的条件下,分别考察发酵温度[13-14]为 35、37、39、41、43 ℃时对于乳酸菌发酵制备核桃粕多肽的影响。
1.2.5.3 接种量对乳酸菌固态发酵制备多肽产量的影响
发酵时间12 h,发酵温度37℃,分别探究接种量[15-16]为5%、10%、15%、20%、25%对乳酸菌发酵制备核桃粕多肽的影响。
1.2.6 响应面优化乳酸菌发酵核桃粕制备多肽工艺
在对核桃粕多肽进行单因素试验基础上,以发酵时间(A),发酵温度(B),接种量(C)3个因素为自变量,多肽产量(Y)为响应值,设计三因素三水平试验优化乳酸菌发酵制备核桃多肽的工艺。试验因素水平见表1。
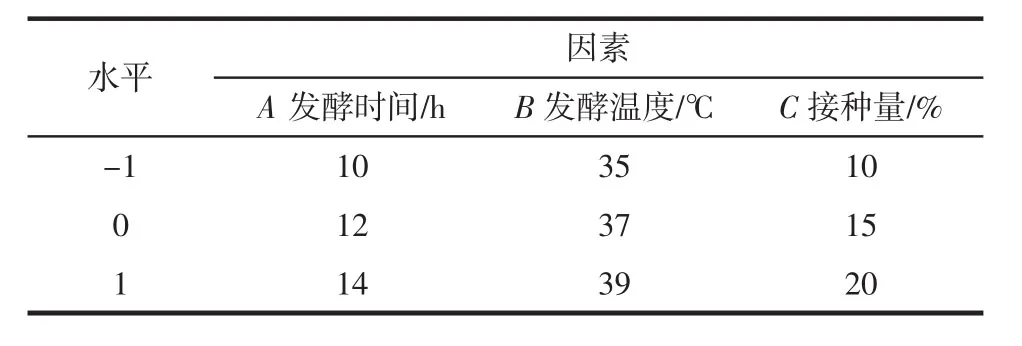
表1 响应面试验因素水平Table 1 Factor levels of response surface test
1.2.7 抗氧化能力测定
1.2.7.1 核桃多肽清除DPPH自由基能力测定
精确称取核桃多肽,将其配制成浓度为1.0、2.0、4.0、6.0、8.0 mg/mL的溶液。同样称取抗坏血酸,制成同样的浓度作参比。分别取2 mL不同浓度核桃多肽溶液、抗坏血酸溶液,加入2 mL DPPH溶液,摇匀后放置30 min,用对应的溶剂为参照,在517 nm处测吸光度,计算公式[18]如下。
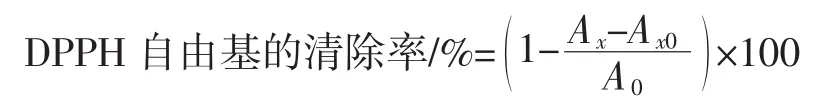
式中:Ax为不同浓度溶液吸光度;Ax0为样品本底吸光度;A0为参比溶液吸光度。
1.2.7.2 铁还原力的测定
取2.0 mL不同浓度的样品溶液,各加入2 mL PBS溶液和铁氰化钾溶液,用振荡器混合,保温箱里50℃存放20 min,取出后再加入2 mL三氯乙酸,3 000 r/min离10 min,取上清液,迅速加入蒸馏水和配好的三氯化铁,室温反应10 min,在700 nm处测定吸光度[19-20]。
1.3 数据处理
每组样品做3次平行试验,数据使用origin 9.0作出折线图,采用Design-Expert 8.0.6.1进行响应面试验数据处理。
2 结果与分析
2.1 多肽标准曲线
Gly-Gly-Tyr-Arg四肽标准曲线如图1所示。
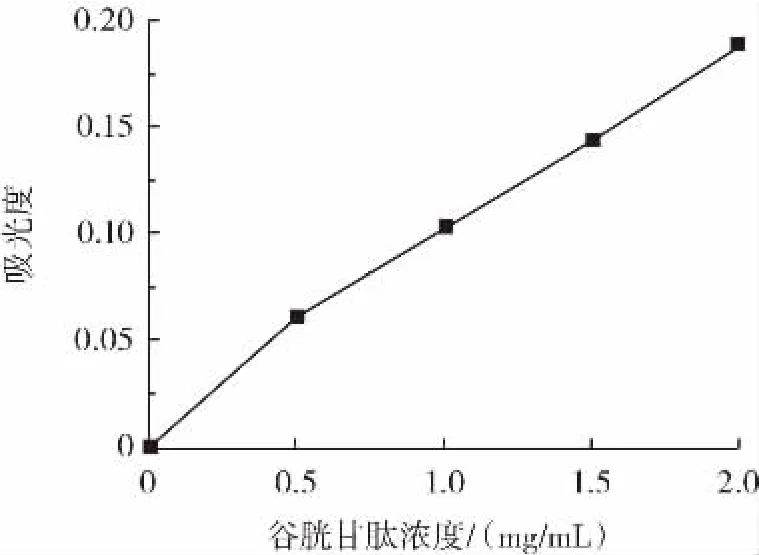
图1 Gly-Gly-Tyr-Arg四肽浓度标准曲线Fig.1 Standard curve of Gly-Gly-Tyr-Arg concentration
此标准曲线的回归方程式:y=0.092 2x+0.007 2。相关系数R2=0.991 7。
2.2 单因素结果分析
2.2.1 发酵时间对乳酸菌发酵制备核桃粕多肽的影响
发酵时间对乳酸菌发酵制备核桃粕多肽的影响见图2。
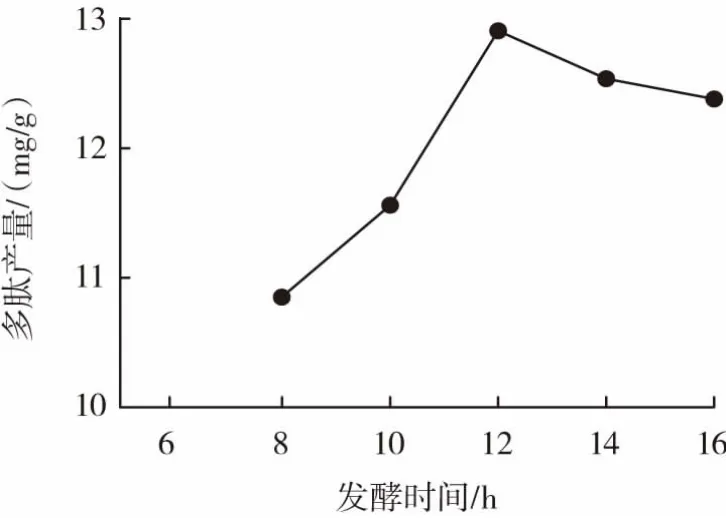
图2 发酵时间对乳酸菌发酵制备核桃粕多肽的影响Fig.2 Effect of fermentation time on preparation of walnut polypeptides by lactic acid bacteria
由图2可知,发酵温度37℃,接种量15%,随着发酵时间的延长,多肽的产量先增大后减小,当发酵时间为12 h时,乳酸菌发酵核桃粕的效果最佳。当发酵时间超出12 h后,多肽产量开始下降,说明发酵时间过长,会影响多肽的结构,从而影响了多肽的产出。所以发酵时间12 h为最佳的发酵时间。
2.2.2 发酵温度对乳酸菌发酵制备核桃粕多肽的影响
发酵温度对乳酸菌发酵制备核桃粕多肽的影响见图3。

图3 发酵温度对乳酸菌发酵制备核桃粕多肽的影响Fig.3 Effect of fermentation temperature on preparation of walnut polypeptides by lactic acid bacteria
由图3可知,发酵时间12 h,接种量15%,多肽产量随温度的升高先增大后减小。当发酵温度为37℃时,多肽产量达到最大。因而选37℃为最适发酵温度。
2.2.3 接种量对乳酸菌发酵制备核桃粕多肽的影响
接种量对乳酸菌发酵制备核桃粕多肽的影响见图4。
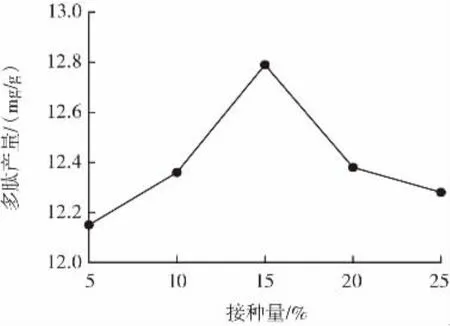
图4 接种量对乳酸菌发酵制备核桃粕多肽的影响Fig.4 Effect of inoculation of walnut polypeptide by lactic acid bacteria fermentation
从图4可看出,接种量在5%~15%当中时,多肽产出量逐步增加。当接种量越来越大时,多肽产出量逐步下降。因此,适合的接种量对多肽产量的影响极为重要,太小或太大都将导致多肽的产量呈下降趋势[21]。根据接种量对乳酸菌发酵制备核桃粕多肽的影响程度可知,接种量为15%为最佳值。
2.3 响应面优化试验
2.3.1 响应面试验结果
以响应面分析法中心组合设计原理为主要试验研究依据[22-24],进行响应面试验,乳酸菌制备核桃粕多肽工艺的响应面试验结果见表2。
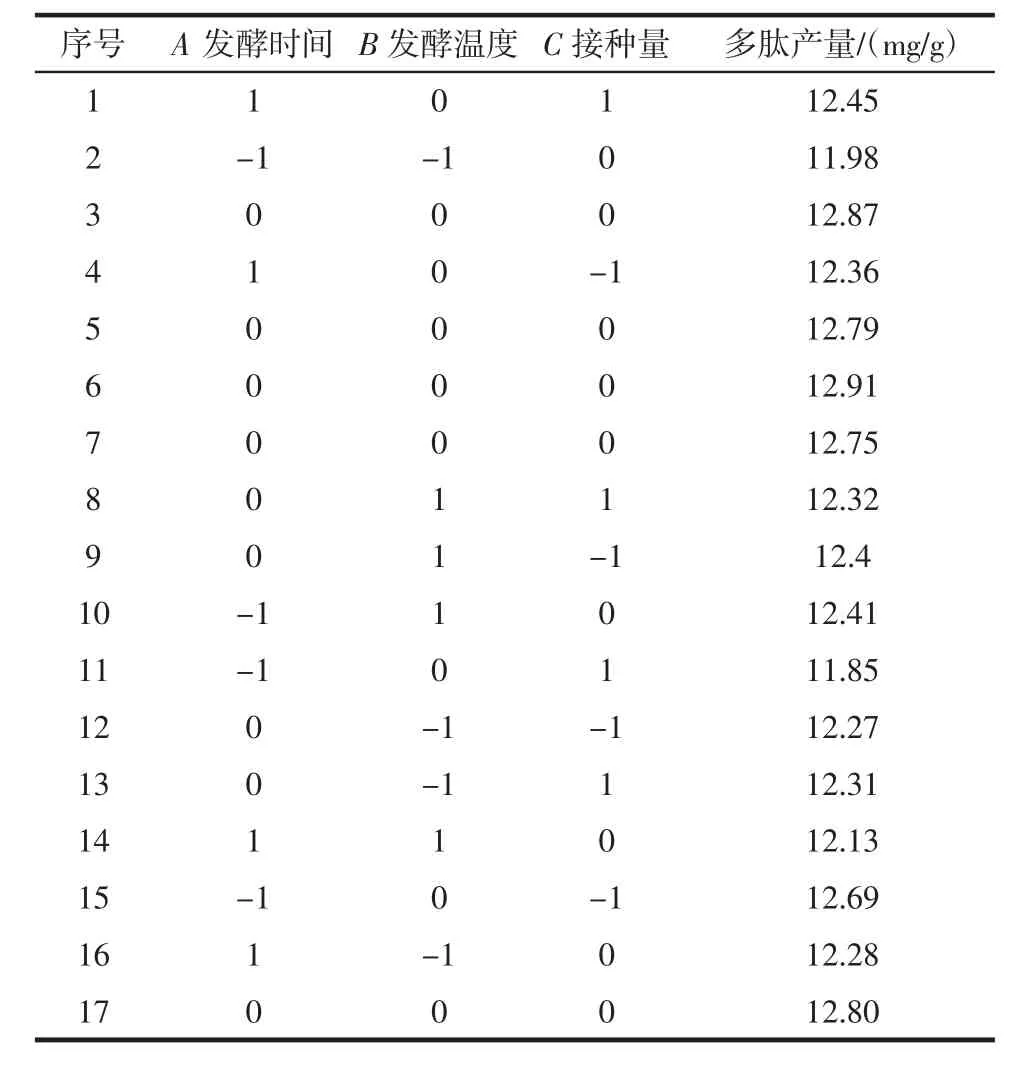
表2 响应面试验结果Table 2 Test design and results of response surface
2.3.2 模型方程的建立及显著性分析
回归模型方差分析见表3。
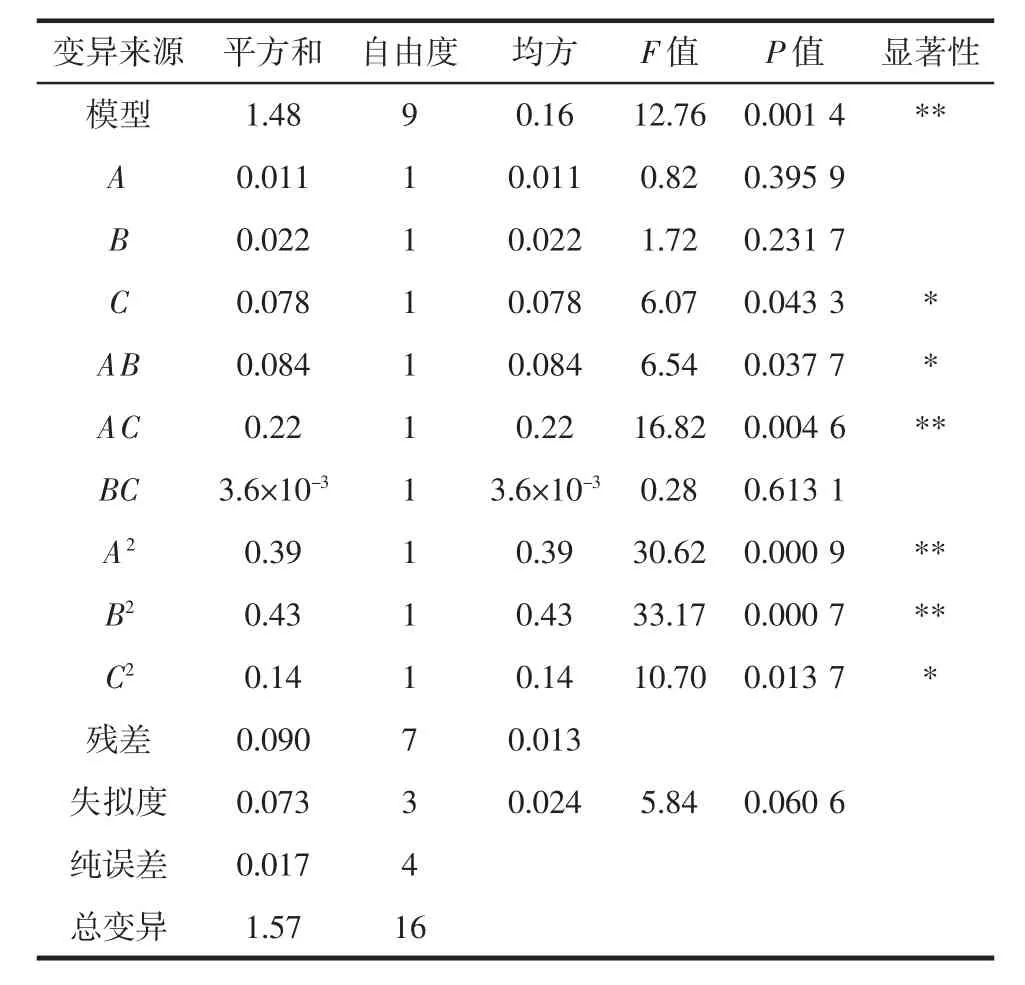
表3 回归模型方差分析Table 3 Analysis of variance of quadratic regression model
对响应面试验数据结果进行多元回归分析,得出核桃饼粕多肽产出量与发酵时间(A),发酵温度(B),接种量(C)的二次回归模型:Y=12.82+0.036A+0.053B-0.099C-0.15AB+0.23AC-0.030BC-0.31A2-0.32B2-0.18C2。从A、B、C项系数的绝对值的大小可以充分看出,这3个影响因素对多肽产量的直接影响程度大小,其中正负值分别表示该因素对多肽影响正效应和负效应,各影响因素对多肽发酵产量的直接影响由大到小依次排序为接种量>发酵温度>发酵时间。模型P=0.001 4<0.01,说明该回归模型具备极显著性,证明发酵条件不同,核桃粕多肽产量有显著性差异;另外,表中失拟项P=0.060 6>0.05,证明在响应面试验选择的各种因素水平范围中,模型拟合程度佳,对响应面试验结果进行数值分析和试验结果预测时,可以用此回归模型的结果。在响应面试验选择的各种因素水平界限内,对多肽产出量的影响效果显著的因素是接种量;交互项中对多肽产出量影响效果极显著的为AC(P<0.01),显著的为AB,而BC对多肽产出量的影响效果不显著;二次项中A2、B2对多肽产出量有极显著的影响(P<0.01),而 C2的影响为显著。
2.3.3 响应曲面分析
各因素交互作用的响应面及等高线图见图5~图7。

图5 发酵时间与发酵温度交互作用的响应面与等高线Fig.5 Response surface and contour map of interaction between fermentation time and fermentation temperature
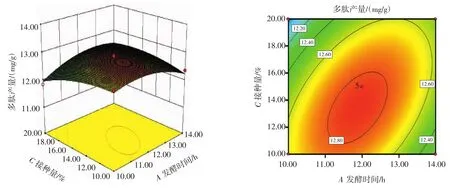
图6 发酵时间与接种量交互作用的响应面与等高线Fig.6 The response surface and contour map of the interaction between fermatation time and inoculation level
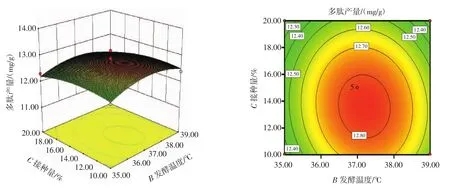
图7 发酵温度与接种量交互作用的响应面与等高线Fig.7 The response surface and contour map of the interaction between fermatation time and inoculation level
从图5可看出,等高线图为椭圆形,表明发酵时间与温度对多肽产量影响显著;随着发酵时间的进一步延长,发酵温度的增高,多肽产量呈现先上升后降低的趋势。
由图6可看出,等高线图同样呈现椭圆的形状,说明发酵时间与接种量对多肽产量的影响极显著(p<0.01);随着发酵时间的延长,多肽产出量呈现先增长后下降的趋势;随着接种量的逐步增大,多肽产出量呈现先增大然后减小的趋势。
从图7可知,等高线图的形状向圆形贴近,表明发酵温度和接种量交互作用对多肽产出量的影响程度是微弱的;随着发酵温度的升高,多肽产量呈现先增高后减小的趋势;随着接种量的逐步增大,多肽产出量呈现逐步增高然后减小的趋向。
2.3.4 最佳制备条件验证
借助Design-Expert 8.0.6应用软件对发酵多肽的工艺条件进行优化,分析可得多肽的最优发酵工艺制备条件:发酵时间11.8 h,发酵温度37.24℃,接种量13.25%,在此条件下多肽产量的理论值为12.80 mg/g。根据以上优化制备条件的试验数据分析结果,联系实际试验条件,将核桃粕多肽最佳制备工艺条件调整为发酵时间12 h,发酵温度37℃,接种量13%,经过3次平行试验,得到最佳条件下多肽产量为12.84 mg/g,与多肽产出量的理论值无显著差异,说明该响应面设计优化后得到的工艺条件可靠。
2.4 抗氧化能力测定
2.4.1 核桃粕多肽清除DPPH自由基能力测定
不同浓度核桃粕多肽的DPPH自由基清除率结果见图8。

图8 不同浓度核桃粕多肽对DPPH自由基清除率的影响Fig.8 Effects of different concentrations of walnut meal polypeptide on DPPH free radical scavenging rate
由图8可知,核桃粕多肽的DPPH自由基清除能力,随着样品浓度的升高而不断增加。当样品浓度达到10 mg/mL时,DPPH自由基清除率达到了82%,表明核桃粕多肽具有较强的抗氧化活性。
2.4.2 核桃粕多肽铁还原能力的测定
不同浓度核桃粕多肽的铁还原能力结果见图9。
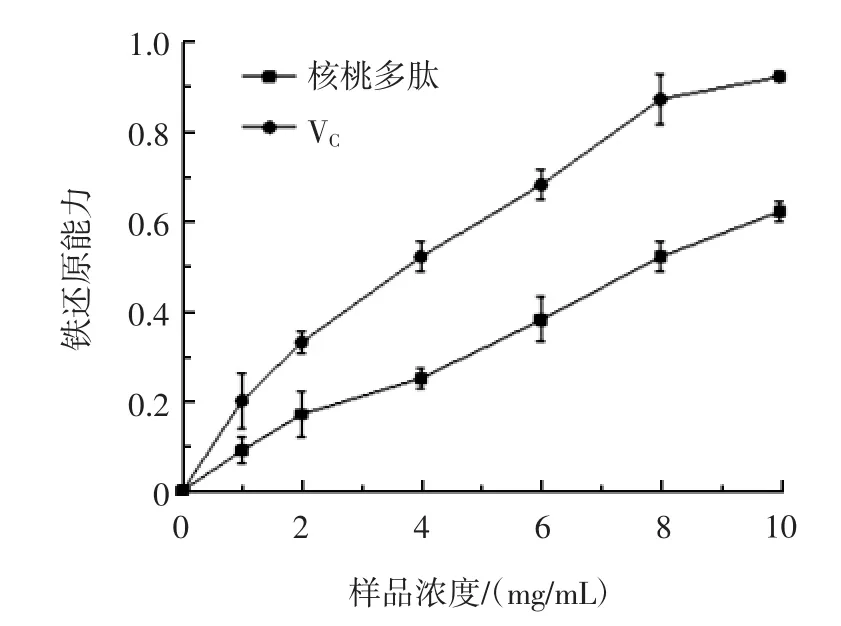
图9 不同浓度核桃粕多肽的铁还原能力Fig.9 Iron-reducing ability of polypeptides in different concentrations of walnut meal
从图9看出,随着样品浓度的升高,核桃粕多肽的铁还原能力在不断增加,阳性对照VC的活性较强,当核桃粕多肽浓度为10 mg/mL时,铁还原能力比其浓度为8 mg/mL时增加了19.2%,可能是乳酸菌作用多肽以后,肽分子构象改变,进一步暴露出一些有抗氧化能力的氨基酸残基,增强了其抗氧化性[25]。
3 结论
以核桃粕为原料,采用固态发酵的方式,以多肽产量为评价指标,通过单因素试验及响应面试验,有针对性地对乳酸菌制备核桃粕多肽进行了发酵条件优化,其最佳发酵条件:发酵时间12 h,发酵温度37℃,接种量13%,在此条件下核桃粕多肽含量为12.84 mg/g。抗氧化性研究表明,当核桃粕多肽质量浓度为10 mg/mL时DPPH自由基清除率达82%,且具有较强的还原能力。这些技术参数可为今后核桃粕多肽在工业化生产以及核桃粕副产物资源有效利用提供参考。

