蓝色化合物榴菌素及其类似物的研究现状
郑胜蓝,李宗显,朱运平,*
(1 北京工商大学 北京市食品添加剂工程技术研究中心 北京 100048 2 北京工商大学食品与健康学院 北京 100048)
榴菌素(Granaticin,GRA),属于苯并异色烷醌类化合物 (Benzoisochromanequinones,BIQ)。BIQ 类化合物是研究聚酮合酶、抗生素生产、次级代谢以及调控的模式化合物,生物合成研究的代表性化合物放线紫红素(Actinorhodin,ACT)以及美达霉素(Medermycin,MED)[1]等都是其家族成员,因这类化合物通常具有抗菌、抗肿瘤等生理活性,故具有非常高的研究价值。作为BIQ 家族的一员,榴菌素及其类似物亦具有优异的抗菌、抗肿瘤、抗病原微生物的功能,且该类化合物在碱性条件下呈现亮蓝色,在功能性色素的领域亦有潜在应用价值。这些独特的功能使榴菌素受到研究者的关注。
1 榴菌素的基本特性
榴菌素的分子式为C22H10O10,分子质量为444.42 u,标准大气压下,其沸点为748.3 ℃,闪点为266.8 ℃,熔点为223~225 ℃,结晶时为深红色晶体;榴菌素在极性溶剂(如水、甲醇、乙醇、乙腈、乙酸乙酯、DMSO 等)中溶解性较好,在水中的溶解度会随着pH 值的增大而增大,不溶于石油醚、氯仿等非极性溶剂。在酸性条件下呈红色,在碱性条件下呈紫蓝色[2]。
榴菌素的化学结构于1968年确定,属于芳香聚酮中的苯并异色烷醌类化合物[3-4],具BIQ 的母核结构,由BIQ 碳骨架和一个糖基附着组成,BIQ碳骨架含有并联的两个芳香环和一个带有手性中心的吡喃环,在吡喃环的立体化学结构与放线紫红素正好相反,其糖基的附着方式也十分特殊。以榴菌素为基础,有多种榴菌素类似物,如榴菌素B(Graticin B),二氢榴菌素(Didhydrogranaticin),二氢榴菌素B(Dihydrogranaticin B)等(图1)。

图1 榴菌素及其类似物结构Fig.1 Structure of granaticin and its analogus
BIQ 类抗生素中的典型化合物除了放线紫红素[5]和美达霉素[6],还包括富伦菌素(Frenolicin)[7],灰色菌素(Griseusin)[8],卡拉芬净(Kalafungin)[9]和七尾霉素(Nanaomycin)[10]等。该类化合物具有共同的三环母核结构,即萘并[2,3-c]吡喃-5,10-二酮的三环系统,也是BIQ 的发色基团。在二氢吡喃基团上γ-内酯环的融合与打开,顺反手性以及萘环上侧链基团的连接附着造就了BIQ 化合物的结构特异性。而榴菌素在C-9 和C-10 上附着的糖基以及附着方式引起了许多人的研究兴趣(图2)。
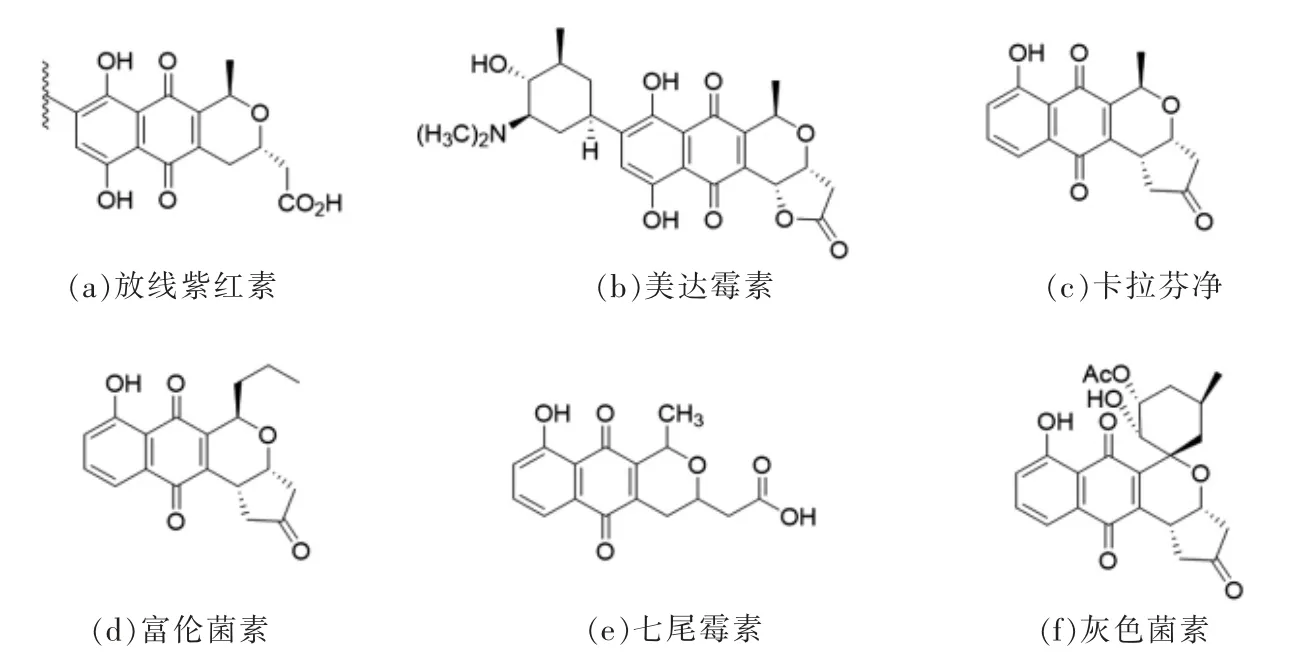
图2 几个代表性的BIQ 家族化合物结构Fig.2 Structures of several representative BIQ antibiotics
2 榴菌素的来源
榴菌素的来源主要有化学合成及生物合成两种途径。化学合成主要是依据化学降解和X 射线晶体衍生学解析的结构进行设计合成。目前有两种完整的合成路线:一种是1983年Yoshii 所建立的以四氢萘酮为原料的合成路线[11]。四氢萘酮作为底物,经20 步的连续反应合成得到榴菌素。在这一路线中,主要通过先合成氰基邻苯二甲酸酯和迈克尔受体两种前体物质,再合成榴菌素,其关键步骤是Kraus 在合成卡拉芬净过程中曾采用烯丙基醇的分子内钯催化的烷氧基羰基化。另一合成路线是由Ruben 于2012年建立[12-13]的以溴四氢萘酮为原料,先合成CD 环形成的溴化物和包含AB 环的酸酐,再实现榴菌素的合成。这一路线中,其关键步骤为Masquelin 在合成富伦菌素B(Frenolicin B) 的过程中曾采用的氧杂-Pictet-Spengler 反应。由于化学合成的条件复杂,衍生物较多,产量低,致使其在榴菌素的制备中鲜有关注。
生物科技的发展为基因组的解析提供了技术手段和高效方法。人们开始通过基因组学的解析对榴菌素进行研究,除紫红链霉菌(AJ011500)外,粤蓝链霉菌 (GU233672)、玫瑰球孢链霉菌[30](LZRD00000000) 以及本实验室先前所发现的黄草乌链霉菌(CP040244)的全基因组序列都陆续被测序以及解析。通过对不同菌株的榴菌素生物合成基因簇进行分析对比,发现3 株菌株的榴菌素基因簇序列高度相似,生物合成基因(orf8-orf33)排序一致,相邻基因的重叠编码方式高度保守。与紫红链霉菌相比,粤蓝链霉菌和黄草乌链霉菌均存在侧翼基因缺失或者插入,粤蓝链霉菌在orf35处存在大片段基因的缺失,且出现基因移位[31],而黄草乌链霉菌在orf7、orf8 存在基因缺失,在orf35处有大片段插入,正是这些基因片段的插入与缺失使得基因簇同源性存在差异。
劳动争议调解员采用换位思考的方法,要给当事人灌输凡事都要全面看问题的观点,告诉当事人面对纠纷既要考虑自己的理由和利益,又要考虑对方的想法和感受。只有双方设身处地地想一想对方的利益,才会感觉到对方的想法也是情理之中的事。这样才能进行有效的沟通。换位思考,实质上是促使双方相互理解,消除对抗情绪,从而达成和解的有效途径。
3 榴菌素的生物合成研究进展
3.1 榴菌素生物合成基因簇的研究
榴菌素的生物合成基因簇(gra)包含了37 个开放阅读框(Open reading frame,ORF),其中33个ORF(orf8~orf33)构成了榴菌素的完整基因簇,而其侧翼基因(orf7,orf35,orf6)在不同菌株中会有不同程度的插入、缺失或者编码移位[2]。榴菌素基因簇中有15 个基因与放线紫红素生物合成基因同源,有17 个基因与美达霉素生物合成基因同源,相较于放线紫红素,榴菌素和美达霉素的基因簇中还多了与糖基合成相关的基因(图3)。榴菌素的基因簇中包含最小PKS(minimal PKS)基因,酮基合成酶基因(KS)、链长合成因子基因(CLF)、酰基载体蛋白基因 (ACP),还有芳香化酶基因(ARO)、酮基还原酶基因 (KR)、环化酶基因(CYC),10 个左右相关的糖基合成基因和修饰的基因,如dTDP-1-葡萄合成酶,dTDP-葡萄糖-4,6-脱水酶、3-酮还原酶、糖基转移酶基因等,以及一些尚未探明功能的未知基因(表1)。
榴菌素是通过二型聚酮合酶途径(Polyketide synthaseⅡ,PKSⅡ)合成的。为了更加清楚地了解榴菌素生物合成的机制,人们对榴菌素合成的基因簇开展了研究。Sherman 等[22]于1989年首先对榴菌素生物合成基因簇上的一段6.5 kb 的片段进行了克隆测序,其中包含II 型PKS 途径中的6个核心合成基因,即orf1~orf6。Bechthold 等[23]于1995年用黏粒载体构建了紫红链霉菌Tü22 的基因组文库,筛选获得一个包含榴菌素生物合成基因簇在内的50 kb 大小的片段,对距离核心合成基因较远的7.3 kb 左右的片段进行了测序,鉴定了包括dTDP-葡萄糖-4,6-脱水酶基因在内的5个与糖基合成的相关基因。在此研究基础上,1998年,Ichinose 等[24]测序并异源表达了榴菌素的完整基因簇,获得了榴菌素,最终确定了榴菌素生物合成基因簇的完整序列。2010年Deng 等[25]首次在榴菌素产生菌(粤蓝链霉菌)上建立有效的遗传转化体系。
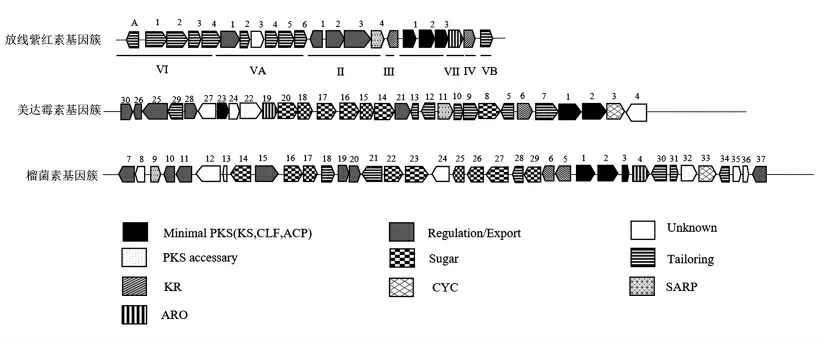
图3 放线紫红素、美达霉素和榴菌素的生物合成基因簇Fig.3 The biosynthesis gene cluster of actinorhodin,medermycin and granaticin

表1 榴菌素生物合成基因及其推定功能Table 1 Biosynthesis genes of granaticin and its deduced functions
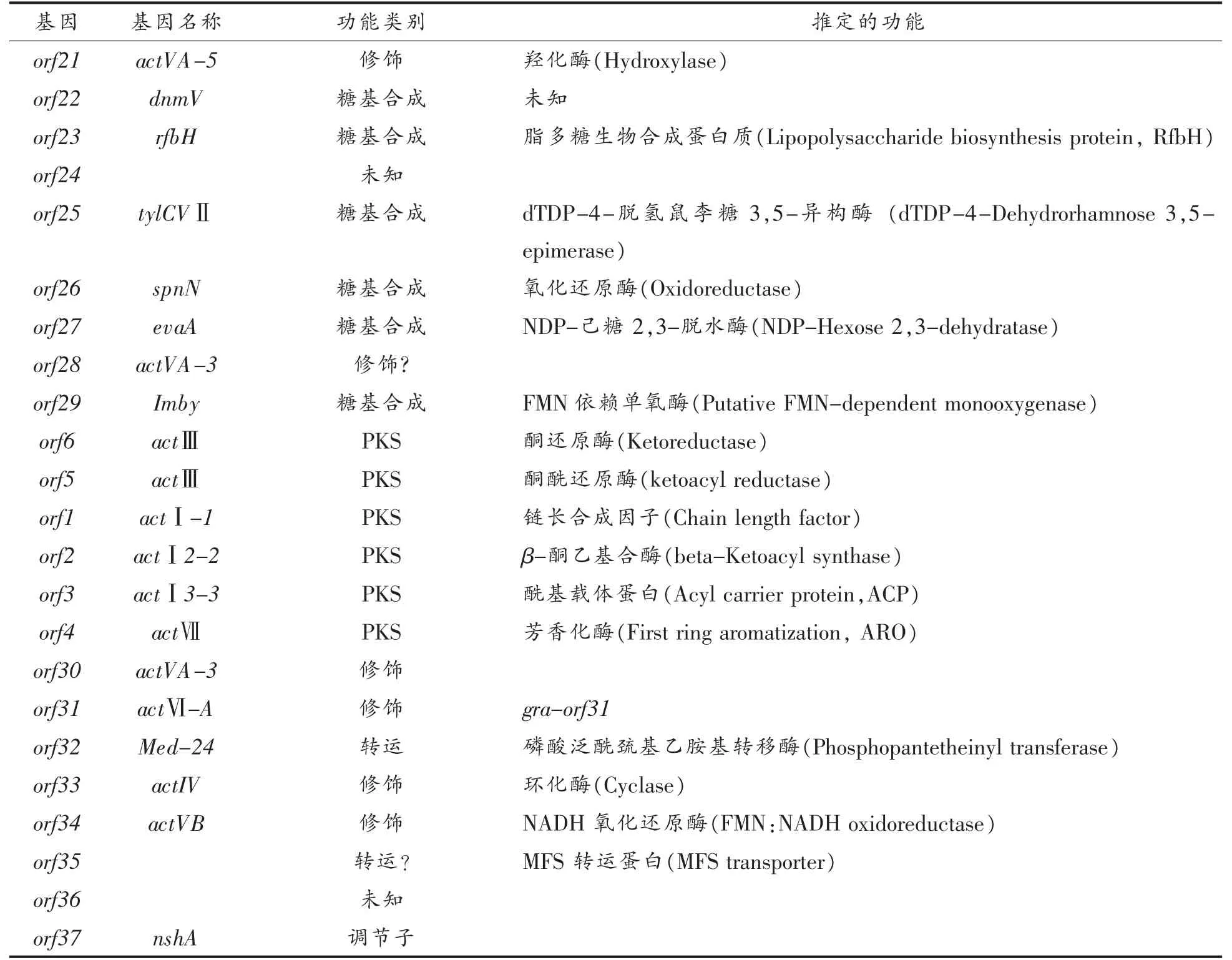
(续表1)
3.2.1 榴菌素发色基团的合成 榴菌素发色基团,即BIQ 发色基团的合成途径是Ⅱ型聚酮合酶途径,参与该途径主要的催化酶为KS(orf1)、CLF(orf2)、ACP(orf3),即最小迭代酶(Minimal PKS),他们以乙酰CoA 为起始单元,丙酰CoA 为延伸单元,经过7 轮脱羧反应,形成聚酮长链,(CLF 虽与KS 同源,但是在活性位点缺少保守的半胱氨酸);在原先的假定途径中,C-9 在酮基还原酶(orf5)的作用下,先行还原成羟基,而后C-7 与C-12 环化,形成第一个芳香环[32];最近生物化学研究表明,C-9 酮基还原酶是NAD(P)H 依赖性酶属于短链脱氢酶 (Dehydrogenase/reductase SDR family)[33-34],该类酶更倾向结合双环底物,这说明了在C-9 酮基还原成羟基前,C-7 和C-12 已经发生环化,而后在C-9 还原后,在芳香化酶(orf4)的催化下,脱去两分子水,形成第一个芳香环[35-36]。随后C-5 与C-14 闭合在环化酶(orf33)的作用下闭合,生成二环中间体。二环中间体的不稳定性是聚酮折叠中的一大挑战,ACP-聚酮复合物具有使聚酮链稳定的作用[37],因此ACP 的释放问题一直是研究的热点,在原先的假定合成途径中,从二环中间体到DNPA 的过程中,ACP 一直锚定在聚酮链上,直到DNPA 的形成,ACP 才从聚酮链上释放;后期研究表明[38],ACP 在形成二环中间体之后,C3还原之前就释放了。orf6 编码一个立体专一性酮还原酶,属于SDR 家族蛋白的第二组,使C-3 的酮基还原成羟基,并负责C-3 的立体选择性,C-3的羟基而在放线紫红素和美达霉素中actⅥ-orf1和med-orf12 编码的脱氢酶催化C-3 形成 (S)-DNPA 中间体[39]。orf21/orf34 与actVA-orf5/actVB同源,其编码产物组成了一个双组份的单加氧酶系统FMOs,既负责中心环的C-6 处形成对醌,也负责在形成侧环处C-8 的羟基。而美达霉素基因簇中的同源基因med-7 转录翻译一个单功能酶,只负责在C6 形成羟基[27](图5)。
相比化学合成法,生物合成具有环境友好、合成效率高、成本较低等优势。生物合成主要是在产榴菌素及其类似物的微生物次级代谢产物中分离得到。1957年Corbaz 等[14]在橄榄色链霉菌中首次分离发现了榴菌素以及其类似物榴菌素B,随后人们分别在紫红链霉菌(S.violaceoruber)[15]、嗜热的紫链霉菌(S.thermoviolaceus subsp.pingens)[16]、玫瑰球孢链霉菌(S.globispororoseus var.granaticus)[17]、砖红色链霉菌(S.lateritius)[18]、石蕊链霉菌(S.litmogenes)[19]、粤蓝链霉菌(S.vietnamensis)[20]和小链霉菌(S.parvus)[21]中相继发现和分离榴菌素及其类似物。由于榴菌素这样的天然产物,代谢途径复杂,产物种类及产量难以控制,目前尚未有采用生物法工业化制备榴菌素及其类似物的方法。因此,为了提高生物合成的效率,降低合成成本,探明榴菌素生物合成的途径和机制是研究者们关注的重点。

图4 已测序的榴菌素基因簇对比Fig.4 The comparison of sequenced granaticin gene clusters
3.2 榴菌素的生物合成机理研究
随着基因克隆表达、敲除技术的发展,榴菌素中许多未知基因的功能逐渐被探明。Ichinose 等[26]在美达霉素基因簇进行研究时,发现med-orf24负责转录和翻译一种磷酸泛酰巯基乙胺基转移酶,而med-orf24 与gra-orf32 具有一定的同源性,其产生的蛋白与med-orf24 转录翻译的产物具有38%的相似性,因此认为gra-orf32 的蛋白酶产物属于该家族;邓名荣[2]对orf20 基因进行体内敲除与体外重组表达,发现orf20 虽具备过氧化物应答(SoxR)的作用,但在榴菌素生产过程中并不参与抗氧化胁迫,而是对orf15 的转录表达进行调控,从而控制榴菌素的产量,对榴菌素的产生具有负调控作用;Taguchi 等[27]发现负责编码一种双组份的单加氧酶系统FMOs 的同源基因actVA-orf5 和gra-orf21 是双功能的,既负责中心环的C-6 处形成对醌,也负责在侧环处形成C-8 羟基。邓名荣等[28]还发现orf10/orf11 与枯草芽孢胞杆菌中的多效性双组份系统(TCS)degU/degS 具有较高的同源性,进一步研究发现orf10/orf11 可能通过接收上游信号而激活途径特异性转录激活基因orf9 的转录,进一步激活榴菌素生活合成基因的表达。Liu 等[29]发现与gra-orf31、ActVI-ORF 同源的med-orf10在合成美达霉素时进行蛋白表达,虽然前期研究已知ActVI-ORF 的敲除会导致放线紫红素的产量的降低,但其具体作用机制以及是否参与生物合成尚不明确,因此med-orf10 的表达证实了该基因在美达霉素合成时起到了调控作用。

图5 榴菌素发色基团合成途径Fig.5 The synthesis pathway of granaticin chromophore
3.2.2 榴菌素糖基的合成与附着 榴菌素上的糖基由葡萄糖转化而来。在基础代谢的过程中,葡萄糖经己糖激酶催化后生成葡萄糖-6-磷酸 (Glucose-6-P),后经α-磷酸葡糖变位酶催化生成葡萄糖-1-磷酸(D-Glucose-1-phosphate),作为榴菌素次级代谢中糖基合成的前体[2]。在随后的推测合成过程中,葡萄糖-1-磷酸被腺苷二磷酸葡萄糖合酶(orf16)催化,生成腺苷二磷酸葡萄糖(dTDP-DGlucose),在dTDP 葡萄糖4,6 脱水酶(orf17)的作用下转化为dTDP-4-酮-6-脱氧-D-葡萄糖[40]。该催化步骤包含了一系列复杂的质子转移、C-6 羟基的消除以及氢化物的转移,虽然尚未有充足的试验证明orf16 和orf17 参与了该催化反应,但是由于基因簇中只有这一组酶能够参与这一催化步骤,因此研究人员还是假定了该条合成途径。为了移除C-2 的羟基,dTDP-4-酮-6-脱氧-D-葡萄糖在2,3-脱水酶(orf27)催化下生成一个不稳定的二酮中间体[41-42],随后在3-酮还原酶(orf26)的作用下转化成dTDP-4-酮-2,6-双脱氧-D-苏式-葡萄糖,即榴菌素的糖基——dTDP-4-酮-D-苏式-己酮糖(dTDP-4-keto-D-thero-hexulose)[43]。
榴菌素的生物活性引起人们对其作用机理进行深入的探讨,在抑菌活性的研究中,Kersten 等[50]和Kersten 等[51]通过榴菌素抑制尿嘧啶与RNA 的结合以及影响DNA 的体外试验,推断其能够抑制枯草芽孢杆菌DNA 和RNA 的合成;随后Ogilvie等[52-53]发现榴菌素主要通过,抑制亮氨酰tRNA 合成酶,干扰tRNALeu氨酰化,使细胞蛋白质和RNA合成受阻,从而间接抑制RNA 的合成抑制了枯草芽孢杆菌生长;随后Weiser 等[54]确定榴菌素B 与放线紫红素D 和链霉素(Streptolydigin)一样可以在体外抑制枯草芽孢杆菌DNA 依赖的RNA 合成,该抑制作用与Mg2+浓度成反比,与DNA 模板浓度成正比,同时他们认为在体内作用中,该抑制途径并不是榴菌素B 的唯一作用位点。Heinstein[48]在研究榴菌素对核糖体RNA 成熟的抑制性和细胞周期特异性时也认为虽然榴菌素能抑制KB 细胞的rRNA,但这并不是致死细胞的主要作用机制。在抗肿瘤活性的研究中,1981年Lopez 等[55]发现榴菌素可以抑制次黄嘌呤核苷酸形成黄嘌呤核苷酸;2007年日本的Iwasaki 等[56]报道榴菌素可以抑制修饰Ras 蛋白的法尼基转移酶,阻碍癌细胞信号转导通路。2008年任晓等[57]发现榴菌素抑制次黄嘌呤核苷酸的作用位点是抑制次黄嘌呤脱氢酶基因,该酶在癌细胞恶性增殖中发挥着重要作用,也是抗癌药物开发的靶标位点。
榴菌素B 是在榴菌素含有一个糖基的基础上,添加一个L-玫红糖(L-Rhodinose)。该糖基前期合成步骤与第一个糖基相同,在dTDP-4-酮-D-苏式-己酮糖形成后,脱氧酶(orf23)与辅酶磷酸吡哆胺(PMP)催化其形成一个中间产物,orf24可能编码一个还原酶辅助orf23 催化C-3 的脱氧反应,从而形成第二个中间体,然后再由orf23 催化形成dTDP-4-酮-2,3,6-三脱氧-D-苏式-己酮糖 (dTDP-4-keto-2,3,6-trideoxy-D-threo-hexulose)。orf24 的作用机理尚未完全阐明,根据研究推测其也可能作为一个调控基因负责榴菌素B 或者二氢榴菌素B 糖基分支的合成。脱氧反应后得到的dTDP-4-酮-2,3,6-三脱氧-D-苏式-己酮糖经表异构化酶(orf25)催化后,形成dTDP-2,3,6-三脱氧-4-酮-赤式-己酮糖,但这个过程的顺序也并未明确,dTDP-2,6-二脱氧-D-苏式-己酮糖(dTDP-2,6-dideoxy-D-threo-hexulose)和dTDP-2,3,6-三脱氧-D-赤式-己酮糖 (dTDP-2,3,6-trideoxy-D-glycero-hexulose) 都可作为表异构酶的催化底物,因此该步骤也可能是C-5 上的甲基先异构化生成dTDP-4-酮-赤式-橄榄糖(dTDP-4-keto-glycerol-olivose)后,再进行C-3 的脱氧。最终dTDP-2,3,6-三脱氧-4-酮-赤式-己酮糖在还原酶(orf22)作用下形成dTDP-L-玫红糖(dTDP-L-rhodinose)[44](图6)。

图6 榴菌素糖基以及榴菌素B 糖基的合成途径Fig.6 The biosynthesis of the sugar moieties of granaticin and granaticin B
榴菌素及其类似物具有抗菌、抗肿瘤和抗病原微生物等多种生物活性。对革兰氏阳性菌,如枯草芽孢杆菌、金黄色葡萄球菌具有较强的抗菌活性(MIC 0.25~1.75 μg/mL);对小鼠淋巴癌细胞P-388 细胞(T/C 166% 1.5 mg/kg)[19]、人口腔表皮样癌细胞株KB(ED503.2 g/mL)[48]、人类宫颈癌细胞海拉细胞(LC500.83 μmol/L)等肿瘤细胞具有较强的抗肿瘤活性[49];对禽瘟病毒、病原微生物等也具有一定的抑制作用;此外榴菌素还具有抑制许多致病菌的生物膜形成的潜力,由一组致病菌形成的生物膜及其对可用的抗生素的抵抗力是导致一些慢性和持续性感染的主要原因,榴菌素B 对预制生物膜和浮游细胞也具有较强的抑制活性[49]。

图7 榴菌素糖基推测的两种附着途径Fig.7 The two possible pattern of sugar attachment of granaticin
3.3 榴菌素及其类似物生物合成调控
研究生物合成基因簇及生物合成机制的根本目的是为了能够通过生物调控的方式提高榴菌素及其类似物的产量,为生物法工业化制备榴菌素及其类似物奠定基础。Deng 等[46]通过过表达环化酶基因,提高中间二环体的生产效率,从而提高榴菌素以及榴菌素B 的产量;Wang 等[47]通过转录组学和代谢组学分析聚酮化合物的初级代谢与次级代谢的关系,从而建立诱导表达质粒,大幅度提高聚酮化合物的产量。Sung 等[30]将榴菌素产生菌玫瑰球孢链霉菌与4 种人类病原体共培养,发现其可以诱导榴菌素、榴菌素B 等次级代谢产物的产生,提高其产量。目前,关于榴菌素及其类似物产量的提高和高效合成的关注度较低,以研究较为成熟的聚酮类化合物作为参考,借鉴其生物调控的研究方法及思路,来开展榴菌素及其类似物生物合成调控的研究,有效提高榴菌素及其类似物的产量,对该类化合物的工业化生产和合成机理的探索具有一定的意义和参考价值。
上述研究表明,跨文化交际学的“修辞转向”重申了通过承认不同主张、文化或个体来建立一个和谐社会或世界,而不是对文化差异摆出不加分辨的宽容态度的重要性。
4 榴菌素及其类似物的生物活性研究进展
4.1 榴菌素及其类似物的生物活性
在后期糖基化修饰时,dTDP-4-酮-D-苏式-橄榄糖通过两个碳碳单键附着在BIQ 发色基团上,人们对于其附着方式有两种猜想:一是糖基配体BIQ 发色基团的C-8 先进行羟基化,生成8-羟基-BIQ,在糖基转移酶(orf14)的作用下,dTDP-4-酮-D-苏式-橄榄糖的C-1′与BIQ 的C-9 之间生成第一个碳碳单键,随后通过分子内的羟醛缩合使得糖基配体环化,而后与BIQ 的C-10 与糖基的C-4′连接生成第二个碳碳单键;二是BIQ 发色基团先与dTDP-4-酮-D-苏式-橄榄糖发生分子间的羟醛缩合,糖基的C-4′与BIQ 的C-10 之间生成第一个碳碳单键,随后BIQ 的C-8 发生羟基化,最后在糖基的C-1′与BIQ 的C-9 之间发生分子内环化,形成第二个碳碳单键[24]。目前糖基的附着方式尚未完全明确,虽然根据研究推测第一种附着方式的可能性更大,但是该机制需要C-糖基转移酶识别糖苷配体也就是BIQ 发色基团的总体特征,否则将无法解释如何识别C-9 作为糖基附着位点。在第二种连接途径中,虽然参与连接反应的酶可能在BIQ 家族中没有同源物,但也不排除可能由榴菌素基因簇中未探明的基因所负责。因此,无论是双键连接的先后顺序还是第二个碳碳键的形成是否为自发性连接都还是榴菌素糖基化修饰的未解之谜,这些问题使得人们对榴菌素产生了强烈的研究兴趣[37]。邓名荣等[45]纯化了糖基转移酶,确认了其负责催化榴菌素B 糖基附着中碳碳键连接,通过对酶的催化活性位点、酶的结构的解析、基因敲除或过表达等手段来探索其对次级代谢合成的影响。
四十二岁那年,李白游到了京城,拜见了文坛高士贺知章。贺知章出于礼貌,随手翻阅着李白呈上的诗文。读到《蜀道难》时,老头登时被惊住,连呼“天纵奇才,下凡的谪仙!”。
在人们对榴菌素的探索中,还发现了许多榴菌素类似物,这些类似物也具有和榴菌素一样的生物活性。除了常见的榴菌素B、二氢榴菌素等,2015年Jiang 等[58]从紫红链霉菌(Strepomyces sp.CCPC200532) 中分离出6-脱氧-13-羟基-8,11-二酮-二氢榴菌素B(1)和A(2)(6-deoxy-13-hydroxy-8,11-dione-dihydrogrsnsticins B and A),其中化合物1 可以生物转化成榴菌素B,且对一些癌症细胞菌株具有毒活性。2019年Lü 等[59]从链霉菌166# 的发酵液分理出一种带有7 环结构的杂化聚酮络合物sekgranaticin,并阐明了其相关的合成机制。
“王老师,徐姗回来了!”我班的语文老师兴致冲冲的对我说道。我没有见过徐姗,心里却一直勾勒这这位学生的样貌,是怎样的学生能引起老师如此的关爱呢?我不知道她转回我班的消息是否可靠,直到后来她父亲带着她来我办公室报名,徐姗的确是转回来了。初见徐娅,是一个大眼睛、漂亮的小姑娘!
结合历史来看,印刷技术的每一次进步,都为文化产品带来了更多的机遇。如何应用新的印刷技术,将数字与纸质完美融合并长久保留,是个课题。比如,自然、科技类出版物如果用上AR等数码技术会更形象生动,但怎样在纸面上进行长久保留,这就对大数据的建立有更高的要求。业内已有先行企业像同昆数码,正展开这方面的研究。
4.2 榴菌素及其类似物的应用前景
早期由于榴菌素类化合物具有较大的细胞毒活性,所以对其药用价值并没有进行深入评估。随着研究的发现,榴菌素以及类似物的生物活性不断被挖掘,其可作为氨酰tRNA 合酶、法尼基转移酶、黄嘌呤核苷酸脱氢酶等多个药物靶标酶抑制剂,以其作为先导化合物,开发改造获得低毒的衍生物具有良好的前景[2],而且随着不断有新的榴菌素类似物的发现,成药选择更为全面,成药性也逐步被挖掘。2016年Kunnari[60]将榴菌素B 与甲醇和丙醇混合形成结晶型A,经临床试验证明新的结晶形式榴菌素B 可以作为一种制药成分治疗增生性疾病如急性髓性白血病、慢性淋巴细胞白血病、甲状腺癌等。2017年Ramachandran 等[61]在研究沙眼衣原体的致病因子巨噬细胞感染性增强因子(Macrophage infectivity potentiator,Mip)时,利用药效团模型和分子对接模拟来发现Mip 抑制剂,发现榴菌素是先导化合物的首选。2017年郑智慧等[62]发现榴菌素及其同分异构形式和结构类似物可以抑制吲哚胺2,3 双加氧酶(IDO)和色氨酸2,3-双加氧酶(TDO)。将榴菌素化合物与一种或多种药学上可接受的载体、赋形剂或稀释剂混合,可用于预防或治疗由IDO 和/或TDO 引起的色氨酸代谢相关的病理学特征的疾病,如肿瘤免疫逃逸、神经系病症和心血管疾病等。榴菌素以及类似物成药性的开发说明了其作为一种高生物活性的化合物具有深远的研究价值和广泛的应用前景。
5 展望
榴菌素作为BIQ 家族中的一员,在抑菌、抗肿瘤方面具有良好的功效。随着对榴菌素研究的深入,其应用潜力和药用价值逐渐被挖掘。榴菌素能抑制并攻击发挥肿瘤细胞活性的靶标酶,阻断肿瘤细胞的信号传导,抑制病原微生物以及生物膜的形成。从已知已测序的榴菌素合成基因簇片段分析,其片段大小在36~40 kb 左右,相对于大环内酯类抗生素基因簇,小片段的榴菌素的遗传操作更为简便,更有利于进行代谢工程的改造。对于抗生素的改造和大批量生产上具有一定的意义。
1.2.2 观察组。采用低温等离子射频法切除扁桃体:使用低温等离子刀头(成都美创MC-GZ310,MC401),将切割调至6档,凝血调至3档后使用消融刀头面向包膜侧,后用刀头分离扁桃体,遇血管采用低温等离子电凝止血。术后给予抗感染及止血治疗,饮食由流质逐渐过渡至半流质,4~6 d出院。
榴菌素研究至今,其基因簇上还存着一些功能未知的基因,代谢途径中二环中间体的后期修饰并未完全阐明,特别是特殊的糖基附着方式和作用也尚未清晰。糖基化修饰在天然产物中具有重要作用,可能赋予或抑制了天然产物的生理活性。糖基附着机制以及后期修饰机制的探索是榴菌素研究与改造的重点和难点。本文通过概述榴菌素结构、活性、合成机制和应用,阐明了榴菌素研究的现状和价值,为榴菌素的深入探讨、改造和利用提供理论基础和指导方向,为BIQ 化合物代谢工程的研究和开发提供思路和见解。

