发酵香肠制作过程中菌群演替及挥发性风味成分变化规律
张香美,叶 翠,卢 涵,裴正钰,闫洪波
(河北经贸大学生物科学与工程学院 石家庄 050061)
发酵香肠是经微生物发酵而成的具有典型发酵香味的肉制品。微生物菌群的变化是影响发酵香肠品质的关键。研究发酵过程微生物菌群结构、相对丰度的变化和挥发性香气成分的变化规律,对于发酵香肠制品质量的稳定和品质的提升具有重要意义。Lin 等[1]用高通量测序和GC-TOF-MS、UPLC-QTOF-MS 分析老挝火腿不同成熟阶段微生物群落和代谢产物之间的关系。高通量测序技术可较为准确地分析样品中不同分类水平的微生物的组成[2]、相对丰度等信息[3-4]。气相色谱-离子迁移谱技术(Gas chromatography-ion mobility spectrometry,GC-IMS) 是近年出现的一种新兴的风味物质分析手段,可用于食品特征风味有机挥发组分的快速检测、识别。Liu 等[5]用该方法分析了特定老化时间金华火腿的特征香气成分。Tian 等[6]用电子舌和顶空-GC-IMS 分析不同盐含量的干腌猪肉的风味成分,均呈现出非常好的区分度。
本研究旨在通过高通量测序技术研究植物乳杆菌-腐生葡萄球菌双菌种发酵香肠制作过程中微生物菌相的演替规律,用GC-IMS 检测不同阶段发酵香肠挥发性风味成分,建立发酵香肠制作过程中菌群和挥发性风味成分的关系,为生产高质量发酵香肠提供参考。
1 材料与方法
1.1 材料与仪器
新鲜猪肉购于石家庄市北国超市;植物乳杆菌b-2(CGMCC No.13413)和腐生葡萄球菌sw50由河北经贸大学益生菌实验室分离并保存。
E.Z.N.A.®soil 试剂盒,美国Omega Bio-tek公司。
Flavour-Spec®气相色谱离子迁移谱联用仪,德国G.A.S.公司。
1.2 方法
1.2.1 发酵剂的制备 分别吸取活化好的植物乳杆菌b-2 和腐生葡萄球菌sw50 接种到MRS 和LB 液体培养基中37 ℃培养24 h,6 000 r/min,4℃离心10 min 收集菌体,洗涤2~3 次,用无菌生理盐水重悬制备菌悬液,调整菌体密度为109CFU/mL。
1.2.2 发酵香肠的制备 将新鲜猪肉用绞肉机绞碎,按照肥瘦比为1∶4(质量比)进行混合,加入食盐2.5%,白糖2.5%,发色剂0.2%,充分混匀。将活化好的植物乳杆菌b2 和腐生葡萄球菌sw50 按107CFU/g 肉的比例接种,其中两菌接种比例为1∶3,灌入肠衣内,置于培养箱37 ℃发酵30 h。
1.2.3 菌群高通量测序分析 采用E.Z.N.A.®soil试剂盒提取不同发酵时间香肠样品的总DNA。DNA 纯度 (A260nm/A280nm、A260nm/A230nm) 及浓度采用NanoDrop 2000 进行检测。样本送深圳微生态科技有限公司,采用338F-806R 为引物对V3~V4 区进行PCR 扩增,根据Illumina MiSeq 平台(Illumina,圣地亚哥,美国)标准操作规程将纯化后的扩增片段构建PE 2*300 的文库。利用Illumina 公司的Miseq PE300 平台进行测序,每组设5 个重复。
测序结束后,运用QIIME2 feature-classifier插件将ASV 的代表序列比对到99%相似度的GREENGENES 数据库,得到物种分类信息表[7]。
1.2.4 挥发性风味物质的测定 分别对不同发酵时间(0,6,12,18,24,30 h)的发酵香肠进行采样,保存于-70 ℃。挥发性风味物质的测定采用FlavourSpecR气相离子迁移谱联用仪。取2 g 样品于20 mL 顶空进样瓶中,自动进样器参数设置为:顶空瓶孵化温度40 ℃,孵化时间15 min,孵化速度500 r/min,进样针温度85 ℃,进样体积500 μL,每个样品设3 个重复。
气相色谱相关参数为:色谱柱FS-SE-54-CB-1(15 m×0.53 mm),色谱柱温度:60 ℃,载气:N2,运行时间:30 min,载气起始流速2 mL/min,保持2 min,2~10 min 增至10 mL/min,10~20 min 增至100 mL/min,20~30 min 增至150 mL/min。
1.2.5 数据处理 高通量测序试验数据均采用平均值,用GraphPad Prism 8.02 作图。采用GCIMS Library Search 软件对挥发性风味物质进行定性分析。运用Laboratory Analytical Viewer(LAV) 分析软件中Reporter 和Gallery Plot 插件构建挥发性风味物质的指纹图谱。
2 结果与分析
2.1 发酵香肠生产过程中微生物群落结构分析
为了研究发酵香肠样品物种组成,对所有样品的全部的有效序列进行聚类/去噪,形成操作分类单元(Operational taxonomic unit,OTU),也称特征序列。选取OTU 的代表性序列,与核糖体RNA 数据库(Greengenes database 13_8)进行比对获得物种注释信息。根据OTU 划分和分类地位鉴定结果,从属水平分析不同阶段发酵香肠中微生物种群的结构,可以获得不同发酵香肠样本在属水平的具体微生物组成及丰度,结果见图1和2。
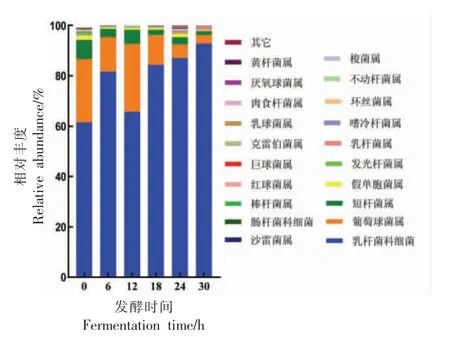
图1 优势菌属在不同发酵阶段样品中的相对丰度Fig.1 Relative abundance of dominant bacteria in samples at different fermentation stages
如图1所示为注释到属水平的序列数目占总注释数据的比率。通过对细菌群落中主要优势菌属(前20 位)进行分析,发现在发酵香肠成熟过程中,不同阶段的菌群结构存在一定差异。在各发酵阶段,乳杆菌科(Lactobacillaceae)细菌均占据绝对优势,其相对丰度为61.50%~92.81%;其次是葡萄球菌属(Staphylococcus),相对丰度为3.22%~26.83%;再次是短杆菌属(Brevibacterium),相对丰度为1.76%~7.62%,这与对发酵香肠样品中的乳酸菌和葡萄球菌活菌数测定结果一致。Quijada等[8]对干发酵香肠的微生物群落的研究也发现乳杆菌属占主导,为65.1%~92.0%。16S rDNA V3~V4 菌群高通量测序可以对微生物的多样性和种群分类进行分析,反映菌群的特征信息,然而由于测序长度仅400 bp,故具有一定的局限性。
通过对不同发酵阶段优势菌属丰度进行比较可以看出,乳杆菌科细菌在30 h 时占比最高,达92.81%;葡萄球菌属细菌在12 h 相对丰度增至最高,为26.83%,然后逐渐下降;短杆菌属细菌在初始阶段丰度最高,为7.62%,然后呈先下降后上升又下降趋势。
如图2所示,热图可直观地反应微生物的相对丰度变化情况,颜色越深,说明在属水平上的微生物比其它样品中的相对丰度更高。从图2可以看出,在0 h,源于发酵菌种的接入,乳杆菌科和葡萄球菌属占优势。在发酵初期,相对丰度高的除了乳杆菌科和葡萄球菌属外,还有短杆菌属、假单胞菌属(Pseudomonas)、发光杆菌属(Photobacterium)和环丝菌属(Brochothrix)。环丝菌属和假单胞菌属均是生鲜肉类中常见的腐败菌[9],假单胞菌属和发光杆菌属均与冷鲜猪肉的腐败有关[10]。随着发酵过程中菌群演替的推进,乳杆菌科细菌相对丰度逐渐上升,发光杆菌属和环丝菌属相对丰度逐渐下降,说明发酵菌种的接入抑制了腐败菌,进而保障了发酵香肠的品质。

图2 不同发酵阶段样品中微生物属分类水平热图Fig.2 Heat map of genus classification level of microorganisms in samples at different fermentation stages
2.2 不同发酵阶段香肠挥发性香气成分组成变化分析
2.2.1 不同发酵阶段香肠整体挥发性风味物质分析 GC-IMS 为挥发性香气成分提供了可视化结果。不同发酵阶段香肠香气成分离子迁移谱图如图3所示,纵坐标为气相保留时间,横坐标为离子迁移时间,横坐标1.0 处红色竖线为反应离子峰(Reaction ion peak,RIP);RIP 峰两侧的每一个点代表一种挥发性有机化合物。颜色表示物质的浓度,颜色越深、面积越大表示含量越大[11]。不同发酵阶段香肠样品中的挥发性风味化合物的差异主要表现在离子峰的位置、数量、强度及时间上。从图3中可得出:6 个不同发酵时间香肠中的挥发性组分可通过GC-IMS 技术很好地分离,不同发酵阶段香肠具有各自不同的GC-IMS 特征谱信息。各发酵阶段香肠挥发性风味化合物含量及种类都有较大差异。在发酵过程中,伴随着菌相变化以及各成分之间的生物化学反应,部分挥发性香气成分的浓度增加,并且还产生了一些新的物质。
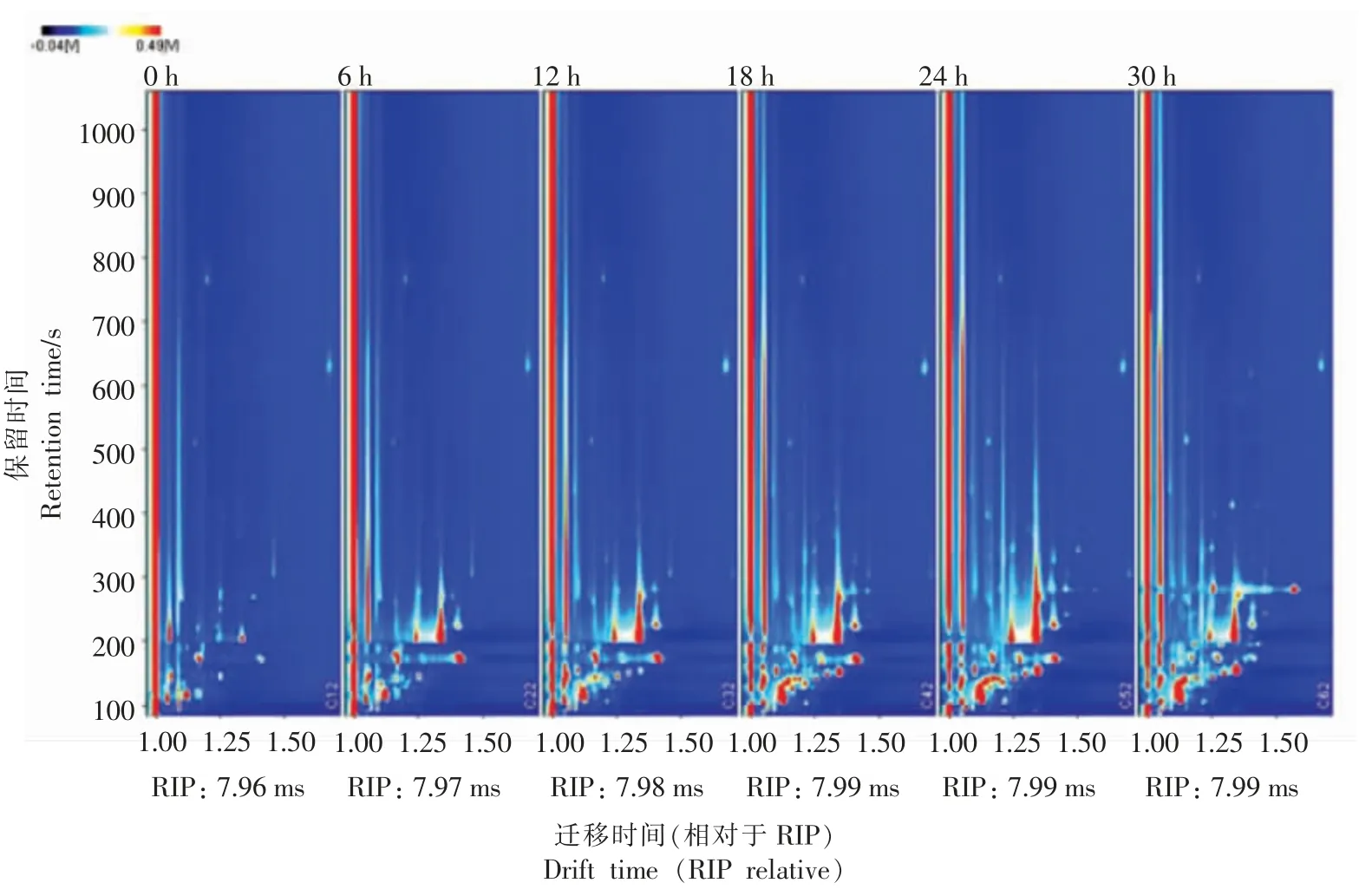
图3 不同发酵阶段香肠气相色谱-离子迁移谱图Fig.3 Gas chromatography-ion migration spectra of sausage at different fermentation stages
2.2.2 发酵香肠挥发性风味物质定性分析 对挥发性香成分的定性分析结果表1所示,在发酵香肠中识别出了27 种挥发性有机物,包括9 种醛类、5 种酯类、5 种醇类、4 种酮类、2 种酸类、1 种烷烃类和1 种吡嗪类。醛类主要来源于脂肪氧化,具有较低的阈值,是发酵香肠中重要的挥发性风味化合物,它还可进一步与其它化合物反应生成调味物质[12]。样品中鉴定出的醛类物质主要有:3-甲基丁醛、2-甲基丁醛、戊醛、乙缩醛、己醛、糠醛、辛醛。其中,3-甲基丁醛和2-甲基丁醛是高香味活性值的风味物质,3-甲基丁醛呈巧克力、麦芽香,与含硫化合物反应时可生成一种类似培根的风味[13],是香肠风味的主要贡献者之一,2-甲基丁醛具有黄油、焦糖风味[14]。戊醛和辛醛分别具有脂香、鲜草香味[15],糠醛呈甜香、木香、焦糖香[16],而己醛具有生的油脂和青草气及苹果香味[17]。Shi 等[18]的研究发现,己醛、3-甲基-丁醛和辛醛也是大河乌猪干腌火腿的特征化合物。乙缩醛是一种重要的挥发性风味化合物,在发酵蓝莓酒[19]和食用花朵[20]中均有检出,然而其风味还有待进一步确认。

表1 发酵香肠样品挥发性物质定性分析Table 1 Qualitative analysis of volatile substances in fermented sausage samples
酯类物质是由于酸和醇通过酯化作用所形成的,对发酵香肠香气的形成具有重要作用,样品中检出了3-甲基丁酸乙酯、乙酸乙酯、γ-丁内脂和乙酸正丙酯,其中乙酸乙酯具有醚香、果香气味,且呈味阈值低[21];3-甲基丁酸乙酯呈甜香、脂香味,周慧敏等[22]在添加了葡萄球菌的腊肉中检测到了该种物质;γ-丁内酯具有牛奶、奶油的气味,赵冰等[23]在特级金华火腿中检测到了该类挥发性风味物质。
醇类主要赋予食品植物香味和芳香味,发酵香肠中的醇类物质主要来源于脂质降解,通常不饱和脂肪醇阈值较低,对风味具有潜在促进作用[24],其它醇类物质风味阈值较高,对整体风味影响较小。如图3和表1所示,样品中检出了乙醇、1-辛烯-3-醇、正己醇和异戊醇等。1-辛烯-3-醇来源于脂质氧化,具有蘑菇味,且气味阈值较低,是发酵香肠中的重要风味物质[25]。
酮类物质在发酵肉制品中起到增强风味的作用,主要来源于β-酮酸脱羧或游离脂肪酸的不完全β 氧化和氨基酸类物质的降解。2-丁酮是多种发酵肉中的主要风味物质[26-27]。2-丁酮、2-庚酮具有香蕉、奶酪及轻微的药香[28]。
酸类物质可以提高产品的风味复杂性,促进发酵香肠形成其独有的感官风味特点。样品中检测出了丁酸和异戊酸。丁酸是一种重要的风味物质,曹辰辰等[15]的研究结果表明,接种植物乳杆菌CD101 和模仿葡萄球菌NJ201 组的丁酸含量显著高于对照组和接种商业发酵剂组。
吡嗪类化合物主要呈现豆豉、坚果风味[29],被认为是许多食品中的关键风味成分。本样品中检测出了三甲基吡嗪,该杂环化合物通常会产生令人愉悦的烤肉味、坚果味、烤玉米味等香气气味[30]。
由于烷烃类阈值很高,对改善风味作用甚微,故未列入主要挥发性风味物质。
2.2.3 发酵香肠不同阶段挥发性物质GC-IMS 指纹图谱分析 为比较不同阶段发酵香肠之间挥发性风味化合物的差异,用GC-IMS 二维图谱中所有谱峰重构指纹图谱,以识别不同阶段发酵香肠的特征峰区域[31]和香肠发酵过程中挥发性香气成分的变化规律。
图4是不同阶段发酵香肠中挥发性风味化合物的指纹谱图,每一行代表香肠样品中选取的全部信号峰,每一列代表同一挥发性有机物在不同样品中的信号峰。由指纹图谱可知:挥发性化合物会随着发酵进程而变化。随着发酵时间的延长,香肠中大部分挥发性物质的浓度逐渐增高,如乙缩醛、乙酸乙酯、3-甲基丁酸乙酯、丁酸、异戊酸、乙醇、己醇、己醛、戊醛、丙酮、2-丁酮、2-庚酮、三甲基吡嗪、3-甲基丁醛、2-甲基丁醛等,这种浓度增高的趋势在前4 个阶段变化比较快,随后变化放缓;小部分挥发性物质在发酵过程中浓度降低,如乙酸正丙酯、糠醛、γ-丁内酯等物质。

图4 不同发酵阶段香肠样品挥发性物质指纹图谱Fig.4 Fingerprint of volatile substances in sausage samples at different fermentation stages
在初始阶段,挥发性香气成分主要是乙酸正丙酯、糠醛、γ-丁内酯以及呋喃酮。发酵6 h,乙缩醛单体、丙酮、乙缩醛二聚体、2-庚酮以及3-甲基丁醛、2-甲基丁醛逐渐增多;丁酸、乙醇在发酵12 h 显著增多;经过18 h 发酵,乙酸乙酯、异戊酸、3-甲基丁酸乙酯逐渐生成;发酵24 h,3-甲基丁酸乙酯二聚体、正己醇逐渐生成;发酵结束阶段,1-辛烯-3-醇、异戊醇、丙酮、三甲基吡嗪、乙酸乙酯、异戊酸、3-甲基丁酸乙酯、3-甲基丁醛成为主体。在发酵的前期,以醛、酮等的合成为主,发酵中期酯类物质逐渐增多,1-辛烯-3-醇、三甲基吡嗪在后期达到高峰。酯类化合物是发酵香肠中重要的挥发性化合物,主要来源于微生物酯酶催化的短链酸与醇的酯化反应[32],在发酵后期合成。本发酵香肠中的酯类物质在发酵18 h 开始形成,在发酵结束时达到高峰。
由于GC-IMS 技术起步较晚,标准的挥发性有机物数据库不完善,本批样品中17 种重要挥发性风味成分未能很好地解析。
2.3 不同阶段发酵香肠菌群结构与挥发性香气成分的关系
采用Pearson 相关性分析法对微生物菌群数据和关键风味物质的相关性进行深度分析和挖掘,分别找到与关键挥发性风味物质高度相关的微生物种类,为解析发酵香肠制作过程中的功能微生物提供数据支持,如图5所示。
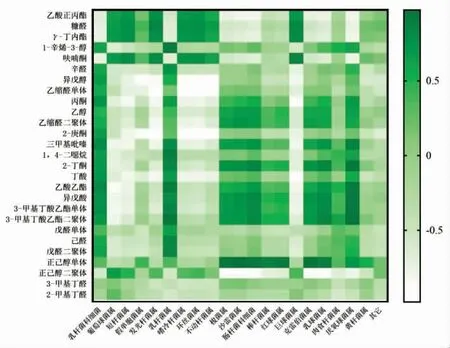
图5 属水平优势菌群与挥发性香气成分相关关系分析热图Fig.5 Heat map of correlation analysis between dominant flora at genus level and volatile flavor components
乳杆菌科、乳杆菌属、厌氧球菌属与辛醛、异戊醇、己醛的合成呈正相关。乳杆菌科、乳杆菌属、厌氧球菌属(Anaerococcus)和肉食杆菌属(Carnobacterium) 与1-辛烯-3-醇的合成呈正相关。Lü 等[33]的研究也发现酸肉中的己醛、1-辛烯-3-醇、辛醛是由乳杆菌属产生的主要挥发性化合物。乳杆菌科细菌、乳杆菌属、肠杆菌科(Enterobacteriaceae)、乳酸球菌属(Lactococcus)、厌氧球菌属与三甲基吡嗪、2-丁酮、丁酸、乙酸乙酯、异戊酸、3-甲基丁酸乙酯、3-甲基丁酸乙酯二聚体的合成呈正相关。可见,乳杆菌科细菌与1-辛烯-3-醇、三甲基吡嗪、乙酸乙酯以及己醛、辛醛和2-丁酮等风味物质的合成密切相关,刘英丽等[14]也有类似的报道。
葡萄球菌属、短杆菌属、发光杆菌属、嗜冷杆菌属 (Psychrobacter)、环丝菌属、不动细菌属(Acinetobacter)、巨球菌属(Macrococcus)与乙酸正丙酯、糠醛、γ-丁内酯、呋喃酮的生成呈正相关。葡萄球菌属、黄杆菌属(Flavobacterium)与2-甲基丁醛、3-甲基丁醛的合成呈正相关。于倩倩等[12]的研究也表明葡萄球菌产生大量支链醛。
葡萄球菌属与乙酸乙酯、三甲基吡嗪、丙酮等的合成呈负相关。乳杆菌科与乙酸正丙酯、糠醛、γ-丁内酯、呋喃酮的生成呈负相关。乳杆菌属与2-甲基丁醛、3-甲基丁醛的合成呈负相关。菌群的演替对挥发性香气成分的形成具有重要的影响,维持菌群结构的稳定对于高品质发酵香肠的生产具有重要的意义。
3 结论
为研究香肠发酵过程中菌群与挥发性风味成分的相关关系,采用高通量测序与GC-IMS 对不同发酵阶段的香肠进行菌群结构和挥发性香气成分联合分析。结果表明:在发酵过程中,乳酸菌科细菌始终占据绝对优势,其次是葡萄球菌属、短杆菌属。乳杆菌科细菌与1-辛烯-3-醇、三甲基吡嗪、乙酸乙酯以及己醛、辛醛和2-丁酮等挥发性风味物质的合成正相关,葡萄球菌属与2-甲基丁醛、3-甲基丁醛的合成呈正相关。在发酵初期,以醛、酮为主,发酵中期酯类物质逐渐增多,1-辛烯-3-醇、三甲基吡嗪在后期达到高峰。高通量测序得到的信息更接近于样品微生态,能够全面解析发酵香肠制作过程中的菌群演替,GC-IMS 可以用于发酵香肠挥发性风味的可视化检测,对不同发酵阶段产生的挥发性组分可以很好地进行区分。利用高通量测序和GC-IMS 阐明发酵香肠中的挥发性香气成分与菌群变化的相关关系,可以为生产高品质发酵香肠提供科学支撑,对进一步提高和改善发酵香肠品质具有重要的意义。本研究未对发酵香肠中的非挥发性香气成分进行测定,应进一步开展相关研究,从而更准确、更全面地分析风味化合物,助推发酵香肠品质提升。

